海南岛葫芦科蔬菜根结线虫种类鉴定
黄伟明, 陈绵才, 肖彤斌, 王会芳
(1.海南大学环境与植物保护学院,儋州 571737;2.海南省农业科学院农业环境与植物保护研究所,海口 571100)
根结线虫(Meloidogyne spp.)在农业生产中具有广泛的寄主,是影响农业经济发展的重要因素之一[1-2]。仅从形态学上来鉴定根结线虫的种类较为困难,根结线虫酯酶表型的出现,为根结线虫的分类提供了可靠的分类学特征[3-4]。Powers等描述了5种主要根结线虫在线粒体COⅡ和lrRNA之间的基因表现限制性扩增的多态性,为根结线虫的鉴定提供了分子生物学上的证据[5]。
海南岛地处热带,是全国重要的冬季蔬菜生产基地,根结线虫对蔬菜的为害有逐年加重趋势,给农业生产带来极大损失。由于海南岛地理和气候的特异性,蔬菜根结线虫可能存在种的变异,但未见系统鉴定的报道。本研究对采自岛内4地葫芦科蔬菜上10个根结线虫纯化系进行了形态观察和同工酶分析以及分子生物学鉴定,旨在明确该地区葫芦科蔬菜根结线虫的种类与分布,为当地蔬菜根结线虫病的有效治理提供理论依据。
1 材料与方法
1.1 供试线虫采集
线虫样本采自儋州、陵水、文昌和琼海4地显现根结症状的葫芦科蔬菜植株。将田间采集的线虫样本接种于感病品种番茄上,产卵后挑取单卵各纯化2盆,于温室中培养备用。
1.2 形态学鉴定
1.2.1 雌虫主要形态特征观察
观察头部特征、尾部特征等,共观测20条线虫。主要测计的指标为体长、最大体宽、口针长、DGO(背食道腺开口至口针基部球的距离)、口针基部球高、口针基部球宽、中食道球长、中食道球宽。
1.2.2 2龄幼虫(J2)形态观察及形态测计
观察头部特征、尾部特征等,共观测20条线虫。主要测计的指标为体长、最大体宽、口针长、DGO、口针基部球高、口针基部球宽、中食道球长、中食道球宽、尾长、透明尾长和a值(体长/最大体宽)。
1.2.3 会阴花纹的制作及观察
用挑针在体视显微镜下解剖根结,每个种群挑取成熟雌虫20条移入硬塑料板上清水滴中,剔除杂物并进行修切,清水中清洗3次,然后将包含完整会阴花纹且大小合适的角质膜转移到载玻片上,加盖玻片。干燥后,在显微镜下观察会阴花纹的形态特征并拍照。
1.3 同工酶分析
根结线虫的酯酶(Est)活性分析参照Esbenshade等的程序[6]。电泳分析采用DYY-13型电泳槽,7%聚丙烯酰胺胶,胶厚1.0 mm,每孔加入10条纯化培养的年轻雌虫酶提取物。后将同一胶在酯酶染色液中染色20~30 min至出现清晰的酶条带为止。以已鉴定的爪哇根结线虫(M.javanica)样本作为参照系。酯酶表型的命名按照Esbenshade等的方法[7]。
1.4 分子生物学鉴定
1.4.1 DNA提取
用纯化后的非南方根结线虫种群,挑取其卵块,用1%的次氯酸钠消毒30 s,然后在清水中30℃孵化5 d,用2 mL灭菌离心管收集孵化的J2悬浮液,5 000 r/min,离心4 min,去上清液。DNA提取方法参照美国Williamson[8]和廖金铃[9]所介绍的方法稍作修改,采用大量DNA提取法。用镊子将含J2的离心管投入液氮中30 s后,用与离心管配套的锥形研磨棒,直接用力研磨成粉末,加入700 μ L提取缓冲液(50 mmol/L Tris-HCl,pH7.5;50 mmol/L NaCl;5 mmol/L EDTA,pH8.0;0.5%SDS)和 7 μ L的20 mg/mL蛋白酶K,轻轻混匀;50℃水浴4~5 h;加入等体积的Tris饱和酚,轻轻混匀,12 000 r/min,4℃下离心10 min,取上清液转入另一灭菌的1.5 mL离心管中;加入等体积的氯仿/异戊醇(24∶1),轻轻混匀,12 000 r/min,4℃下离心10 min,取上清液转入另一灭菌的1.5 mL离心管中;加入1/10体积的3 mol/L醋酸钠(pH5.2)和2.5体积经预冷的无水乙醇,轻轻混匀,放入-20℃冰箱中放置2 h;12 000 r/min,4℃下离心10 min以沉淀DNA;沉淀物用75%的乙醇洗涤2次,待乙醇挥发完全后,将沉淀的DNA溶解于 20 μ L TE(10 mmol/L Tris-HCl,pH8.0,1 mmol/L EDTA)中;-20℃保存备用。
1.4.2 引物
利用 Powers等[5]设计的引物#C2F3和 #1108,所用引物的系列如下:5′-GGTCAATGTTCAGAAATT TGTGG-3′和 5′-TACCT T TGACCAATCACGCT-3′,分别位于线粒体 DNA中的 COⅡ基因和lrRNA基因,引物由上海生物工程有限公司合成。
1.4.3 反应体系
2.5 μ L 10×PCR 缓冲液;0.5 μ L dNTP(每一核苷酸为 10 μ mol/L);1 μ L 引物#C2F3;1 μ L 引物#1108;0.5 μ L 5U Taq 酶 ;无菌水 17.5 μ L;DNA悬浮液 2 μ L;共 25 μ L 。
1.4.4 扩增条件
94℃预变性4 min,94℃1 min,51℃1 min,70℃2 min,共35个循环,再在 72 ℃延伸10 min。
1.4.5 电泳
配制1.5%琼脂糖凝胶,待凝胶冷却至约55℃时,加入1.5 μ L Goldview 生物核酸染料,混匀后制胶 。取5 μ L PCR 扩增产物与1 μ L 6×DNA 载样缓冲液混匀上样;在1×TBE缓冲液中以8 V/cm电压电泳30 min。用凝胶成像分析系统分析照相。
2 结果与分析
2.1 测量结果
通过显微观察,对采自4个市县的10个纯化系进行初步的会阴花纹观察和形态学测量,发现有2种不同的会阴花纹。通过测量对比,初步鉴定为南方根结线虫(M.incognita)和象耳豆根结线虫(M.enterolobii)。象耳豆根结线虫雌虫梨形或球形,无后端突;头区和颈区分界不明显,唇盘圆盘状;口针纤细,略向背面弯曲;基部球粗大。J2线形,体前端平截,头区与虫体分离。测量数据中,除最大体宽(315~702)与Yang(375.7~809.7)[10]结果相比偏小,与卓侃(306.0~693.6)[11]测量的值相近,其余值基本相近。南方根结线虫雌虫虫体膨大,呈球形或梨形,有明显突出的颈部,唇区稍突起,略呈帽状;测量值与赵洪海[12]所测近似。
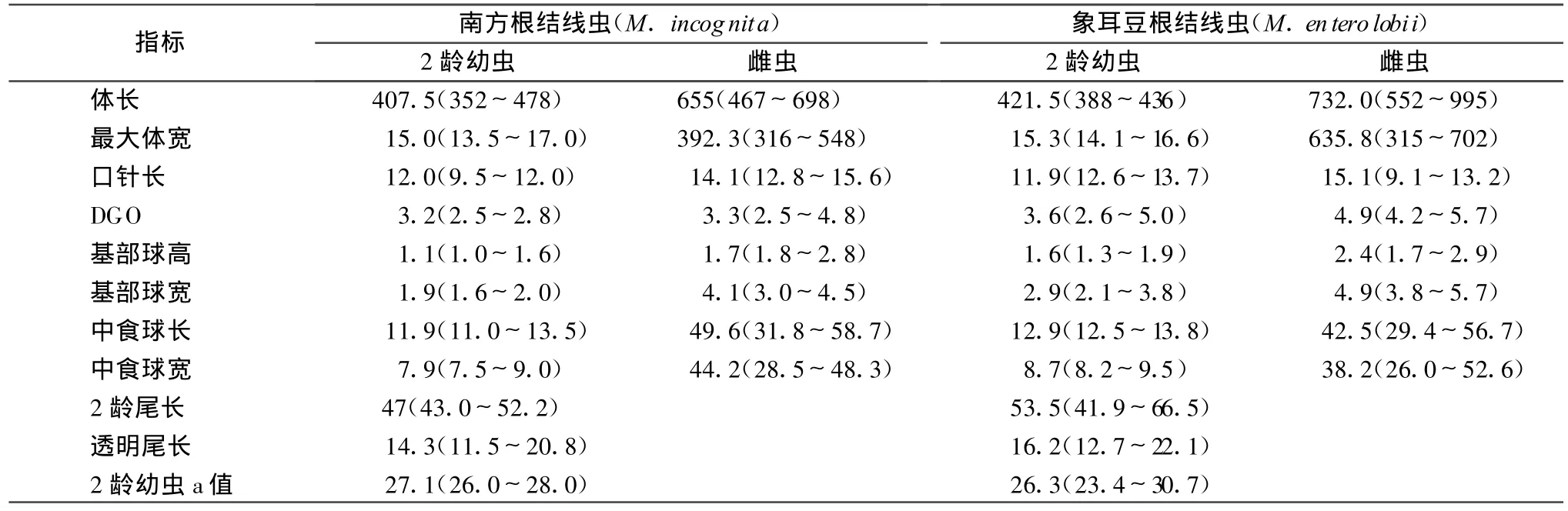
表1 病原根结线虫的形态学测量数据 μ m
2.2 会阴花纹观察
来自儋州、陵水、文昌和琼海4地根结线虫样本纯化出的10个种群中,主要有2种会阴花纹表型,其一主要特征为:整体呈卵圆形至椭圆形,线纹较平滑,背弓常较高,呈方形或近圆形;无明显侧线;阴门区一般无线纹,与刘昊[13]描述的象耳豆根结线虫会阴花纹形态一致。另一会阴花纹变异较大:花纹呈椭圆形或近圆形,通常背弓高,背弓顶部圆或平,有时呈梯形,背纹紧密:花纹背面和侧面的线纹呈波浪形或锯齿状,有的平滑,侧线不明显,侧面线纹有时分叉,与南方根结线虫的形态一致。
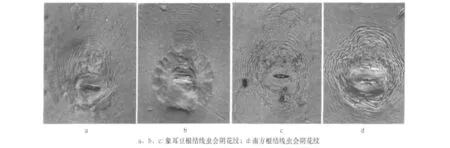
图1 海南岛葫芦科蔬菜根结线虫种群的代表性会阴花纹形态(400×)
2.3 同工酶分析结果
将分离纯化的10个种群进行同工酶分析,Est两条主要酶带,Rm分别约0.36和0.43,为VS1-S1型,其中 A2和B3中有纯化系 Est表型为I1型,Rm约在0.47(图2,表2)。同工酶表型在以往的研究中证明是可靠的根结线虫鉴定证据[7,13],因此可以断定,种群2和种群3是南方根结线虫与象耳豆根结线虫的混合种群,其余为象耳豆根结线虫纯种群。
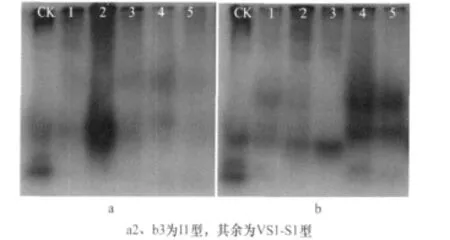
图2 葫芦科蔬菜根结线虫10个纯化系的Est电泳图

表2 海南岛葫芦科蔬菜根结线虫的Est表型分析
2.4 分子生物学分析
对5个样本的Est表型为VS1-S1型纯化系进行分子标记分析,结果如图3。用引物#C2F3和#1108扩增提取产物,电泳后可得到一在700 bp左右的条带。此结果与前人报道的象耳豆根结线虫获得的片段大小相同[11-13]。
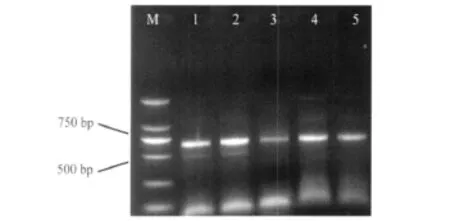
图3 象耳豆根结线虫5个纯化种群PCR产物电泳图
3 结论与讨论
本研究运用比较形态学、同工酶电泳和mtDNA-PCR相结合的方法对海南岛葫芦科蔬菜上的5个根结线虫种群进行鉴定,结果发现10个纯化系中,有2个为南方根结线虫,其余的为象耳豆根结线虫。在海南琼海的丝瓜、文昌的南瓜、陵水的葫芦和儋州的丝瓜上均发现了象耳豆根结线虫为害。据报道,海南地区的象耳豆根结线虫分布在海口、儋州、三亚、澄迈和琼海5个市县[10-11,13],此次研究结果增加了2个市县,分别为文昌和陵水;同时增加了2个新的寄主作物葫芦和丝瓜[13]。由此可见,象耳豆根结线虫在海南岛有逐步扩展的趋势,应引起相关部门的重视。
象耳豆根结线虫和南方根结线虫混合种群的出现,是否会导致种群的灾变,象耳豆根结线虫是否会成为继4个重要根结线虫种类后的又一重大根结线虫病原,还有待于进一步研究。
[1]Oka Y,Koltai,Bar-eyal H.New strategies for the control of plant-parasitic nematodes[J].Pest Mgmt Sci,2000,56:983-988.
[2]Karssen G,Moens M.Root-knot nematodes[M]∥Perry R N,Moens M.(Eds):Plant Nematology.CAB International,Wallingfo rd,UK :2006:59-90.
[3]Esbenshade P R,Triantaphy llou A C.Isozyme phenotypes for the identification of Meloidogyne species[J].Journal of Nematology,1990,22:10-15.
[4]Pais C S,Abrantes I M O.Esterase and malate dehydrogenase phenotypes for identification of Meloidogyne species[J].J Nematol,1989,21:342-346.
[5]Powers T O,Harris T S.A polymerase chain reaction method for identification of five major Meloidogyne species[J].Journal of Nematology,1993,25:1-6.
[6]Eisenback J D,Triantaphyllou H H.Root-knot nematodes:Meloidogyne species and races[C]∥Nickle W R.Manual of Agricultural Nematology.New York:M arcel Dekker,1991:191-274.
[7]Esbenshade P R,Triantaphy llou A C.U se of enzyme phenotypes for identification of Meloidogyne species[J].J Nematol,1985,17(1):6-20.
[8]Williamson V M,Caswell Chen E P,Westerdahl B B,et al.A PCR assay to identify and distinguish single juvenile of Meloidogyne hapla and M.chitwoodi[J].Journal of Nematology,1997,29(1):9-15.
[9]廖金铃.根结线虫的鉴定及其DNA多态性研究[D].广州:华南农业大学,2001:1-120.
[10]Yang B J,Eisenback J D.Meloidogyne enterolobii n.sp.(Meloidogy nidae),a root-knot nematode parasitizing pacara earpod tree in China[J].Journal of Nematology,1983,15:381-391.
[11]卓侃,胡茂秀,廖金铃,等.广东省和海南省象耳豆根结线虫的鉴定[J].华中农业大学学报,2008,27(2):193-197.
[12]刘维志.植物线虫志[M].北京:中国农业出版社,2004:392-393.
[13]刘昊,龙海,鄢小宁,等.海南省番石榴根结线虫病病原的种类鉴定及其寄主范围的测试[J].南京农业大学学报,2005,28(4):55-59.

