土壤放线菌的选择性分离及其代谢产物抗菌活性评价*
谭悠久, 彭 祎, 黄永春
(农业部环境保护科研监测所,农业部/天津市产地环境与农产品安全重点开放实验室,300191)
以放线菌为来源的抗生素研究一直备受关注,在放线菌代谢产物中发现的包括抗生素在内的大量新活性物质中约70%~80%是从链霉菌发现的[1-2]。虽然从链霉菌属发现新的生物活性物质从未间断过,但链霉菌属外的放线菌也是生物活性物质的重要产生菌[3-4]。近年来从链霉菌属外的小单孢菌属[5-6]、诺卡氏菌属[7-10]、小双孢菌属[11]、马杜拉放线菌属[12]、指孢囊菌属[13]、链孢囊菌属[14]、放线多孢菌属[15]、游动单孢菌属[16]、拟无枝菌酸菌属[17]、北里孢属[18]、Kibdelosporangium[19]等分离到多种生理活性物质,显示了代谢产物多样性的特点。
本文主要研究土壤样品中放线菌的选择性分离,以期分离到利用常规分离方法出菌率低的放线菌菌株,并对选择性分离得到的放线菌代谢产物进行抗菌活性评价。
1 材料与方法
1.1 材料
1.1.1 土壤样品
采自安徽、重庆、江苏、吉林、河北、湖北、山东、四川、天津、云南及德国莱比锡等地不同生态环境的45份土壤样品。
1.1.2 指示菌
1.1.3 培养基
放线菌分离培养培养基(改良的HV培养基):腐质酸 0.1%,K2HPO40.1%,NaCl 0.08%,Mg-SO40.05%,CaCO30.001%,复合维生素(维生素B1、核黄素 、烟酸 、维生素 B6、泛酸钙 、肌醇、对氨基苯甲酸各0.000 05%,生物素0.000 025%),土壤浸提液10%,琼脂2%。
放线菌斜面培养基:酵母膏 0.3%,蛋白胨0.5%,麦芽浸膏 0.3%,葡萄糖1%,琼脂2%。
真菌培养基:土豆汁 20%,加葡萄糖2%,琼脂2%。
细菌培养基:牛肉膏 0.3%,蛋白胨 1%,氯化钠0.5%,琼脂2%。
放线菌平板培养基:可溶性淀粉1.5%,酵母膏0.4%,K2HPO40.2%,MgSO40.05%,葡萄糖0.25%,蛋白胨 0.2%,玉米浆 1.2%,麦芽浸膏0.25%,复合维生素0.01%,琼脂2%。
放线菌发酵培养基:可溶性淀粉1.5%,酵母膏0.4%,K2HPO40.2%,MgSO40.05%,葡萄糖0.25%,蛋白胨 0.2%,玉米浆 1.2%,麦芽浸膏0.25%,复合维生素0.001%。
1.1.4 抑制剂
[3]《最新:2017U.S.News世界大学排名TOP200》http://www.sohu.com/a/117108180_479700
萘啶酮酸 20 μ g/mL,制霉菌素 50 μ g/mL 。
1.1.5 供试植物
日本天鹰椒(购自天津农科院)。
1.2 方法
1.2.1 样品采集、预处理、菌株分离
从土壤表面采集土层,用速封袋装好,带回实验室,迅速将土壤样品风干,研磨成粉,用前100℃干热处理60 min。称取约1 g预处理土壤样品,加入无菌试管,加10 mL灭菌水,充分振荡,10倍系列稀释,取200 μ L涂布平板,28℃倒置培养15~25 d,用接种针挑取单菌落于斜面培养基培养。
1.2.2 放线菌代谢产物抗菌活性平板初筛
从斜面挑取放线菌菌落,于培养皿内画线,28℃倒置培养14 d;用直径5 mm的打孔器打制带菌落的琼脂块,依次将琼脂块等距接到混有指示菌的直径为15 cm的培养皿中,每个培养皿接40个不同的放线菌菌株;25℃培养2~3 d,观察抑菌情况,测量抑菌圈直径。
1.2.3 放线菌抗菌活性复筛
挑选经初筛抑菌活性较强的菌株,从斜面刮取成熟孢子,接入发酵培养基中(250 mL三角瓶装液量50 mL),200 r/min,28℃培养5 d,离心取上清液备抗菌活性检测;抗菌活性检测采用管碟法[20]。
1.2.4 对辣椒疫霉的保护作用
取4叶期辣椒苗(每盆30棵苗),均匀浇灌发酵液原液,48 h后将辣椒疫霉菌的孢子悬浮液(孢子浓度106个/mL)灌根,每处理4次重复,以清水为对照,7 d后调查病情和防治效果,试验重复2次。数据进行5%水平上的差异显著性分析。
2 结果
2.1 放线菌的选择性分离
从45份土壤样品中共选择性地分离到570株放线菌菌株,平均每份土壤分离到约12.7个菌株,堆肥中菌株分出率最高,其次为旱地、矿渣,灰烬和海泥分出率较低。分离效果见表1。经鉴定,分离到的放线菌菌株分别属于链霉菌属、小单孢菌属、诺卡氏菌属、小双孢菌属、马杜拉放线菌属、放线多孢菌属、游动放线菌,但仍以链霉菌属菌株居多。

表1 不同土壤样品分离效果
2.2 放线菌代谢产物抗菌活性初筛
对570个放线菌菌株进行了琼脂块初筛评价。结果显示,212个菌株代谢产物显示了抗真菌或抗细菌活性,占总菌株数量的37.2%,33个菌株代谢产物兼具抗真菌活性和抗细菌活性,占菌株数量的5.8%;77个菌株代谢产物对黑曲霉有抑制作用,占菌株总数的13.6%;57株菌代谢产物对棉花枯萎菌有抑制作用,占菌株总数的10.0%;55个菌株代谢产物对稻瘟病菌有抑制作用,占菌株总数的9.7%;137个菌株代谢产物对辣椒疫霉有抑制作用,占菌株总数的24.2%;59个菌株代谢产物对青枯菌有抑制作用,占菌株总数的10.4%。
2.3 放线菌抗菌活性复筛
经平板琼脂块初筛,挑选出12株对部分指示菌具有较强抑制作用或具有广谱抗菌活性的菌株进行复筛,复筛结果见表2。有4个菌株(TJ211、TJ231、TJ234、TJ430)发酵液对所有指示菌具有抑制作用,但以TJ231、TJ430菌株抑制效果最明显;1个菌株(TJ561)发酵液对所有指示真菌具有强烈的抑制效果,但无抑制细菌作用。
2.4 菌株发酵液对防治辣椒疫霉病的保护效果
将通过摇瓶复筛获得的3株具有较强抗真菌活性的菌株摇瓶发酵,进行活体防效评价。结果见表3,菌株 TJ231、T J430、TJ561对防治辣椒疫霉病的保护效果分别为56.2%、87.2%、61.4%。

表2 放线菌抗菌复筛结果1)
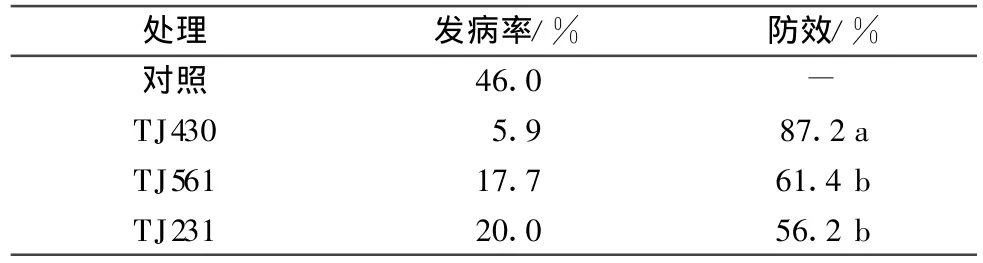
表3 发酵液对防治辣椒疫霉病的保护效果1)
3 讨论
有较多报道认为,土壤样品的来源决定了分离放线菌的数量与种类。链霉菌广泛分布于各种环境;小单孢菌也广泛分布于各种环境[21],但以稻田、草地、湖底为主;小双孢菌主要分布在植物体内,在红树林根围土壤也有分布[22];诺卡氏菌土生、水生,在河流、湖底和海洋沉积物中均有分布[23]。链孢囊菌属、游动单孢菌属在森林土壤中有分布[24]。因此,为保证样品来源的丰度,作者从不同地区的不同生态环境采集了土壤样品。风干土壤样品在100℃干热处理60 min,可以除去多数不耐热链霉菌,能有效分离链孢囊菌、小双孢菌、小四孢菌、马杜拉放线菌、小单孢菌、游动放线菌等稀有放线菌[25],因此为了减少常规链霉菌,提高稀有放线菌的分出率,本试验采用了100℃干热处理60 min的分离方法。采用含腐殖酸、维生素的HV培养基作为基础培养基,可以提高放线双孢菌、北里孢菌、小双孢菌、拟诺卡氏菌、游动放线菌、Longispora等很多未知放线菌的分出率[26]。从分离效果比较,虽然仍以分离到链霉菌为主,但也分离到包括小单孢菌、诺卡氏菌、小双孢菌属、马杜拉放线菌属、放线多孢菌属、游动放线菌等多种稀有放线菌。
通过平板琼脂块初筛,表明选择性分离到的放线菌是产抗菌活性物质的重要类群。复筛结果显示,多数菌株发酵液对病原菌的抑制效果基本与初筛结果相吻合。盆栽试验表明,摇瓶筛选与盆栽试验存在一定差异。菌株T J231、TJ561虽然在摇瓶筛选中对辣椒疫霉显示了强烈的抑制效果,但在活体防效并不明显。菌株TJ430则在摇瓶筛选与盆栽试验中具有良好的抑制效果和防效,显示了较好的开发应用前景,其代谢产物分析工作已经在实验室逐步展开。
[1]B é rdy J.Bioactive microbial metabolites[J].T he Journal of Antibiotics,2005,58(1):1-26.
[2]Osada H.An overview on the diversity of actinomy cete metabolites[J].Actinomycetol,2001,15(1):11-14.
[3]Lazzarini A,Cavaletti L,T oppo G,et al.Rare genera of actinomycetes as potential producers of new antibiotics[J].Antonie van Leeuwenhoek,2000,78:399-405.
[4]Takahashi Y,Omura S.Isolation of new actinomycete strains for the screening of new bioactive compounds[J].J Gen Appl Microbiol,2003,49:141-154.
[5]A ntal N,Fiedler H P,Stackebrandt E,et al.Retymicin,galtamycin B,saquayamycin Z and ribofuranosy llumichrome,novel secondary metabolites from Micromonospora sp.Tü 6368 I.taxonomy,fermentation,isolation and biological activities[J].The Journal of Antibiotics,2005,58(2):95-102.
[6]James B M,Arjun H B,Romila D C.Biosynthesis of diazepinomicin/ECO-4601,a Micromonospora secondary metabolite with a novel ring system[J].Journal of Natural Products,2008,71(9):1585-1590.
[7]Hoshino Y,Mukai A,Yazawa K,et al.T ransvalencin A,a thiazolidine zinc complex antibiotic produced by a clinical isolate of Nocardia transvalensis[J].The Journal of Antibiotics,2004,57(12):797-802.
[8]Sohng1 J K,Yamaguchi1 T,Seong C N,et al.Production,isolation and biological activity of nargenicin from Nocardia sp.CS682[J].Arch Pharm Res,2008,31(10):1339-1345.
[9]M ukai A,Fukai T,Matsumoto Y,et al.Transvalencin Z,a new antimicrobial compound with salicylic acid residue from Nocardia transvalensis IFM 10065[J].The Journal of Antibiotics,2006,59(6):366-369.
[10]Schneider K,Rose I,Vikineswary S,et al.Nocardichelins A and B,sideropho res from Nocardia strain acta 3026[J].Journal of Natural Products,2007,70:932-935.
[11]Okujo N,Iinuma H,George A.Bispolides,novel 20-membered ring macrodiolide antibiotics from Microbispora[J].T he Journal of Antibiotics,2007,60(3):216-219.
[12]Harada K,T omita K,Fujii K,et al.Isolation and structural characterization of sideropho res,madurastatins,produced by a pathogenic Actinomadura madurae[J].T he Journal of Antibiotics,2004,57(2):125-135.
[13]Tani M,Gyobu Y,Sasaki T,et al.SF2809 compounds,novel chymase inhibitors from Dacty losporangium sp.[J].T he Journal of Antibiotics,2004,57(2):83-88.
[14]Boudjella H,Bouti K,Zitouni A,et al.Taxonomy and chemical characterization of antibiotics of StreptosporangiumSg 10 isolated from a Saharan soil[J].Microbiological Research,2006,161:288-298.
[15]Huang S X,Zhao L X,T ang S K,et al.Erythronolides H and I,new erythromycin congeners from a new halophilic actinomycete Actinopolyspora sp.YIM 90600[J].Organic Letters,2009,11(6):1353-1356.
[16]Castiglione F,Cavaletti L,Losi D,et al.A novel lantibiotic acting on bacterial cell wall synthesis produced by the uncommon actinomy cete Planomonospora sp.[J].Biochemistry,2007,46:5884-5895.
[17]Zhang C W,Herath K,Jayasuriya H,et al.Thiazomycins,thiazolyl peptide antibiotics from Amycolatopsis fastidiosa[J].Journal of Natural P roducts,2009,72:841-847.
[18]Aida W,Ohtsuki T,Li X F,et al.Isolation of new carbamateor pyridine-containing natural products,fuzanins A,B,C,and D from Kitasatospora sp.IFM 10917[J].T etrahedron,2009,65:369-373.
[19]Ratnayake R,Lacey E,Tennant S,et al.Isokibdelones:novel heterocy clic polyketides from a K ibdelosporangium sp.[J].Organic Letters,2006,8(23):5267-5270.
[20]李青,刘华梅,陈振民,等.管碟法测定苏云金杆菌上清液中增效物质含量的研究[J].微生物学通报,2002,29(3):73-74.
[21]Qiu D H,Ruan J S,Huang Y.Selective isolation and rapid identification of members of the genus Micromonospora[J].Applied and Environmental Microbiology,2008,74(17):5593-5597.
[22]Xu X X,Hong K.Selective isolation of Microbispora from mangrove soil[J].Journal of Biotechnology,2008,136S:S75-S98.
[23]Yamamura H,Hayakawa M,Nakagawa Y,et al.Species diversity of Nocardiae isolated from lake and moat sediment samples[J].Actinomycetol,2003,17(2):44-46.
[24]Seong C N,Choi J H,Baik K S.An improved selective isolation of rare actinomycetes from forest soil[J].T he Journal of Microbiology,2001,39(1):17-23.
[25]姜怡,段淑蓉,唐蜀昆,等.稀有放线菌分离方法[J].微生物学通报,2006,33(1):181-183.
[26]Okazaki T.Intrigued by actinomycete diversity[J].Actinomycetol,2006,20(1):15-22.

