苯丙氨酸与对苯醌荷移反应的研究
宋秀丽,李省云,李改芬
(太原师范学院化学系,山西 太原 030031)
苯丙氨酸(phenylalanine)又称α-氨基化肉桂酸,化学全称为α-氨基-β-苯丙氨酸,它的应用领域比较广泛,如孟山公司开发了以苯丙氨酸及其衍生物为原料合成手性中间体技术[1]。目前,对于苯丙氨酸含量测定的分析方法主要有:电位滴定法[2]、脱氨酶法[3]、纸层析法[4]、荧光法[5]、双波长紫外吸收法[6]、双酶电极法[7]、毛细管电泳法[8]和 HPLC[9]等。利用对苯醌荷移光谱法测定苯丙氨酸含量的方法还未见报道。本文选用对苯醌为电子接受体,研究了苯丙氨酸与对苯醌形成荷移络合物的条件,探讨了反应机理,并对药物样品进行了含量测定,结果令人满意。
1 实验材料
CARY300紫外可见分光光度计(美国Varian);HH-6电热恒温水浴锅(北京科伟永鑫实验仪器设备厂);92M-202A-DR电子天平(普利赛斯国际贸易上海有限公司);210-酸度计(意大利Hanna)。
2 方法与结果
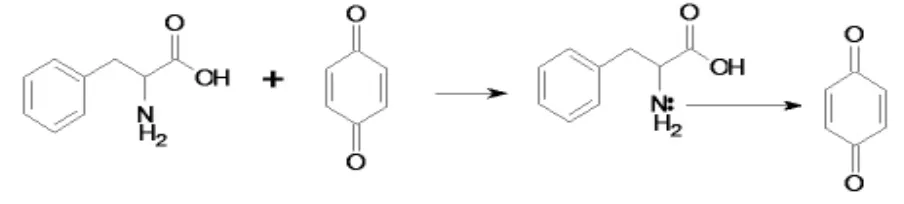
2.1 反应机理的探讨
苯丙氨酸分子内一个N原子上的孤对电子可作为电子给予体,对苯醌作为电子接受体,在水溶液中形成络合物。基于测得络合物组成比为1∶1,该荷移反应可表示如下:
2.2 溶液的制备
苯丙氨酸标准溶液:在电子天平上准确称取0.250 0 g苯丙氨酸(中国药品生物制品检定所)于250 mL的棕色容量瓶内,加水适量,振摇使苯丙氨酸溶解,用水稀释至刻度,摇匀配成浓度为1 g/L的溶液;对苯醌乙醇溶液:在电子天平上准确称取0.250 0 g对苯醌于250 mL的棕色容量瓶内,加无水乙醇适量,振摇使对苯醌溶解,用无水乙醇溶解稀释至刻度处,摇匀,配成浓度为1 g/L的乙醇溶液;三酸缓冲溶液:在100 mL三酸混合液(磷酸、乙酸和硼酸,浓度均为0.04 mol/L)中,在酸度计上,用0.2 mol/L NaOH溶液调节pH值为8.5;溴代十六烷基吡啶溶液:在电子天平上准确称取20.123 5 g溴代十六烷基吡啶,加500 mL水溶解,振摇至完全溶解即可。所用试剂均为分析纯,实验用水为超纯水。准确移取适量苯丙氨酸标准溶液于10 mL比色管中,加对苯醌乙醇溶液0.9 mL,加表面活性剂溴代十六烷基吡啶溶液2 mL,用三酸缓冲溶液稀释至刻度,摇匀,在90℃水浴中反应30 min,迅速冷却后,以试剂空白为参比,用1 cm石英比色皿,于339 nm处测其吸光度。
2.3 实验条件的选择
2.3.1 吸收光谱 按照实验方法,用紫外可见分光光度计在200 nm~500 nm之间扫描,并绘制吸收光谱图,结果见图1。由图1可以看出,苯丙氨酸与对苯醌形成的络合物在339 nm处一个有吸收峰,而苯丙氨酸在214 nm处有一个吸收峰,试剂对苯醌在259 nm和288 nm处有两个吸收峰。
2.3.2 溶剂的影响 选用不同的溶剂,按实验方法配制溶液,测定相应络合物的吸光度,结果表明,在水与甲醇中反应最好,二者吸光度接近,考虑到环境污染及价格问题,本实验采用水为溶剂。
2.3.3 温度和时间的影响 按实验方法进行,测定不同温度下不同反应时间络合物的吸光度。从结果可以看出,在80℃以下反应速度慢,在95℃时很快达到平衡,但吸光度值较小,而在90℃时,在30 min~80 min之间吸光度几乎不变,说明反应较彻底且到达平衡。本实验选用90℃和30 min。
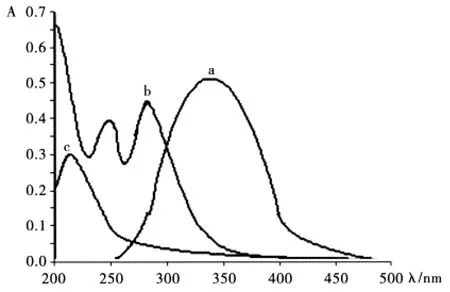
图1 吸收光谱图
2.3.4 酸度的影响 分别用pH值不同的三酸缓冲溶液,按照实验方法测定其吸光度。实验表明,在pH=8.5的三酸缓冲溶液中,背景的影响最小,吸光度较大,所以本实验选用pH=8.5的缓冲溶液。
2.3.5 试剂用量的影响 按照实验方法改变试剂对苯醌乙醇溶液的用量,结果表明,对苯醌的用量为0.9 mL时,吸光度最大。
2.3.6 表面活性剂的影响 按照实验方法配制溶液,分别加入不同的表面活性剂,测定其吸光度,结果表明,用溴代十六烷基吡啶溶液时吸光度较大且稳定,且溴代十六烷基吡啶溶液用量为2 mL时吸光度值最大。
2.4 重现性的试验
在选定的最佳条件下,以0.2 mL标准溶液按实验方法重复测定10次,计算得其相对标准偏差为2.4%。
2.5 络合物稳定性试验
在选定的最佳条件下,取适量苯丙氨酸标准溶液按照试验方法,测定吸光度后,每隔一定时间再测定其吸光度,结果表明该络合物在100 min内吸光度值基本不变,稳定性较好。
2.6 工作曲线的绘制
按实验方法,准确移取不同量的苯丙氨酸标准溶液,反应后测定络合物的吸光度,并绘制工作曲线,结果见图 2。苯丙氨酸含量在 20 μg/mL~60 μg/mL时符合比尔定律,线性回归方程为A=0.096 4+0.014 3C(C 的单位为 μg/mL),相关系数 R=0.999 2,表观摩尔吸光系数ε=2.4×103L/(mol·cm),桑德尔灵敏度 S=0.070 μg/cm2。
2.7 络合物组成的测定
用等摩尔连续变化法测定络合物的组成,结果表明,苯丙氨酸与对苯醌的络合比为1∶1。
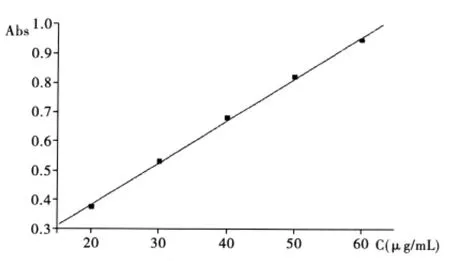
图2 络合物的吸光度工作曲线
2.8 样品的测定及回收率实验
2.8.1 样品溶液的配制 在电子天平上准确称取0.250 0 g苯丙氨酸(天津市大茂化学仪器供应站)于250 mL的容量瓶内,加水适量,振摇使苯丙氨酸溶解,用水稀释至刻度,摇匀,备用。
2.8.2 样品测定 准确移取0.2 mL样品溶液于10 mL比色管中,按实验方法测定吸光度,并计算苯丙氨酸的含量。另用药典法测定苯丙氨酸的含量,测定结果均列于表1中。经F检验,F=2.37<F(理论)=19,经t检验,t=1.58<t(理论值)=2.78,表明这两组数据比较差异无统计学意义,表明本方法与药典法测定结果一致。

表1 药典法与本法测定苯丙氨酸含量比较
2.8.3 回收率实验 按照样品测定方法,在样品中分别加入不同量的苯丙氨酸标准溶液,用标准加入法测定回收率。其测定结果见表2,回收率在99.7%~103.0%之间。
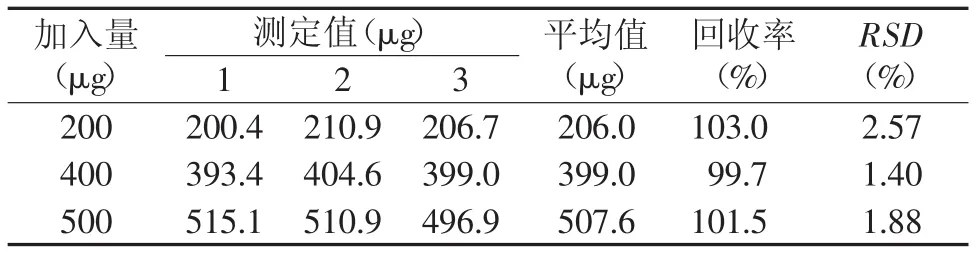
表2 回收率测定结果
3 讨论
苯丙氨酸是人体必需的八种氨基酸之一,在人体的代谢过程中具有重要作用。广泛应用于医药、食品和化工等行业。在食品行业中,苯丙氨酸与天冬氨酸缩合形成阿斯巴甜,已广泛应用于调味品功能性食品中,它还可以用于焙烤食品中强化了氨基酸且改善食品风味。在医药行业中,它是医药输液制品的必需成分,还是合成一些药物的原料或良好载体,如它是合成一些抗癌药物的中间体,其原理是根据肿瘤细胞对氨基酸的特殊要求,以氨基酸为载体,把抗癌药物的分子或基因载入肿瘤区,达到既能抑制肿瘤成长又能降低肿瘤细胞毒性的目的,也是生产肾上腺素、甲状腺素和黑色素的原料。我们选用对苯醌为电子接受体,研究苯丙氨酸与对苯醌形成荷移络合物的条件,结果表明,苯丙氨酸与对苯醌在pH=8.5的三酸缓冲溶液中,90℃水浴加热30 min,可以生成稳定的荷移络合物。此荷移络合物的λmax=339 nm,表观摩尔吸光系数ε=2.4×103L/(mol·cm),在 20 μg/mL~60 μg/mL 的范围内符合比尔定律,用这种方法测定的样品含量,结果与文献方法一致。
[1]李翼新,张超.L-苯丙氨酸生产及应用研究进展[J].氨基酸和生物资源,2006,28(2):51-56.
[2]国家药典委员会.中华人民共和国药典(二部)[M].北京:化学工业出版社,2000:364-365.
[3]范长胜,胡宝龙,杨仁根.苯丙氨酸的脱氨酶法测定[J].氨基酸和生物资源,1995,17(3):33-35.
[4]吴文彦.血清中苯丙氨酸的纸层析测定法[J].遗传学报,1979,6(1):154.
[5]Yamaguchi A,Mizushima Y,Fukushi M,et al.Microassay system for screening newborn for galactosemia with use of a fluorometric microplate reader[J].Screening,1992,1(1):49-62.
[6]项雷文,郑检兵.双波长紫外吸收法测定L-苯丙氨酸含量[J].氨基酸和生物资源,2002,24(3):69.
[7]陈滋青,胡军,Axel W,等.双酶电极法测定L-苯丙氨酸的研究[J].工业微生物,2000,30(1):5-8.
[8]杨莉丽,袁倬斌.高效毛细管电泳法在芳香族手性氨基酸与年龄的关系研究中的应用[J].分析化学,1999,27(9):1 065-1 068.
[9]Kand’ár R,Záková P.Determination of phenylalanine and tyrosine in plasma and dried blood samples using HPLC with fluorescence detection[J].Chromatogr B,2009,877(30):3 926-3 929.

