枯草芽孢杆菌BS501a代谢物生防效果与理化特性研究
李瑞芳,田泱源,张慧茹,邱涵景,王 炳,裴昭君
(河南工业大学生物工程学院,河南 郑州 450001)
应用微生物次生代谢物防治植物病害是目前生物防治的一种主要方法.拮抗细菌由于培养周期短,生产方便,且对人畜无害、不污染环境,日益显示出其作为生防菌工业化生产的优势[1].芽孢杆菌由于具有耐热、抗逆性强等特点,在生物防制杀菌剂中占主导地位[2].枯草芽孢杆菌BS501a是本实验室从水稻田里分离、筛选和鉴定的优良拮抗菌株[3],具有较强的抗稻瘟病菌活性.本试验对枯草芽孢杆菌BS501a发酵液的抗菌谱进行测定,并研究其对稻瘟病的温室防治效果,对其发酵产物的生物安全性和理化稳定性进行研究,旨在为将其开发成生物农药并应用于生产实践提供依据.
1 材料与方法
1.1 试验材料
测定抗菌谱用稻瘟病菌(Magnaporthe grisea)为浙江大学梁慎博士惠赠;黄瓜枯萎病菌(Fusarium spp.)、黄瓜灰霉菌(Botrytis cinerea)、玉米青枯菌(Fusarium graminearum)、玉米小斑病菌(Bipolaris maydis)、玉米串珠镰孢菌(Fusarium moniliforme)、小麦根腐菌(Bipolaris sorokiniana)、小麦赤霉菌(Fusarium graminearum)、禾腐霉菌(Pythium graminicola)、番茄早疫病菌(Alternaria solani),由河南农业大学汪敏教授惠赠;辣椒枯萎病菌(Fusarium oxysporum f.sp.vasinfectum)、西瓜枯萎病菌(Fusarium oxysporum f.sp.niveum)、苹果轮纹病菌(Botryosphaeria berengeriana f.sp.piricola)、苹果腐烂病菌(Cytospora sp.),由河南省农业科学院刘玉霞博士惠赠;小麦纹枯病菌(Rhizoctonia cerealis)由河南工业大学伊艳杰博士惠赠.
温室防效试验用水稻为郑稻18,购于河南省农科院.
生物安全性测定用实验动物为KM小鼠,体重18~21 g,购自郑州大学医学院实验动物中心.
1.2 培养基
制备枯草芽孢杆菌种子液用LB培养基[4].培养真菌用PDA培养基[5].抗菌谱测定用PD培养液.发酵培养基配方见参考文献[6].
1.3 枯草芽孢杆菌BS501a发酵液的制备
挑取新鲜培养的枯草芽孢杆菌BS501a单菌落接种于LB液体培养基,37℃,220 r·min-1振荡培养过夜.过夜培养物按5%接种量接种到盛有100 mL发酵培养基的500 mL三角瓶中,37℃,220 r·min-1振荡培养 48 h 后得发酵液,12 000 r·min-1离心15 min,收集上清液.
1.4 枯草芽孢杆菌BS501a发酵液抗菌谱的测定
采用摇甁培养菌丝生长抑制法[7]测定2倍稀释的BS501a发酵液对15株病原菌的拮抗活性.
将直径6 mm的病原菌菌丝饼接种到20 mL发酵上清液和PD培养基(体积比1∶1)的混合液体培养基(含氨苄青霉素 100 μg·mL-1,抑制枯草芽孢杆菌BS501a的生长)中,28℃,140 r·min-1振荡培养7 d.取出病原菌菌丝块,用6层纱布过滤,用蒸馏水洗涤2次,转移到玻璃平皿内,放入37℃恒温培养箱,每隔几小时用刀片松动菌丝块,避免菌丝块与玻璃粘紧,烘至恒重,取出刮净,转移到尽量小的硫酸纸上,用精密电子天平称量菌丝块干重.每处理进行3次重复.根据公式计算菌丝生长抑制率.
菌丝生长抑制率(%)=(对照组菌丝块重量-处理组菌丝块重量)/对照组菌丝块重量×100
1.5 稻瘟病温室防效
1.5.1 稻瘟病菌孢子悬液制备 制备Ф6 mm稻瘟病菌菌饼,挑取2个放入含有1 mL无菌水的1.5 mL离心管中,在漩涡混合仪上振荡5 min,用无菌纱布过滤除掉菌饼和菌丝,得到稻瘟病菌孢子悬液,用血球计数板统计孢子个数,并用无菌水调配孢子悬液至浓度为105个孢子·mL-1.
1.5.2 水稻温室栽培 取少量水稻种子先用质量浓度为2%的次氯酸钠溶液浸泡15 min,然后用清水漂洗3~4次,采用菲律宾国际水稻研究所推荐的盆栽水稻营养液培养.设试验组和对照组,每组3盆,每个盆里放20~30粒水稻种子,置于光照培养箱中,28℃光照14 h黑暗10 h交替培养.
1.5.3 温室防效测定 用菲律宾国际水稻研究所推荐的盆栽水稻营养液,将水稻培养3周左右,待大部分水稻长至3叶1心时,用喷壶向水稻的叶和茎喷洒稻瘟病菌孢子悬液(含0.5%吐温80)5 mL.用黑色塑料罩罩在水稻外层,喷洒少量无菌水保持高湿,然后置于光照培养箱中28℃光照14 h黑暗10 h交替培养.24 h后,用喷壶喷洒5 mL枯草芽孢杆菌 BS501a发酵上清液(含0.5%吐温80)对水稻进行防治.对照组用清水喷洒.染病第6天,调查水稻染病情况,计算病情指数和防治效果.调查分级标准以叶片为单位(IRRI):0级为无病;1级为叶片病斑少于5个,长度小于1 cm;3级为叶片病斑6~10个,部分病斑长度大于1 cm;5级为叶片病斑11~25个,部分病斑连成片,占叶片面积10% ~25%;7级为叶片病斑26个以上,部分病斑连成片,占叶片面积26% ~50%;9级为叶片病斑连成片,占叶片面积50%以上或全部枯死.
病情指数、防治效果计算公式如下:

1.6 急性经口毒性试验
小鼠经口毒性试验按中华人民共和国药典(2010版)[8]介绍的方法进行.将发酵上清冷冻干燥获得的冻干粉用生理盐水依次稀释到5×10-2,5 ×10-3,5 ×10-4,5 ×10-5和 5 ×10-6g·mL-15个浓度.
选取健康实验动物KM小白鼠36只,每只体重18~21 g,按每组雌雄各半的原则随机分成6组,每组6只.实验前对小白鼠进行7 d的喂养观察,观察期内小白鼠自由采食、饮水、称重.小白鼠给药前禁食但不禁水,过夜后,称重.应用5×10-2,5 × 10-3,5 × 10-4,5 × 10-5和 5 × 10-6g·mL-1不同质量浓度的药液,对各试验组小鼠一次性灌胃约0.2 mL,使枯草芽孢杆菌BS501a发酵上清冻干粉口服剂量分别达 500,50,5,0.5 和 0.05 mg·kg-1,对照组灌服等量的生理盐水.
给药后2 h进食,连续观察8 d.分别于给药后第2,4,6,8天称重.给药第8天解剖,观察内脏病理变化.采用采血管颈动脉采血,析出血清,进行肝炎、肾炎血清学指标检验,内容包括谷丙转氨酶酶活(ALT)、谷草转氨酶酶活(AST)、碱性磷酸酶酶活(ALP)、尿素氮含量(BUN)和肌酐含量(CREA),由中国人民解放军第一五三中心医院完成.
1.7 理化稳定性试验
1.7.1 热稳定性试验 依据《中华人民共和国药典(2010 版)》[8]规定,取 4 份枯草芽孢杆菌BS501a发酵上清液,分2组,每组2份,每份10 mL,盛放于100 mL小烧杯中,用无菌纱布封口,分别置于45和60℃恒温水浴锅中.分别于第5天和第10天每组各取1份终止处理,测定热处理后的发酵上清液对稻瘟病菌的菌丝生长抑制率,每组做3次重复,并以-20℃保存的原始发酵上清液做对照.
1.7.2 酸碱稳定性试验 取13份发酵上清液,每份 10 mL,分13 组,用1 mol·L-1的盐酸和1 mol·L-1的氢氧化钠将样品分别调成pH值1~13范围内的不同pH值,每组1个pH值.分别测定每组发酵上清液对稻瘟病菌的菌丝生长抑制率,每组做3次重复,并以原始发酵上清液做对照.
1.7.3 光照稳定性试验 依据《中华人民共和国药典(2010 版)》[8]规定,取 2 份枯草芽孢杆菌BS501a发酵上清液,每份10 mL,分别盛放于100 mL小烧杯中,用带有若干针孔的保鲜膜封口,置于真空干燥机中,制成干粉状.去封口膜,放在多波段光照培养箱中,设置光照度为(4 500±500)lx,分别光照5和10 d,取光照处理过的干粉用10 mL蒸馏水溶解,测定发酵上清干粉溶液对稻瘟病菌菌丝生长抑制率,每组做3次重复,并以原始发酵上清干粉做对照.
1.7.4 蛋白酶稳定性试验 取4份发酵上清液,每份10 mL,加入蛋白酶K至终质量浓度50 mg·L-1,55 ℃水浴,分别作用 0.5,1.0,1.5,2.0 h,测定处理后的发酵上清液对稻瘟病菌的菌丝生长抑制率,每组做3次重复,并以原始发酵上清做对照.
1.8 遗传稳定性试验
将枯草芽孢杆菌BS501a在LB固体培养基上划线培养,生长12 h后,挑取单菌落转接到新鲜的LB平板上,为第2代,以此类推,转接10代.取第3,5,7,10代的单菌落制备种子液,然后转接到发酵培养基中,发酵 48 h,10 000 r·min-1离心 15 min,收集发酵上清液,分别测定其对稻瘟病菌菌丝生长抑制率,每组做3次重复,并以原始发酵上清做对照.
2 结果与分析
2.1 枯草芽孢杆菌BS501a发酵液抗菌谱的测定
按照1.4的方法,计算枯草芽孢杆菌BS501a发酵上清液对15种常见植物病原真菌的菌丝生长抑制率.将3次重复实验结果取平均值,并计算标准差,结果如表1所示.

表1 枯草芽孢杆菌BS501a发酵上清对植物病原真菌的菌丝生长抑制率Table 1 Mycelium growth inhibition rates of B.subtilis BS501a fermentation supernatant to plant pathogenic fungi
以85%和60%为分界点,菌丝生长抑制率大于85%为抑制效果强,菌丝生长抑制率在60%到85%之间为抑制效果中等,小于60%为抑制效果弱.菌丝生长抑制实验结果表明,枯草芽孢杆菌BS501a对玉米小斑病菌、小麦赤霉病菌、禾腐霉菌、稻瘟病菌、小麦根腐病菌、苹果腐烂病菌、辣椒枯萎病菌、西瓜枯萎病菌、苹果轮纹病菌、玉米串珠镰孢菌的抑制效果强;对番茄早疫病菌、黄瓜镰刀菌、小麦纹枯病菌的抑制效果中等;对黄瓜灰霉病菌和玉米青枯病菌的抑制效果弱.
2.2 温室防效
以稻瘟病为例,进行温室防效试验.具体病情指数及防治效果见表2.由结果可知,枯草芽孢杆菌BS501a发酵上清在温室培养条件下对稻瘟病菌具有良好的防治效果,平均防治效果为64.42%.

表2 枯草芽孢杆菌BS501a发酵上清对稻瘟病的防治效果Table 2 Control efficiency of B.subtilis BS501a fermentation supernatant to rice blast
2.3 小鼠急性经口毒性试验结果
2.3.1 小鼠解剖变化 小鼠经口投胃给药8 d后,解剖观察,试验组小鼠肠系膜清亮透明,没有出血点.肺呈粉红色,无出血点.4叶肝脏大小、颜色正常,没有变硬、变脆及肿胀现象,没有出血点.脾脏、肾脏颜色和大小均正常,无出血点和坏死点,不肿胀.胃饱满,胃壁完整,无出血点.胃黏膜无出血点.心脏大小、颜色正常,无出血点.试验最大剂量组与对照组无明显区别.结果表明,KM小鼠服用枯草芽孢杆菌BS501a发酵上清冻干粉500 mg·kg-1以内剂量,8 d后,内脏组织无病理变化.
2.3.2 小鼠血清学变化 测定小鼠血清中的肝炎、肾炎指标 ALT,AST,ALP,BUN 和 CREA,结果如表3 所示.各试验组 ALT,AST,ALP,BUN,CREA的平均含量与对照组的平均含量比较,没有显著差异,说明枯草芽孢杆菌BS501a发酵液对小鼠血清中衡量肝炎和肾炎的血清学指标无明显影响.由此可知,枯草芽孢杆菌 BS501a发酵液 LD50>500 mg·kg-1,说明 BS501a发酵上清属于低毒级,对生物是安全的.
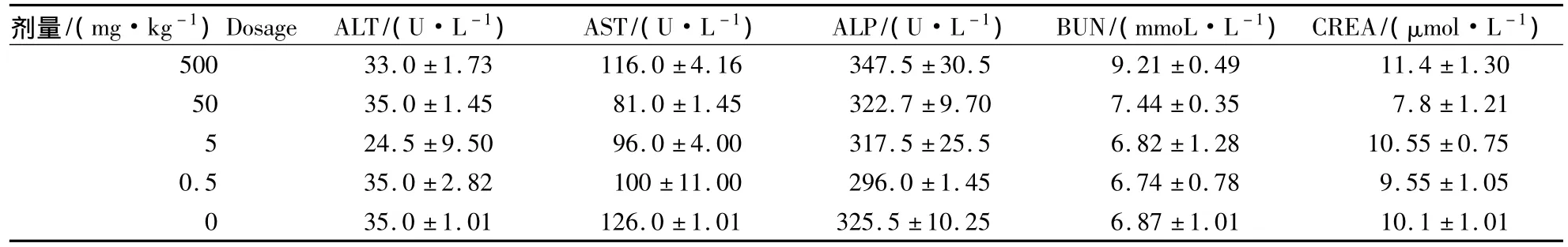
表3 KM小鼠血清学变化Table 3 Serological changes of KM mice
2.3.3 发酵液对小鼠体重的影响 分别称量小鼠灌胃给药前空腹时的体重和灌胃后第2,4,6,8天的体重,结果如表4所示.由表4可知,实验前各组实验动物体重间差别不明显,说明各组动物具有可比性.试验后期,最大剂量组与对照组之间体重差别仍不明显.试验组小鼠在给药期间增重变化与对照组差别不大,说明枯草芽孢杆菌BS501a发酵上清对小鼠的生长没有明显影响.
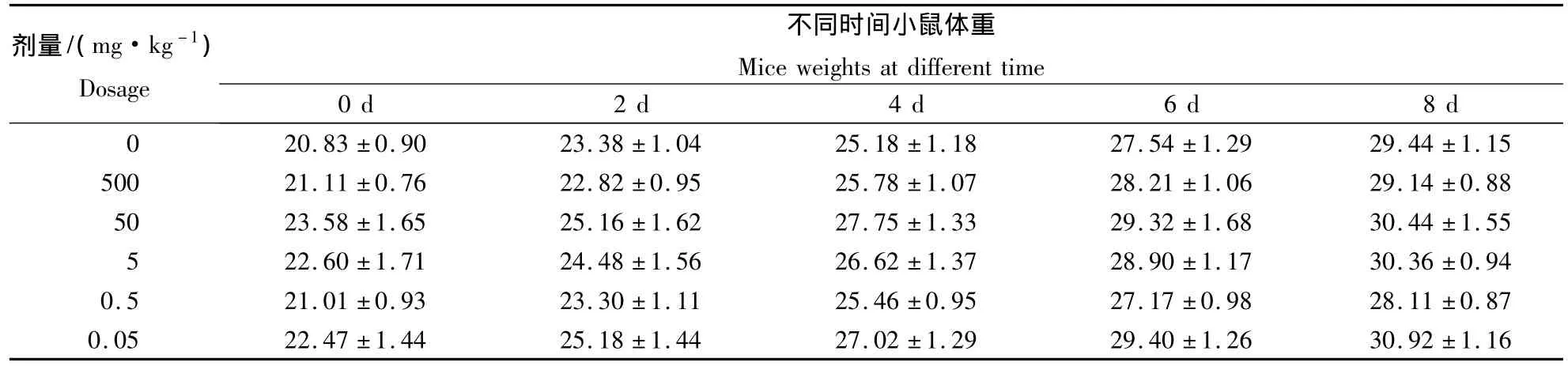
表4 KM小鼠体重变化Table 4 Weight changes of KM mice g
2.4 理化稳定性结果
2.4.1 热稳定性 枯草芽孢杆菌BS501a发酵上清热稳定性结果如表5所示.由结果可知,发酵上清在45℃下水浴10 d,其菌丝生长抑制率仅下降2.33%,变化较小.在60℃条件下水浴,第5天时发酵液的菌丝生长抑制率下降6.73%,但是第10天其抑制率就下降了27.47%,拮抗活性变化较大.实验结果表明BS501a发酵上清液在60℃下不能长久保存,在低于45℃条件下可以长时间存放.
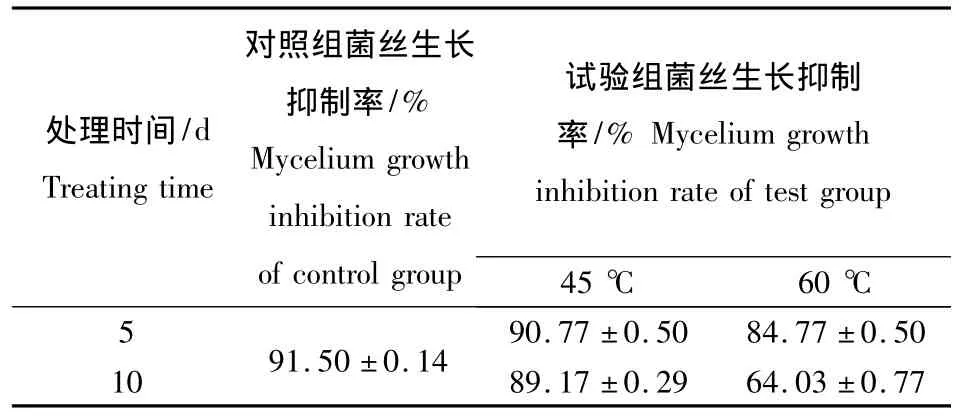
表5 热处理对枯草芽孢杆菌BS501a发酵上清液拮抗稳定性的影响Table 5 Effect of heat on antagonistic stability of B.subtilis BS501a fermentation supernatant
2.4.2 酸碱稳定性 枯草芽孢杆菌BS501a发酵液酸碱稳定性结果见图1.枯草芽孢杆菌BS501a发酵上清液自然条件下pH值为8.25,当用HCl将发酵液的pH值调制为6时,溶液中开始出现沉淀,上清液拮抗活性也逐渐降低.pH值越低,沉淀越多,上清液拮抗活性也越低.pH调到2时,发酵上清液拮抗活性下降57.2%.用pH值为7.0的80%甲醇重溶沉淀,溶液拮抗活性仅为32.5%.由此可知,发酵上清液中拮抗活性物质在酸性条件下形成了不溶性沉淀,用pH值为7.0的甲醇重溶,仅部分沉淀恢复活性.提高发酵上清液pH时,上清液始终保持澄清.当pH>9时,发酵上清液拮抗活性随pH值的升高而降低,可能是发酵上清液中活性拮抗物质在碱性条件下分解或灭活所致.结果表明,发酵上清液中的拮抗活性物质在pH值为7~9条件下较为稳定,活性较高.
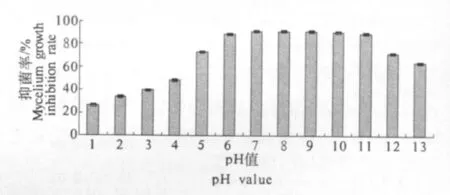
图1 酸碱处理对枯草芽孢杆菌BS501a发酵液上清液拮抗稳定性影响Fig.1 Effect of acid and alkali on antagonistic stability of B.subtilis BS501a fermentation supernatant
2.4.3 光照稳定性 枯草芽孢杆菌BS501a发酵上清液光照稳定性结果见表6.由表 6可知,BS501a发酵上清液在光照度(4 500±500)lx下照射10 d后,菌丝生长抑制率仅下降0.73%,拮抗活性比较稳定.

表6 光照对枯草芽孢杆菌BS501a发酵上清液稳定性的影响Table 6 Effect of illumination on antagonistic stability of B.subtilis BS501a fermentation supernatant
2.4.4 蛋白酶稳定性 枯草芽孢杆菌BS501a发酵上清液蛋白酶稳定性结果见表7.由表7可知,经过蛋白酶K的作用,发酵上清液对稻瘟病菌的菌丝生长抑制率变化不大,稳定性良好.蛋白酶K是一种切割活性较广的丝氨酸蛋白酶,可以切割脂肪族氨基酸和芳香族氨基酸的羧基端肽键,是一种广谱的蛋白酶.试验结果表明,发酵上清液中起拮抗作用的主要成分不能被蛋白酶K降解.

表7 蛋白酶K对枯草芽孢杆菌BS501a发酵上清液拮抗稳定性的影响Table 7 Effect of proteinase K on antagonistic stability of B.subtilis BS501a fermentation supernatant
2.5 遗传稳定性
枯草芽孢杆菌BS501a遗传稳定性结果见表8.由结果可以看出,枯草芽孢杆菌BS501a在传了10代之后,菌丝生长抑制率仅下降0.3%,拮抗活性稳定.
3 讨论
枯草芽孢杆菌是多种植物病原菌的竞争性抑制菌,它通过竞争性生长繁殖占据生存空间的方式来阻止植物病原菌的生长.穆常青等[7]分离的枯草芽孢杆菌B2332菌株培养物对稻瘟病的盆栽活体防治效果为52.80%.陈雪丽等[9]分离的枯草芽孢杆菌BRF22代谢产物对番茄枯萎病菌菌丝生长抑制率为60%,对番茄枯萎病的温室防治效果为44.73%.韩玲等[10]分离的枯草芽孢杆菌培养液对百合枯萎病的发病抑制率达65.3%.本研究表明,枯草芽孢杆菌BS501a发酵上清液对稻瘟病菌菌丝生长抑制率为91.5%,对稻瘟病的温室生物防治效果为63.8%.因此,枯草芽孢杆菌BS501a是一株高效生防菌.在抗菌谱研究方面,选择了多种常见的危害比较严重的植物病原真菌,发现枯草芽孢杆菌BS501a发酵上清液对其均有很强的抑制作用.枯草芽孢杆菌BS501a发酵上清液对实验小鼠安全性好.在理化性质研究方面,我们选择了影响生防制剂生物稳定性的几个关键因素,如环境温度、pH、光照、蛋白酶等,发现BS501a发酵液对外界环境抵抗力强,理化性质稳定,BS501a遗传性能稳定,适合做生防制剂.枯草芽孢杆菌BS501a的广谱高效、安全、对外界环境的稳定性和遗传稳定性,为其开发提供了理论依据.枯草芽孢杆菌BS501a具有开发潜力.

表8 枯草芽孢杆菌BS501a遗传稳定性Table 8 Genetic stability of B.subtilis BS501a
[1]王雪莲,王 敏,骆健美,等.枯草芽孢杆菌生防菌B579最佳培养基响应面法优化[J].江苏农业学报,2009,25(1):212 -215.
[2]丁翠珍,裘季燕,刘伟成,等.枯草芽孢杆菌B02产生拮抗物质培养基及发酵条件优化[J].中国生物防治,2008,24(2):159 -163.
[3]李瑞芳,赵玉峰,魏 建,等.具有稻瘟病菌拮抗活性的枯草芽孢杆菌的分离与鉴定[J].河南农业科学,2010(3):63-65.
[4]SAMBROOK J,FRITSCH E F,MANIATIS T.Molecular cloning:a laboratory manual.[M].2nd ed.New York:Cold spring Harbor Laboratory Press,1989.
[5]沈 萍,范秀荣,李光武.微生物学实验[M].第3版.北京:高等教育出版社,1999.
[6]LI R,TIAN Y,YI Y,et al.Optimization of medium and fermentation conditions for the antagonistic Bacillus subtilis BS501a strain using response surface methology[C].The 5thinternational conference on bioinformatics and biomedical engineering,2011,578-583.
[7]穆常青,刘 雪,陆庆光,等.枯草芽孢杆菌B332菌株对稻瘟病的防治效果及定殖作用[J].植物保护学报,2007,34(2):123 -128.
[8]国家药典委员会.中华人民共和国药典[M].2010版.中国医药科技出版社,2010.
[9]陈雪丽,王光华,金 剑,等.多粘类芽孢杆菌BRF-1和枯草芽孢杆菌BRF-2对黄瓜和番茄枯萎病的防治效果[J].中国生态农业学报,2008,16(2):446 -450.
[10]韩 玲,程智慧,孙金利,等.枯草芽孢杆菌对百合枯萎病的防治效果[J].西北农业学报,2010,19(10):133-136;151.

