黄芪注射液对阿霉素中毒性心肌损伤小鼠心肌细胞线粒体膜电位及GSH的影响*
梁丽英 陈 晶 贺 毅
阿霉素(adriamycin,ADM)用于治疗各种恶性肿瘤。但是,由于其具有明显的心脏毒性,临床应用受到限制。阿霉素心脏毒性与心肌细胞凋亡有关,在细胞凋亡过程中,线粒体起着关键性的作用。研究发现,在细胞凋亡的早期阶段,细胞发生病理改变前,线粒体膜电位就已经下降,一旦线粒体跨膜电位崩溃,则细胞凋亡不可逆转[1]。黄芪注射液对细胞线粒体膜电位下降有抑制作用[2]。本研究旨在探讨其拮抗阿霉素心脏毒性的作用机制。
1 材料与方法
1.1 药品与试剂 阿霉素(注射用盐酸多柔比星10 mg/瓶,浙江海正药业股份有限公司,批号:090201B);黄芪注射液(2 g/mL,正大青春宝有限公司,批号:0901073)。JC-1细胞线粒体膜电位试剂盒(5 mg/瓶,美国Biovision,批号:ENZ-52304)。还原型谷胱甘肽(GSH)试剂盒(100T,批号:20100302,南京建成生物工程技术有限公司)。
1.2 实验动物 昆明小鼠60只(广西医科大学动物实验中心,SCXK桂-2003-0003),雄性,清洁级,体质量18~20 g。
1.3 仪器设备 流式细胞分析系统(美国BECKAN COUL⁃TER公司,型号:Epics XL);移液器(德国EPPENDORF公司);756型紫外分光光度计(上海菁华仪器厂)。
1.4 实验方法 采用随机平行同期对照的方法,建立小鼠阿霉素中毒性心肌损伤(ADR)动物模型。60只小鼠按随机数字表分为黄芪注射液治疗组(大、中、小3个剂量组)、阿霉素模型组和正常对照组。正常对照组每日腹腔注射生理盐水10 μL/g;阿霉素模型组,隔日腹腔注射阿霉素3 μg/g;黄芪注射液治疗组,隔日腹腔注射阿霉素3 μg/g,另外大、中和小剂量组每日腹腔分别注射黄芪注射液12、6和3 μg/g。所有动物均自由饮食。连续给药14 d。
1.5 检测指标与方法 (1)心脏系数测定:称取小鼠体质量,摘眼球取血,处死后取出心脏,用电子分析天平准确称量全心湿质量,计算心脏系数(全心湿质量/体质量)。(2)心肌组织中GSH的检测:取心肌约50 mg,置于预冷的PBS中,洗去残留血液,用滤纸吸干水分,在4℃冰浴中制备10%的心肌组织匀浆,低温离心3 000 r/min,30 min,取上清比色法检测GSH。(3)心肌细胞线粒体膜电位检测:取心脏约50 mg,制成单细胞悬液,调整细胞数的浓度为106个/mL。用流式细胞仪检测,将100 μL细胞悬液(106个/mL)加入5 mL的流式测定管中,同时设立阴性对照管。在测定管中加入1 μL JC-1工作液,阴性对照管不加。轻轻混匀。将测定管和对照管置于37℃培养箱中孵育15~20 min;吸取500 μL PBS缓冲液分别加入测定管和对照管中,上机检测。流式细胞仪激发波为488 nm,红色荧光的最大发射波长为580/590 nm,绿色荧光的最大发射波长为510/527 nm,以红/绿荧光强度比值代表细胞线粒体膜电位,图像采用Cell Quest软件分析。
1.6 统计学方法 实验数据采用SPSS 13.0软件对数据进行单因素方差分析,以均数±标准差±s)表示,方差不齐时采用秩和检验,组间两两比较采用LSD法,P<0.05为差异有统计学意义。
2 结果
2.1 心脏系数结果 各组分别与模型组比较,差异均有统计学意义(P<0.01);与正常对照组比较,黄芪注射液小剂量组心脏系数偏大,差异有统计学意义(P<0.05),与黄芪注射液大剂量组、中剂量组比较差异无统计学意义(P>0.05),见表1。
2.2 心肌组织中GSH检测结果 各组分别与阿霉素模型组比较差异均有统计学意义(P<0.01);黄芪注射液各剂量组相互比较,差异无统计学意义(P>0.05),见表2。
2.3 线粒体膜电位 阿霉素模型组与其他各组比较差异有统计学意义(P<0.05或P<0.01);黄芪注射液各剂量组与正常对照组比较,差异也有统计学意义(均P<0.01),见表3。
表1 黄芪注射液对ADR小鼠心脏系数的影响 ±s)

表1 黄芪注射液对ADR小鼠心脏系数的影响 ±s)
**P<0.01
正常对照组(1)阿霉素模型组(2)黄芪大剂量组(3)黄芪中剂量组(4)黄芪小剂量组(5)F 12 10 12 12 12 4.11±0.10 4.44±0.14 4.18±0.13 4.21±0.16 4.24±0.18 7.140**组比(1)∶(2)(1)∶(3)(1)∶(4)(1)∶(5)(2)∶(3)P<0.001 0.193 0.104 0.036<0.001组比(2)∶(4)(2)∶(5)(3)∶(4)(3)∶(5)(4)∶(5)P<0.001 0.003 0.624 0.411 0.738统计学处理组别 n 心脏系数(mg/g)
表2 黄芪注射液对ADR小鼠心肌组织GSH的影响±s)

表2 黄芪注射液对ADR小鼠心肌组织GSH的影响±s)
**P<0.01
正常对照组(1)阿霉素模型组(2)黄芪大剂量组(3)黄芪中剂量组(4)黄芪小剂量组(5)F 12 10 12 12 12 3.99±0.47 2.02±0.22 2.77±0.16 2.88±0.56 2.67±0.28 36.118**组比(1)∶(2)(1)∶(3)(1)∶(4)(1)∶(5)(2)∶(3)P<0.001<0.001<0.001<0.001<0.001组比(2)∶(4)(2)∶(5)(3)∶(4)(3)∶(5)(4)∶(5)P<0.001<0.001 0.609 0.550 0.270统计学处理组别 n GSH(mg/g)
表3 黄芪注射液对ADR小鼠线粒体膜电位的影响±s)
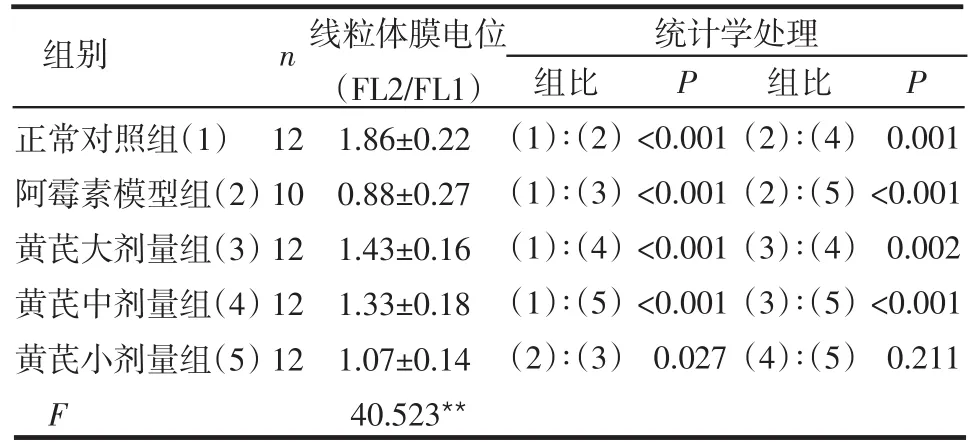
表3 黄芪注射液对ADR小鼠线粒体膜电位的影响±s)
**P<0.01
正常对照组(1)阿霉素模型组(2)黄芪大剂量组(3)黄芪中剂量组(4)黄芪小剂量组(5)F 12 10 12 12 12 1.86±0.22 0.88±0.27 1.43±0.16 1.33±0.18 1.07±0.14 40.523**组比(1)∶(2)(1)∶(3)(1)∶(4)(1)∶(5)(2)∶(3)P<0.001<0.001<0.001<0.001 0.027组比(2)∶(4)(2)∶(5)(3)∶(4)(3)∶(5)(4)∶(5)P 0.001<0.001 0.002<0.001 0.211统计学处理组别 n线粒体膜电位(FL2/FL1)
3 讨论
心肌细胞凋亡可直接导致心脏动力来源减少,凋亡细胞局部纤维化可诱发心律失常。线粒体跨膜电位(mitochondrial membrane potential)紊乱是细胞凋亡时发生的细胞内事件之一,是细胞凋亡过程中的重要事件,其可导致在线粒体膜上形成孔洞,细胞色素C释放到细胞质中。线粒体内容物释放的调控被认为与线粒体膜上一种称为permeability transition pore(PT pore)的线粒体膜通透性转运孔有关,此孔道打开会造成线粒体内膜两侧H+梯度消失、线粒体膜电位下降,造成线粒体涨大,外膜涨破之后细胞色素C释放到细胞液中引起细胞凋亡[3]。线粒体膜电位下降是细胞凋亡的特征性标志,维持正常的线粒体膜电位是抑制细胞凋亡的重要手段[4]。本研究选用线粒体膜电位检测试剂盒(JC-1),它是一种以JC-1为荧光探针,快速灵敏地检测细胞、组织或纯化的线粒体膜电位变化的试剂盒。在线粒体膜电位较高时,JC-1聚集在线粒体的基质(ma⁃trix)中,形成聚合物(J-aggregates),可以产生红色荧光;在线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体(monomer),可以产生绿色荧光,这样就可以非常方便地通过荧光颜色的转变来检测线粒体膜电位的变化。红绿荧光的相对比例常用来衡量线粒体膜电位。本研究结果显示,黄芪注射液能稳定心肌细胞膜电位,抑制膜电位下降,减缓心肌细胞凋亡。
线粒体是能量产生的重要场所,在产生能量的同时也会产生大量的氧自由基(ROS),ROS过多会造成线粒体损伤、膜电位下降、线粒体膜通透性转换孔开放和细胞色素C等凋亡相关因子释放[3]。GSH参与体内氧化还原过程,能和过氧化物及自由基结合,以对抗氧化剂对巯基的破坏,保护细胞膜中含巯基的蛋白质和含巯基酶不被破坏,同时还可对抗自由基对重要脏器的损害,是人体组织中用于清除ROS的抗氧化剂。GSH不仅参与细胞抗氧化反应、维持机体的氧化还原平衡,还参与了调节细胞增生、机体免疫应答。GSH降低是潜在的凋亡早期激活信号,随后产生的ROS促使细胞发生凋亡,即细胞发生凋亡时,细胞浆内的GSH水平会降低[5],因此检测GSH水平可以判断和检测细胞凋亡。本研究结果显示黄芪注射液可提高ADR小鼠细胞浆内GSH,保护心肌细胞,抑制细胞凋亡。
[1]Haeberlein SL.Mitochondrial function in apoptotic neuronal cell death[J].Neurochem Res,2004,29(3):521-530.
[2]李晓东,徐建良,姜楠,等.内毒素对大鼠肝细胞线粒体膜电位的影响及黄芪注射液的干预作用[J].中西医结合肝病杂志,2005,15(6):357-358.
[3]Correa F,Soto V,Zazueta C.Mitochondrial permeability transition rel⁃evance for apoptotic triggering in the post-ischemic heart[J].Int J Biochem Cell Biol,2007,39(4):787-798.
[4]陈楠楠,刘春雨,黄世林,等.线粒体膜电位在PUVA诱导HL-60,K562细胞凋亡时的变化[J].中药材,2008,31(11):1679-1681.
[5]高世勇,徐丽丽,季宇彬.龙葵碱调控还原型谷胱甘肽和活性氧氧化还原体系损伤线粒体超微结构诱导HepG2细胞凋亡[J].中草药,2009,40(11):1779-1784.

