大分子拥挤体系下葡聚糖对SPI的共价修饰*
齐军茹 卓秀英 杨晓泉 尹寿伟 黄立新
(华南理工大学轻工与食品学院,广东广州510640)
“大分子拥挤”是生命科学领域中的研究热点[1],生命细胞内含有大量的大分子物质如多糖、蛋白质、核酸等,这些大分子以很高的浓度存在,使细胞内环境变得异常拥挤,大多数的生化反应是在这种拥挤的环境体系中完成的.因此,近几年生命科学家强烈建议把“大分子拥挤”环境与pH、离子强度和溶液组成等常规因素一样用于研究生物大分子,加入拥挤物质逐渐成为一种研究大分子的途径[2].
蛋白质和多糖是共存于食品乳化体系中的最重要的两类生物大分子,是影响食品结构和功能的主要因素.蛋白质因能在液—液或气—液界面上形成吸附层,降低界面张力,多在胶体体系中充当乳化剂;多糖则由于其良好的增稠性和持水性而常用作稳定剂.与以次级力结合的蛋白质-多糖体系相比,共价键结合的蛋白质与多糖形成大分子复合物,既保留了蛋白质的表面活性又具有多糖的亲水性能,具有较高的环境适应性,其结合不受热或pH值的影响[3].就乳化性能而言,大分子复合物优于某些商业小分子乳化剂[4-5];引入糖链后,蛋白质的溶解度、抗氧化性、抗菌性以及热稳定性等性能提高[5-6].
当体系中存在高浓度的生物大分子时,大分子之间的反应遵循分子排斥容积理论[7],促进反应向溶质总体积减小的方向,即朝结合方向移动[8];此外,大分子拥挤环境下蛋白质分子构型趋于稳定,蛋白质变性程度以及聚集程度将会减小[9].笔者前期研究了乙醇体系中大豆分离蛋白-葡聚糖共价复合物的制备及机理,结果表明乙醇通过控制水分活度对Maillard反应有促进作用[10].基于大分子拥挤理论,文中将多糖(葡聚糖)和蛋白质(大豆分离蛋白)作为生物大分子形成高浓度的大分子拥挤环境,进行Maillard反应,探讨了葡聚糖对大豆分离蛋白的共价修饰作用;与乙醇体系不同,大豆分离蛋白和葡聚糖不仅仅是反应试剂,而且是拥挤试剂.
1 材料与方法
1.1 材料与试剂
主要材料与试剂如下:实验用大豆低温脱脂豆粕,购自山东东营蛋白厂;葡聚糖(相对分子质量为60000~90000),购自Sigma公司;无水乙醇和甲醇等试剂均为国产分析纯.
1.2 仪器和设备
主要仪器和设备如下:Q100型差示扫描量热仪,美国TA Instruments公司生产;1525型凝胶渗透色谱仪,美国Waters公司生产;MOS 450型圆二色光谱仪,法国BIO-LOGIC公司生产;Mastersizer 2000型粒度分布仪,英国Malvern Instruments公司生产.
1.3 实验方法
1.3.1 大豆分离蛋白的制备
大豆分离蛋白(SPI)的制备方法见文献[10].
1.3.2 蛋白 -多糖干热反应
将大豆分离蛋白与葡聚糖按质量比1∶1混合并溶解,调混合物总质量浓度至60 g/L,冷冻干燥.物料过120目筛后放置在有饱和KBr溶液的容器内,保持相对湿度为79%,在60℃下恒温反应5d,得到干热复合物(DHC).
1.3.3 SPI和葡聚糖的交联
分别称取1g大豆分离蛋白和一定量的葡聚糖,加入pH值为6.5的磷酸盐缓冲液10 mL,搅拌2 h至完全溶解,添加0.2%NaN3数滴,置于5℃过夜;之后保持恒温,搅拌加热一段时间后,4℃下透析24h,于20℃在10000g离心30 min,取上清液,冷冻干燥,得到大豆分离蛋白-葡聚糖共价复合物(SDC).
1.3.4 接枝度的测定
采用邻苯二甲醛(OPA)法[11]测定接枝度.称取40mg的 OPA溶解于1 mL的甲醇中,分别加入2.5mL 200g/L的十二烷基磺酸钠(SDS)、25 mL 0.1mol/L 的硼砂、100μLβ-巯基乙醇,最后用蒸馏水定容至50 mL,得到OPA试剂.取OPA试剂4 mL于试管中,分别注入200 μL样品液,混匀后于35℃反应2min,340nm下测其吸光值.由此可得接枝度G:

式中,D0为接枝反应前溶液的吸光值,D1为接枝反应后溶液的吸光值.
1.3.5 乳化活性的测定
样品用去离子水配制成2%(质量分数)的溶液,加入含量为20%(体积分数)的花生油溶液,30MPa高压均质2次,制成乳状液,用去离子水按质量比1∶1000稀释,采用粒度分布仪测定乳状液中粒子大小及其分布[12].参数设置如下:颗粒折射率为1.520,分散剂折射率为1.330.
1.3.6 荧光光谱分析
采用1-苯胺基萘-8-磺酸盐(ANS)荧光探针法[13]进行分析.将加热后的糖基化产品用0.01mol/L的磷酸盐缓冲液(pH=7.0)稀释为蛋白质质量浓度为0.1 g/L的待测样,检测前取20 μL ANS溶液(8mmol/L)加到4mL待测液中混合均匀,激发波长为390nm(狭缝5 nm),迅速进行400~600 nm的波长扫描.
1.3.7 其它分析方法
SDS-聚丙烯酰胺凝胶电泳、热稳定性测定、凝胶渗透色谱分析及圆二色光谱仪分析的具体方法参考文献[10].
2 结果与分析
2.1 Maillard反应条件的确定
Maillard反应中,蛋白质中的游离氨基对侧链进行修饰,文中通过游离氨基的变化情况表征Maillard反应的程度,即接枝度.
在反应体系中,蛋白质分子有一个肽链展开、游离氨基暴露的过程,随着反应的进行,游离氨基参与了羰氨反应,形成共价结合物,体系游离氨基逐渐减少,接枝度升高.当SPI/葡聚糖质量比为2∶1、1∶1、1∶2、1∶3 时,对应的接枝度分别为 20.21%、62.72%、63.19%、44.65%,接枝度随葡聚糖浓度的升高先升高后降低.这是因为:体系越拥挤,与SPI的接触面越大,有利于反应的进行,接枝度增大,但是同时葡聚糖的空间位阻也增加,会阻碍共价交联的进行,过大的葡聚糖浓度会使接枝度减小.可见,SPI/葡聚糖的最佳质量比为1∶1(质量比为1∶2时所耗葡聚糖过多).当反应时间为 18、24、30、36 h时,对应的接枝度分别为44.79%、56.48%、62.70%、62.91%,可见,反应时间增加,接枝度提高,当反应时间达到30 h时,其接枝度与36 h时基本相当.在Maillard反应中,当反应温度为 50、55、60、65℃时,对应的接枝度分别为30.73%、49.92%、62.84%、62.99%,可见,随着反应温度的升高,接枝度提高,当反应温度从60℃升高到65℃时,接枝度增加不明显.因此,可确定Maillard反应的适宜条件为:SPI/葡聚糖质量比为1∶1,反应时间为30h,反应温度为60℃.
2.2 电泳图谱分析
图1为考马斯亮蓝染色和糖蛋白染色的电泳图谱.在考马斯亮蓝染色图谱中,SDC的条带中分离胶与浓缩胶界面有相对分子质量较大且集中的物质生成,在上样孔与浓缩胶界面生成了相对分子质量更大的聚集物,有大量难以进入浓缩胶的大分子物质,而未加热和加热的SPI条带没有这两种现象.在糖蛋白染色图谱中,对应考马斯亮蓝染色图谱中的大分子区域均有聚合产物条带,表明SDC为共价结合的糖蛋白.

图1 考马斯亮蓝染色和糖蛋白染色的电泳图谱Fig.1 Electrophoretograms with coomassie brilliant blue staining and carbohydrate staining
结合接枝度分析的结果可知,模拟大分子拥挤体系可以大大缩短反应时间,拥挤体系只需30 h就可完成反应,而传统的干热反应需5天.这是因为水相反应中可以自由搅拌,克服了干热反应不均匀的缺点,最大程度地让多糖和蛋白质充分接触,从而加快了反应速度.这说明了模拟大分子拥挤体系进行Maillard反应的可行性和有效性.
2.3 乳化活性
图2示出了各样品的乳化活性.乳状液中的粒度分布是影响乳状液稳定性的关键因素,也是评价样品乳化活性的重要指标.乳状液粒子越大,乳析过程越快,乳析率越高.由图2可知:SDC的乳液粒径小,乳化活性高,且稳定性好;质量比为1∶1的SPI/葡聚糖混合物的乳液粒径偏高,表明未经Maillard反应的混合物中蛋白质的乳化活性没有得到改善;SPI单独加热所得产物的乳液粒径明显较大,说明在加热过程中蛋白质发生了热聚集,从而导致粒径增大,乳化活性降低.显然,大分子拥挤环境中,葡聚糖糖链的键入可有效抑制蛋白质的热聚集.该现象表明,大分子拥挤体系中Maillard反应制备的蛋白

图2 乳化活性的比较Fig.2 Comparison of emulsifying activity
2.4 疏水性分析
图3为产物加热后的外置荧光光谱.利用ANS作为荧光探针的外置荧光光谱可以分析蛋白质疏水基团暴露的情况.ANS连接到芳香族氨基酸如苯丙氨酸、色氨酸和酪氨酸的支链上,因而荧光强度与蛋白质的疏水性直接相关[14],荧光强度越大,疏水性越强.由图 3可知,荧光强度的高低顺序为:SPI>SPI/葡聚糖混合物>SDC.这说明以共价键形式键入的葡聚糖能够与芳香族氨基酸共价结合,减少蛋白质表面的疏水基团,降低由于疏水作用导致的蛋白质聚集.

图3 对照样品和SDC的外置荧光光谱Fig.3 Exterior fluorescence emission spectra of control samples and SDC
2.5 热稳定性分析
图4为SDC和SPI的差示扫描量热(DSC)图谱.加热是蛋白质加工中不可避免的工序,而蛋白在热作用后会发生变化(如聚集、分子结构变化等),因而影响其功能.由图4可知,三者均呈现了一至两个吸收峰,这是SDC和SPI的热变性峰.其中SDC的变性温度较高,为105.17℃,变性焓为25.600J/g,两项指标都高于加热和未加热处理的SPI,表明大分子拥挤体系中,蛋白质的热稳定性提高了.原因可能是由于葡聚糖分子糖链的键入,分子的净负电荷增加,空间位阻增大,静电排斥作用增强[15],因此接枝的复合物在热作用下不易发生聚集[16],热稳定性得到提高.
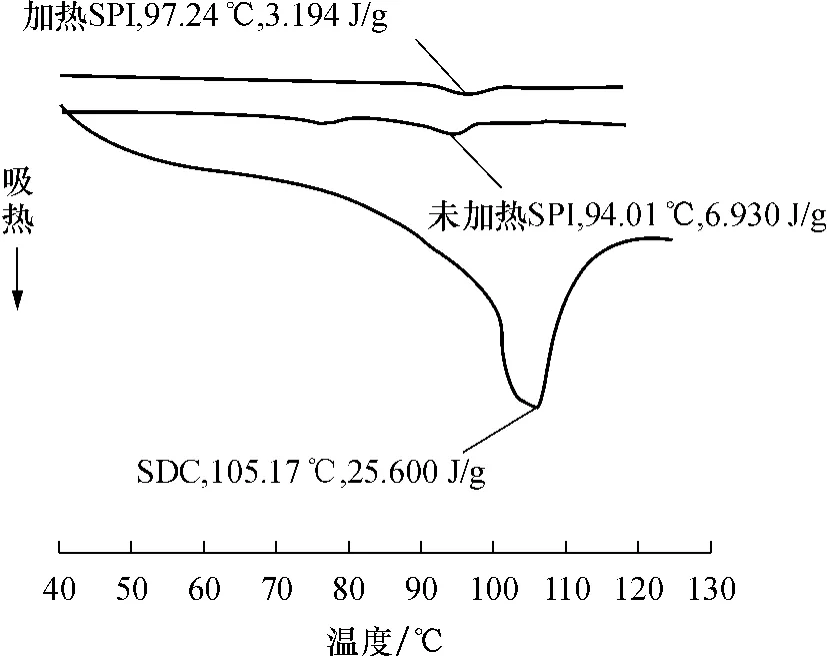
图4 SDC和SPI的DSC图谱Fig.4 DSC profiles of SDC and SPI
2.6 相对分子质量分析
图5为对照样品和SDC的凝胶渗透色谱图,根据所测标准样品的数据,当洗脱时间为12.97 min时,对应的相对分子质量为669000;当洗脱时间为15.83min时,对应的相对分子质量为158000;当洗脱时间为17.06 min时,对应的相对分子质量为43000.比较可知,与SPI相比,SDC的吸收峰发生明显变化,且洗脱峰位置前移,说明生成了聚合物;相对分子质量变大,说明糖基化处理后,大分子的分散度提高,蛋白与糖交联后其产物为各种不同相对分子质量的物质组成的混合物,其中高相对分子质量的物质较多,与2.2节中的电泳图谱分析结果一致.

图5 对照样品和SDC的凝胶渗透色谱Fig.5 Gel permeation chromatograms of control samples and SDC
2.7 蛋白质二、三级结构分析
图6(a)示出了对照样品和SDC二级结构的变化情况.研究表明,典型的α螺旋结构蛋白在192nm处有明显正吸收峰,在208nm及222nm处有两个明显负吸收峰,β折叠结构在196 nm处有一正的谱带,在206 nm处有一负的谱带[17].与SPI的二级结构组成相比,两种糖基化产物二级结构的主要结构与SPI一样,仍以β折叠结构为主,而α螺旋含量均有不同幅度的减少,无规则卷曲含量都增加.这说明蛋白质肽链中引入较长的糖链,抑制了蛋白质分子聚集,空间结构发生变化,柔韧性有所增加[18].与干热产物DHC的二级结构略有不同,SDC的α螺旋结构减少的幅度较大,原因可能是水溶液更有利于反应的进行,反应程度更高,随着葡聚糖分子的接入,空间位阻增大,α螺旋结构迅速减少,蛋白质展开逐渐趋于稳定.
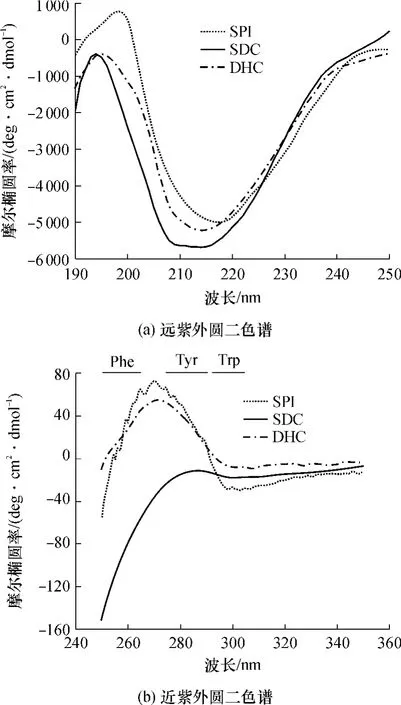
图6 对照样品和SDC的圆二色谱分析Fig.6 Circular dichroism spectra of control samples and SDC
对照样品和SDC三级结构的近紫外图谱如图6(b)所示.圆二色谱的近紫外图谱反映了蛋白质侧链基团的变化,主要是芳香族氨基酸,如色氨酸(Trp)、酪氨酸(Tyr)、苯丙氨酸(Phe)[19].图6(b)中SDC图谱变化大,曲线主要波动出现在250~290nm内,表明扰动主要发生在Phe、Tyr残基及二硫键附近.糖链的接入能引进较大的空间位阻,较大程度地屏蔽掉近紫外区有信号的芳香族氨基的圆二信号,尤其在Phe的特征信号范围250~265 nm内,圆二信号负值增强,说明在糖基化过程中苯丙氨酸减少,可能与葡聚糖发生了共价交联.结合近紫外和远紫外圆二色谱分析可知,糖基化产物的二、三级结构都发生了明显的变化,蛋白质结构的柔韧性有所增强,这将更有利于发挥其功能.
3 结语
文中探讨了大分子拥挤体系中蛋白质糖基化的有效性,发现大分子拥挤体系可加速接枝反应的进程,大大缩短反应时间.电泳图谱结果表明,接枝效果良好,所得产物具有优异的性能,特别是乳化活性和热稳定性.此外,文中还从构象角度揭示了大分子拥挤体系中蛋白质糖基化产物的特性:反应体系中蛋白二级结构α螺旋含量减少,无规则卷曲含量增强,蛋白质结构的柔韧性增强,更有利于发挥其功能.SDC作为一种性能优异的的大分子复合物在食品工业中有广泛的应用,文中提供的SDC制备方法可为工业生产提供一定的技术基础,有助于SDC的工业规模化生产.
[1]Minton A P.The influence of macromolecular crowding and macromolecular confinement on biochemical reactions in physiological media[J].Journal of Biological Chemistry,2001,276(14):10577-10580.
[2]Donald J W,Peter R W.Molecular crowding effects of linear polymers in protein solutions[J].Biophysical Chemistry,2006,119(2):186-195.
[3]Akhtar M,Dickinson E.Emulsifying properties of whey protein-dextran conjugates at low pH and different salt concentrations[J].Colloids and Surfaces B-Biointerfaces,2003,31(1/2/3/4):125-132.
[4]Qi J R,Yang X Q,Liao J S.Improvement of functional properties of acid-precipitated soy protein by the attachment of dextran through Maillard reaction [J].International Journal of Food Science and Technology,2009,44(11):2296-2302.
[5]Diftis N,Kiosseoglou V.Physicochemical properties of dry-heated soy protein isolate-dextran mixtures[J].Food Chemistry,2006,96(2):228-233.
[6]Diftis N,Kiosseoglou V.Stability against heat-induced aggregation of emulsions prepared with a dry-heated soy protein isolate-dextran mixture [J].Food Hydrocolloids,2006,20(6):787-792.
[7]Giovanni R A,Ezio B.Thermodynamics of proteins in unusual environments [J].Biophysical Chemistry,2007,126(1/2/3):65-79.
[8]Sasahara K,McPhie P,Minton A P.Effect of dextran on protein stability and conformation attributed to macromolecular crowding[J].Journal of Molecular Biology,2003,326(4):1227-1237.
[9]Eggers D K,Valentine J S.Molecular confinement influences protein structure and enhances thermal protein stability[J].Protein Science,2001,10(2):250-261.
[10]齐军茹,卓秀英,杨晓泉.液相体系中SPI-葡聚糖复合物的制备及性质[J].华南理工大学学报:自然科学版,2011,39(4):99-104.Qi Jun-ru,Zhuo Xiu-ying,Yang Xiao-quan.Preparation and properties of SPI-dextran conjugate in liquid system[J].Journal of South China University of Technology:Natural Science Edition,2011,39(4):99-104.
[11]Elena P,Guadalupe P,Rosario G.High pressure and the enzymatic hydrolysis of soybean whey proteins[J].Food Chemistry,2004,85(4):641-648.
[12]Carlos B,Alberto R,Jose M A,et al.Temperature and pH as factors influencing droplet size distribution and linear viscoelasticity of O/W emulsions stabilized by soy and gluten proteins[J].Food Hydrocolloids,2010,24(8):783-791.
[13]Kato A,Nakai S.Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins[J].Biochemical et Biophysical Acta,1980,624(1):13-20.
[14]Cardamone M,Puri N K.Spectro fluorimetric assessment of the surface hydrophobicity of proteins[J].Biochemical Journal,1992,282(2):589-593.
[15]Oliver C M,Melton1 L D,Stanley R A.Functional properties of caseinate glycoconjugates prepared during controlled heat treatment in the‘dry’state[J].Journal of the Science of Food and Agriculture,2006,86(5):722-731.
[16]Jing H,Kitts H H.Chemical and biochemical properties of casein-sugar Maillard reaction products[J].Food and Chemical Toxicology,2000,40(7):1007-1015.
[17]Pelton J T,Mclean L R.Spectroscopic methods for analysis of protein secondary structure[J].Analytical Biochemistry,2000,277(2):167-176.
[18]Xu C H,Yu S J,Yang X Q,et al.Emulsifying properties and structural characteristics ofβ-conglycinin and dextran conjugates synthesised in a pressurized liquid system [J].International Journal of Food Science and Technology,2010,45(5):995-1001.
[19]Pelton J T,Mclean L R.Spectroscopic methods for analysis of protein secondary structure[J].Analytical Biochemistry,2000,277(2):167-176.

