蛋白质类药物胃肠道促吸收方法的研究进展
李佐法(山东泰安市第一人民医院,泰安市 271000)
生物技术药物在人类疾病的治疗中正发挥着越来越重要的作用,而生物技术药物大多数为蛋白质类药物。该类药物在胃肠道中不稳定,易被胃肠道苛刻的pH环境和丰富的酶系统破坏,同时由于其具有分子量大、对胃肠道黏膜的渗透性低的特点,导致该类药物的胃肠道用药生物利用度极低。
为了避免蛋白质在胃肠道中的降解及吸收困难的问题,蛋白质类药物主要采用注射的方式给药,给患者带来了极大不便。因而开发该类药物的无损伤性传输系统已成为药剂领域的研究热点。以往人们已投入大量的精力开发蛋白质类药物的非注射给药剂型,包括滴鼻剂、肺部给药的喷雾剂及干粉吸入剂、植入剂以及口服剂型等。其中口服剂型以其良好的患者依从性吸引了大批研究者的关注,而各种技术手段也被应用其中,如添加酶抑制剂与吸收促进剂等,这使得对蛋白质类药物的口服给药系统的研究方兴未艾。但酶和pH环境对蛋白质的降解、破坏以及蛋白质在胃肠道的低渗透性,使得蛋白质类药物的吸收障碍亦成为蛋白质类药物胃肠道给药研究的瓶颈。为此,本文在查阅近年国内、外研究论文基础上,从技术手段和剂型手段2方面综述可提高蛋白质类药物胃肠道吸收的方法,希望可以为开发蛋白质类药物口服给药系统的工作者及其胃肠道给药系统提供参考。
1 技术手段
采用添加酶抑制剂与吸收促进剂,对蛋白质进行化学修饰,利用穿膜肽、转铁蛋白等特殊转运机制的技术手段,可有效提高蛋白质类药物的胃肠道吸收。
1.1 添加酶抑制剂
蛋白质类药物在胃肠道的巡行过程中,会遭到众多酶系的降解。在该类药物的给药系统中添加酶抑制剂,可以在一定程度上减少胃肠道中酶系统对药物的破坏,从而增加药物吸收入血的可能性,提高其口服生物利用度。常用的酶抑制剂包括杆菌肽、抑肽酶、胰蛋白酶抑制剂、胰凝乳蛋白抑制剂、胆酸钠、卡莫司他甲磺酸盐、大豆胰蛋白酶抑制剂等。Lee等[1]在胰岛素微球中添加抑肽酶和Bowman-Birk酶抑制剂,通过回肠瘘管给大鼠饲药,与对照组(不含酶抑制剂的胰岛素微球)比较,含酶抑制剂的胰岛素微球使胰岛素绝对生物利用度由(1.78±0.40)%上升至(8.76±4.47)%,可见酶抑制剂显著提高了胰岛素在回肠中的吸收。
在正常生理环境下,与胃肠道中大量的酶系相比,有时口服常规剂量的酶抑制剂所产生的作用并非十分明显。Yamamoto等[2]研究了大豆胰蛋白酶抑制剂等5种酶抑制剂对胰岛素肠道吸收的影响,发现这5种酶抑制剂能够促进胰岛素在大鼠大肠中的吸收,但是不能促进胰岛素在小肠中的吸收,这可能是由于小肠中酶分泌量较大的缘故。
同时在长期用药时,酶抑制剂对胃肠道中酶系的抑制作用可能干扰人体对蛋白质正常的消化吸收,并且可能对人体胃肠道的结构和功能带来可逆甚至不可逆的损伤。酶抑制剂的长期使用还可能刺激胃肠道分泌更大量的酶,从而降低用药的效果。这些都是目前添加酶抑制剂所存在的问题。
另外,一些新型的酶抑制剂,如Bowman-Birk酶抑制剂,其相比传统的酶抑制剂有更高的活性,但是对人体的安全性还有待进一步研究。
1.2 添加吸收促进剂
吸收促进剂是能显著提高药物对胃肠道渗透性的分子的统称。传统的吸收促进剂包括乙二胺四乙酸(EDTA)、柠檬酸、水杨酸、胆汁酸盐及其衍生物等。这类分子的作用机制有4种:(1)增加肽类和蛋白质类药物的溶解度;(2)吸收促进剂的阳离子与膜表面的阴离子结合,促进吸收,提高生物利用度;(3)通过扰乱膜上的磷脂层来降低膜的阻碍作用;(4)打开消化道黏膜上皮细胞间的紧密连接。其中壳聚糖作为一种常用药物载体,其正电的铵基与带负电的细胞膜相互作用,使细胞紧密连接蛋白(ZO-1)减少,F-肌动蛋白结构发生变化,从而可以暂时打开细胞间的紧密连接,促进药物的细胞间转运。常用胃肠道给药的吸收促进剂见表1。

表1 常用胃肠道给药的吸收促进剂
虽然吸收促进剂可以使蛋白类等分子量较大的药物在肠道中的吸收得到改善,但长期用药的安全性应当引起制剂设计者的重视。目前使用的一些新型的吸收促进剂,如L-精氨酸(NO供体)、产气荚膜梭菌肠毒素等,它们具有可打开细胞的紧密连接,促进药物的吸收的特点[3]。虽然据称这类吸收促进剂对人体毒副作用较传统促进剂更小,提示安全性较传统促进剂高,但在使用特别是长期使用时仍需慎重。
1.3 进行蛋白质化学修饰
蛋白质的化学修饰是蛋白质类药物胃肠道给药研究的热点。对蛋白质进行化学修饰,可以屏蔽蛋白质中某些酶系的作用位点,提高药物稳定性、脂溶性和对肠道的渗透性。蛋白质修饰剂包括右旋糖酐、肝素、聚乙烯吡咯烷酮、聚氨基酸、聚乙二醇(PEG)等,其中以PEG类最为常用。
Chi等[3]制备的经蛋白质修饰的类高血糖素,通过分别将8位和30位的丙氨酸替换为甘氨酸和半胱氨酸,并且在30位接入PEG长链,可以防止蛋白质在8位、15位、18位、19位、27位和31位的降解,提高了药物的稳定性。蛋白质修饰的类高血糖素图示见图1[4]。
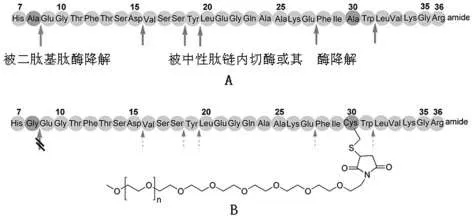
图1 蛋白质修饰的类高血糖素图示
窦怀智等[5]采用PEG-醛对胰岛素进行修饰,发现通过PEG-醛修饰,可以减少胰岛素单体的自缔合,提高胰岛素在溶液中的稳定性,抑制胰蛋白酶和糜蛋白酶对胰岛素的降解,因而具有口服给药的应用前景。Gershonov等[6]研究发现利用己酸对胰岛素进行化学修饰,提高了胰岛素的亲脂性和在大肠内的吸收。
前体药物的应用在很大程度上拓宽了蛋白质类药物的应用范围,但修饰剂呈现多种聚合,选择性不够高,修饰后的药物分子量分布宽、活性低、稳定性有时不够理想的特点,均已成为蛋白质修饰中的突出问题。而蛋白质结构的复杂性和缺乏有效合成工艺也已成为蛋白质修饰的研究瓶颈。故选择性更佳、活性更高的修饰剂的制备以及适宜修饰条件的探索将可能成为蛋白质修饰研究的发展方向。
1.4 利用特殊转运机制
1.4.1 穿膜肽(CPP)。CPP是一类可以通过非能量依赖途径穿透所有真核细胞的细胞膜的多肽类物质[4,7,8]。CPP通过化学键与其他大分子甚至纳米粒相连,还可以将大分子或纳米粒转运至细胞内,甚至可以运载酶穿透血脑屏障。目前见诸文献报道的CPP有人免疫缺陷病毒1型(HIV-1)、寡精氨酸(Oligoarginine)等。
Liang等[9]用4-(N-甲基马来酸亚胺)-环己胺-1-羟酸酯将胰岛素和一种CPP相接,证明了该复合物可以使胰岛素穿透人结直肠腺癌(Caco-2)细胞。有研究[10]用CPP作为载体,用于胰岛素的胃肠道给药,发现具有6、8、10个精氨酸残基的CPP可以极大地提高胰岛素在小肠的吸收。
CPP对蛋白质的吸收促进机制为直接干扰细胞膜的磷脂双分子层或介导细胞的胞吞作用[11]。在体外研究[12,13]中发现,CPP对细胞的毒副作用几乎为零。在体内应用中,CPP的毒副作用尚未被发现。由此可见CPP在促进蛋白质肠吸收中可能具有较大的应用前景。
1.4.2 转铁蛋白(Tf)。Tf为一种β1球蛋白,在体内通过转铁蛋白受体(TfR)介导三价铁离子(Fe3+)的转运。如图2所示,类似Tf-TfR对Fe3+的转运,是将蛋白质类药物与Tf通过共价键结合后,Tf-蛋白会与TfR发生特异性结合,然后在质子泵的作用下,Tf-TfR-蛋白质复合物被囊泡包裹进入细胞。在细胞中,蛋白质类药物和Tf分离,以外排的方式排出细胞,进入血液。而Tf-TfR在高尔基体的作用下,回到细胞的表面,完成Tf与TfR的分离。

图2 转铁蛋白转运药物的跨膜机制图示
有研究[14]表明蛋白质或白细胞集落刺激因子和Tf结合形成的复合物,能容易地通过Caco-2细胞的单层膜。并且这2种复合物在小鼠体内的实验表明,复合物具有使血糖水平的下降与中性粒细胞数目上升的作用。
Tf-TfR介导的转运机制为蛋白质类药物的口服给药提供了一条可以实施的途径。但是摄入大量外源性的Tf会对人体产生一定影响,这种物质对人体是否安全、它的转运速度及程度是否可控,还需大量的工作进行验证。
2 剂型手段
采用纳米粒、微乳、脂质体、水凝胶等剂型手段,均可有效提高蛋白质类药物的胃肠道吸收。
2.1 纳米粒
纳米粒的粒径范围一般小于500 nm,这种粒径使其能够直接作用于细胞。纳米粒系统能够进入与内脏相关的淋巴系统,如伊氏节结、孤立淋巴小结。伊氏节结为淋巴小囊,其表面有M细胞。纳米粒主要分布于M细胞的顶端区域,然后通过胞饮作用被M细胞吞噬。蛋白质类药物通过M细胞和肠上皮细胞的细胞间隙进入血液。组织片段的解剖证实了≤100 nm的粒子通过黏膜下层扩散,而>10 μm的粒子主要集中在组织的上皮层。这就使得载药纳米粒可以直接进入细胞,提高药物的吸收效率。
Prego等[15]制备的PEG修饰的壳聚糖降钙素纳米粒,可以提高降钙素在胃肠液中的稳定性,并且提高和延长了降钙素在肠道中的吸收。调节壳聚糖与PEG的比例,可以使纳米粒具有更好的稳定性、低毒性,提高其载药性能。
在纳米粒表面接上特有的配基,可以提高其转运效率。Kishore等[16]制备了维生素B12-右旋糖酐胰岛素纳米粒。研究发现这种纳米粒可以保护65%~83%的胰岛素不在胃肠道中降解,并且能够有效地介导胰岛素吸收进入血液。小分子量的右旋糖酐效果优于大分子量的右旋糖酐。维生素B12微球可通过维生素B12-内体-内体受体介导内吞(维生素B12-IF-IFR RME)旁路介导胰岛素的吸收,其吸收部位位于伊氏节结[17,18]。
由于目前有应用前景的口服纳米粒的生物可降解材料,如聚乳酸(PLA)、聚羟基乙酸(PGA)以及二者的共聚物(PLGA)等均为水难溶性材料,这就给水溶性药物的载药带来很大困难。因此提高水溶性药物的脂溶性是提高该类药物载药量较好的方法。对亲水蛋白质进行亲脂性的修饰也是提高蛋白质黏膜渗透性的较好方法。但是这种方法常使蛋白质发生非可逆性变性。疏水性的离子对也被用来提高水溶性蛋白质的脂溶性,但这种方法仅适用于碱性蛋白质,这种蛋白质具有高的等电点,而对于胰岛素等酸性蛋白质,还未见有相关报道。有研究[19]通过先将胰岛素和磷脂混合,后制备胰岛素的反相胶束,然后将胰岛素载入PLGA和PLA纳米粒,制备了胰岛素的口服制剂,其粒径为200 nm,包封率可达到90%。同时进行的小鼠体内实验亦证实该制剂具有显著的降血糖作用。
2.2 微乳
乳剂中的油相可能增加膜通透性,另外乳剂也能够增加药物的淋巴转运,从而提高生物利用度。国外已有环孢菌素的微乳制剂上市。
微乳以其热稳定性、对蛋白质类药物的保护作用以及高分散性的特点,在蛋白质载药领域具有着一定的应用优势。油包水(W/O)型微乳可以显著提高水溶性蛋白质类药物的小肠渗透性,提高其生物利用度[20]。这种微乳也可以显著提高跨细胞途径和细胞间途径标志药物的渗透性。其机制可能是微乳诱导的细胞膜结构和流动性的改变所致。有研究[21]制备了蚯蚓溶纤蛋白酶W/O型微乳,试验表明该载药系统能保护蛋白质在胃肠道中不被破坏,并且显著提高药物在小肠的吸收程度。连续给药7 d后未发现任何的组织损伤,从一定程度反映了该给药系统的安全性。
长期用药时,在大量存在表面活性剂和助表面活性剂的情况下,微乳的安全性是研究工作者不容忽视的问题。因此寻找更安全的表面活性剂、助表面活性剂以及油相是微乳应用于临床的关键。
2.3 脂质体
脂质体可以介导药物进入细胞,其主要途径有4种:脂质体进入细胞前释放药物、脂质体与细胞膜的融合、脂质体与细胞吸附释药、脂质体被细胞吞噬。由于蛋白质类药物的膜渗透性很差,因此后三者可能是主要机制。另外细胞间通路可能也参与脂质体和细胞的相互作用。脂质体与细胞的作用方式见图3[22]。
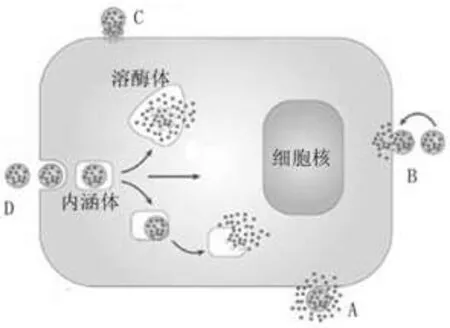
图3 脂质体与细胞的作用方式
有研究[23]使用Caco-2细胞模型在不同胰岛素浓度下进行试验,以考察口服胰岛素脂质体吸收动力学机制,发现脂质体可以促进胰岛素的吸收,而药物吸收机制不是简单的被动扩散,胰岛素可以分别从胞内、胞外途径通透。
研究[24]发现口服胰岛素脂质体后,小鼠血糖浓度既得到了有效控制,又不至于引起大的副作用,尤其是表面经PEG改性后的胰岛素脂质体,其突释现象较小且药效维持时间较长。Kim等[25]制备的含有PEG的胰岛素脂质体比普通的胰岛素脂质体具有更长的作用时间。
尽管脂质体可以通过各种途径促进药物的胃肠道吸收,但由于其自身的不稳定性、长期用药可能带来的副作用等不足,大大限制了它的应用。
2.4 水凝胶
pH敏感的水凝胶可以保护蛋白质不受降解。其原因为在胃部的酸性环境中水凝胶的膨胀率很低,对蛋白质类药物的释放很少。并且水凝胶具有生物黏附性与降解性,可延长释药系统在吸收部位的作用时间及药物的吸收时间[26,27],同时由于pH敏感水凝胶具有与钙离子(Ca2+)的结合能力和对酶的诱捕能力,所以pH敏感水凝胶也可防止胰岛素的失活。凝胶在肠中快速吸收大量水,在机械压的作用下,可以打开肠壁的紧密连接,促进药物的吸收。
有研究[28]制备了聚丙烯酸-丙烯酰胺-羧甲基壳聚糖胰岛素水凝胶,将其用于小鼠体内实验结果表明,在十二指肠、空肠、结肠、回肠中,该系统对胰岛素的转运能力是游离胰岛素的2~3倍。
由于高分子片段的不连贯性,水凝胶在压力的作用下很容易断裂成小的碎片,从而减弱了其对酶的诱捕能力和机械作用。因此寻找好的凝胶材料,可以提高药物的传输效率。
3 结语
虽然各种技术和剂型的应用已经大大提高了蛋白质类药物在胃肠道的吸收能力,但由于各种技术或剂型均有其自身局限性,至今仍没有蛋白质的口服制剂上市。对蛋白质胃肠道给药系统的开发,解决蛋白质类药物的口服胃肠道吸收问题,依赖于对胃肠道生理结构和功能机制的进一步认识以及新材料、新剂型、新技术的进一步发展。相信在不久的将来,蛋白质类药物的胃肠道吸收研究一定会取得新的进展。
[1] Lee HJ,Amidon GL.The effect of enzyme inhibitor and absorption site following[D-ala2,D-leu5]enkephalin oral administration in rats[J].Biopharm Drug Dispos,2002,23(4):131.
[2] Yamamoto A,Taniguchi T,Rikyuu K,et al.Effect of various protease inhibitors on the intestinal absorption and degradation of insulin in rats[J].Pharm Res,1994,11(10):1 496.
[3] Chi YS,Zhang HB,Huang WL,et al.Microwave-assisted solid phase synthesis,PEGylation,and biological activity studies of glucagon-like peptide-1(7-36) amide[J].Bioorg Med Chem,2008,16(16):7 607.
[4] Amand HL,Boström CL,Lincoln P,et al.Binding of cell-penetrating penetratin peptides to plasma membrance vesicles correlates directly with cellular uptake[J].Biochim Biophys Acta,2011,1 808(12):1 860.
[5] 窦怀智,侯 晋.PEG-醛修饰胰岛素产物的构象、纤维化和抗酶解能力[J].化学通报,2009,72(2):171.
[6] Gershonov E,Goldwaser I,Fridkin M,et al.A novel approach for a water-soluble long-acting insulin prodrug:design,preparation,and analysis of[(2-sulfo)-9-fluorenylmethoxycarbonyl](3)-insulin[J].J Med Chem,2000,43(13):2 530.
[7] Verdurmen WPR,Thanos M,Ruttekolk IR,et al.Cationic cell-penetrating peptides induce ceramide formation via acid sphingomyelinase:Implications for uptake[J].J Control Release,2010,147(2):171.
[8] Schmidt N,Mishra A,Lai GH,et al.Arginine-rich cellpenetrating peptides[J].Febs Lett,2010,584(9):1 806.
[9] Liang JF,Yang VC.Insulin-cell penetrating peptide hybrids with improved intestinal absorption efficiency[J].Biochem Biophys Res Commun,2005,335(3):734.
[10] Morishita A,Kamei N,Ehara J,et al.A novel approach using functional peptides for efficient intestinal absorption of insulin[J].J Control Release,2007,118(2):177.
[11] Tréhin R,Merkle HP.Chances and pitfalls of cell penetrating peptides forcellular drug delivery[J].Eur J Pharm Biopharm,2004,58(2):209.
[12] Zorko M,Langel U.Cell-penetrating peptides:mechanismand kinetics of cargo delivery[J].Adv Drug Deliv Rev,2005 ,57(4):529.
[13] Saar K,Lindgren M,Hansen M,et al.Cell-penetrating peptides:a comparative membrane toxicity study[J].Anal Biochem,2005,345(1):55.
[14] Widera A,Bai Y,Shen WC.The transepithelial transport of a GCSF-transferrin conjugate in Caco-2 cells and its myelo-poietic effect in BDF1 mice[J].Pharm Res,2004,21(2):278.
[15] Prego C,Torres D,Megia E,et al.Chitosan-PEG nanocapsules as new earners for oral peptide delivery:effect of chitosan pegylation degree[J].J Control Release,2006,111(3):299.
[16] Kishore KB,Russel-Jones GJ,Yandrapu SK,et al.A novel vitamin B12-nanosphere conjugate carrier system for peroral delivery of insulin[J].J Control Release,2007,117(3):421.
[17] Jun T,Kamm W,Breitenbach A,et al.Biodegradable nanoparticles for oral delivery of peptides:is there a role for polymers to affect mucosal uptake[J].Eur J Pharm Biopharm,2000,50(1):147.
[18] Chalasani KB,Russel-Jones GJ,Jain AK,et al.Effective oral delivery of insulin in animal models using vitamin B12-coated dextran nanoparticles[J].J Control Release,2007,122(2):141.
[19] Cui FD,Shi K,Zhang LQ,et al.Biodegradable nanoparticles loaded with insulin-phospholipid complex for oral delivery:Preparation,in vitro characterization and in vivo evaluation[J].J Control Release,2006,114(2):242.
[20] Wu HF,Zhou A,Lu CH,et al.Examination of lymphatic transport of puerarin in unconscious lymph duct-cannulated rats after administration in microemulsion drug delivery systems[J].Eur J Pharm Biopharm,2011,42(4):348.
[21] Cheng MB,Wang JC,Li YH,et al.Characterization of water-in-oil microemulsion for oral delivery of earthworm fibrinolytic enzyme[J].J Control Release,2008,129(1):41.
[22] Torchilin VP.Recent advances with liposomes as pharmaceutical carriers[J].Nat Rev Drug Discov,2005,4(2):145.
[23] 王 琰,李正荣,潘飞燕,等.口服胰岛素脂质体吸收的细胞学机制[J].中国医院药学杂志,2005,25(3):193.
[24] Kumar A,Lahir SS,Singh H,et al.Development of PEGDMA:MAA based hydrogelmicroparticles for oral insulin delivery[J].Int J Pharm,2006,323(1-2):117.
[25] Kim A,Yun MO,Oh YK,et al.Pharmacodynamics of insulin in polyethylene glycol-coated liposomes[J].Int J Pharm,1999,180(1):75.
[26] Rasool N,Yasin T,Heng JYY,et al.Synthesis and characterization of novel pH-,ionic strength and temperature-sensitive hydrogel for insulin delivery[J].Polymer,2010,51(8):1 687.
[27] Sajeesh S,Vauthier C,Gueutin C,et al.Thiol functionalized polymethacrylic acid-based hydrogel microparticles for oral insulin delivery[J].Acta Biomater,2010,6(8):3 072.
[28] Yin LC,Ding JY,Fei LK,et al.Beneficial properties for insulin absorption using superporous hydrogel containing interpenetrating polymer network as oral delivery vehicles[J].Int J Pharm,2008,350(1-2):220.

