喹啉酸所致亨廷顿病动物模型
邢秋云,李 峰
(1.首都医科大学基础医学院,北京 100069;2.首都医科大学北京神经科学研究所、北京市神经再生及修复研究重点实验室、教育部神经变性病学重点实验室,北京 100069)
喹啉酸所致亨廷顿病动物模型
邢秋云1,李 峰2
(1.首都医科大学基础医学院,北京 100069;2.首都医科大学北京神经科学研究所、北京市神经再生及修复研究重点实验室、教育部神经变性病学重点实验室,北京 100069)
亨廷顿病(Huntington's disease,HD)是以不自主舞蹈样动作、进行性认知障碍,痴呆为特征的一种常见染色体显性遗传病。兴奋性毒性作用是目前公认的HD发病机制之一,其中喹啉酸(quinolinic acid,QA)作为神经兴奋性毒素,可以损伤相应神经元,导致大脑功能障碍,从而可有效模拟HD的相关改变。本文将就QA动物模型在模拟HD时的优缺点和目前QA在药物研究、疾病治疗等不同方面的应用进行综述。
亨廷顿病;喹啉酸;模型,动物;应用
1 亨廷顿病概述
亨廷顿病,又名遗传性舞蹈病、Huntington舞蹈病,是典型的常染色体显性遗传病,属于延迟显性亚型。HD是一种中枢神经系统退行性病变,一般30~40岁发病,致病基因 ITl5定位于4p16.3,基因产物为huntingtin蛋白,该蛋白与发育有关。ITl5基因5'端编码区有CAG三核苷酸重复,正常拷贝数为11~34次,患者拷贝数高达37~100余次。CAG重复序列能表达产生一段多聚谷氨酰胺(poly-Q),它能连在Huntingtin蛋白的N端造成蛋白的聚集和沉降,从而使该蛋白的功能减弱或丧失,或使该蛋白获得新功能而致病;Green则提出谷氨酰胺转移酶能够使huntingtin蛋白的poly-Q与其他肽链的赖氨酸残基发生交联,产生一种谷氨酰赖氨酸异构肽,经降解后残留的异构肽会对细胞产生毒性作用。此外,还发现与细胞凋亡有关的一组蛋白酶Caspase可能参与 HD 的发病[1]。
2 喹啉酸动物模型的建立
2.1 发病机制
2.1.1 HD发病机制:目前,对于HD的发病机制有多种理论和假说,这些假说大致可分为两类:一类是在HD致病基因发现之前依据已知的病理和生理变化提出的,包括兴奋毒性(excitotoxicity)、氧化应激(oxidative stress)和能量代谢受损(impaired energy metabolism)等学说;另一类是在发现 IT15基因之后,根据对该基因及其表达产物huntingtin的研究所提出的,以“毒性功能获得”(toxic gain of function)为主的观点。两类学说间有一些共同的通路。根据第二类学说,IT15基因中 CAG重复序列异常扩增后,一方面导致体内野生型 huntingtin(wHtt)的缺失,另一方面产生突变性huntingtin(mHtt)。
(1)wHtt的缺失:wHtt与 Htt相关蛋白1(huntingtin associated protein 1,HAP1)结合形成复合体,调控P150、动力蛋白(dynein),动力蛋白激活蛋白(dynactin)形成复合体,从而促进脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)膜泡的微管运输。在HD患者中,wHtt缺失使其功能丧失,而对细胞产生致毒性作用。
(2)mHtt的产生:mHtt通过干扰胞内DNA的正常转录抑制PGC-1α表达干扰能量产生或通过降低ATP产量使细胞供能障碍导致异常程序性细胞死亡两个方面对神经元产生毒性作用。
2.1.2 喹啉酸致病机制:Schwarcz等发现在HD患者死后的大脑中3-羟邻氨基苯甲酸加氧酶的水平有所升高,其中纹状体增幅最大,神经元最脆弱,这些数据显示在HD纹状体内存在着由正常水平的犬尿酸转化成毒性水平的喹啉酸的通路,这一通路可能促进该病的神经细胞的死亡。鼠纹状体内注射喹啉酸导致了Htt蛋白的上调,这与人类HD发病机制的关键蛋白毒素的表达有联系。研究表明,过量表达wHtt可以保护培养的神经细胞不被喹啉酸的毒性作用诱导,这种喹啉酸和Htt蛋白的紧密联系和潜在的蛋白相关的毒性作用使得它成为测试HD有关的特定假设模型。喹啉酸不能通过血脑屏障,因此需直接纹状体注射给药来导致大鼠、小鼠和灵长类动物的纹状体神经退行性变,进而产生与人类HD相似的模型。这些模型不但显示了与HD特征相一致的特有表现,而且强烈地表明了兴奋毒性过程在这一疾病发病机制中所起的作用[2]。
喹啉酸诱导的动物模型与早期HD的表现更为相似,影响中等棘神经元的数量。在HD,纹状体生长激素抑制素和神经肽神经元至少增加了3倍,喹啉酸注射后这些细胞出现类似改变,增加约2倍。黑质内神经递质GABA分泌减少,GABA受体数量增加,这些均与HD中所见的相似。另外,这一模型也模拟了HD脑中的神经元死亡机制。HD中细胞死亡的确切机制不明,其中谷氨酸诱导的兴奋性毒性细胞死亡是可能的原因之一。在HD中,中等棘神经元因富含NMDA受体而较其他细胞类型对兴奋毒性细胞死亡更敏感,喹啉酸在动物模型中有着相似的作用形式:向NMDA受体丰富的纹状体注射喹啉酸,导致Ca2+内流增加,ATP产生减少及相应的兴奋性毒性细胞死亡,这些都模拟了人类HD中某些方面的神经退行性变[3]。如果 NMDA兴奋毒性的过程在HD选择性神经变性中起作用,则因这些受体耗竭造成的高密度含有这些受体的神经细胞优先受损伤。Young等[5]的发现正是证明了这一点:相较于其他受体亚型,NMDA受体呈现显著性的枯竭。然而兴奋性毒性与坏死密切相关,在喹啉酸模型中的细胞死亡模拟了HD脑中所见的细胞凋亡,DNA片段化及TUNEL染色则显示出其与HD早期和中期阶段的凋亡是相一致的[2]。
2.2 病理学特点
2.2.1 HD病理学特点:HD主要侵犯基底节和大脑皮质,具有高度的区域选择性。NMR与CT检查显示HD患者基底节中纹状体退变,尤以尾状核和壳核最严重。尾状核尤其是头部萎缩明显并发生脱髓鞘改变,使得侧脑室额角扩大,脑室系统形态呈特征性的蝴蝶状改变,纹状体萎缩程度随着病情的延长而呈进行性加重。正常情况下尾状核将GABA(γ-氨基丁酸)的纤维投射到苍白球和黑质中,黑质也将多巴胺能的纤维投射到尾状核乙酰胆碱能的中间神经元,在HD各种神经递质的传递和神经元的存在都受到了不同程度的影响,其中以中等中间神经元和纹状体向苍白球或黑质投射的有棘神经元的损害最为严重,大中等无棘神经元很好的保留,表达神经肽Y的无棘纹状体神经元在一些HD大脑中上调。此外,HD患者大脑皮质(特别是额叶)也有显著的损害,这导致了患者部分高级认知功能的障碍。病变还涉及其它一些部位,包括海马、小脑、下丘脑侧结节核、杏仁核及一些丘脑神经核。在HD尸检结果中还表明纹状体钙结合蛋白的mRNA、蛋白水平和calbindin免疫反应阳性神经元数明显减少。
2.2.2 喹啉酸所致的动物模型病理形态学改变:一般水平的喹啉酸不能导致损伤,小幅度的增高剂量才可以产生毒力。喹啉酸诱导的动物模型与HD早期的表现相似,可产生活动过度[2],不过任何剂量的喹啉酸都无法模拟出疾病后期患者活动低下的体征。尽管不同实验室通过向雄性大鼠的纹状体尾壳核注射喹啉酸(QA)建立动物模型,但所用QA的浓度和剂量差异较大[4]。如 Tattersfield 等[5]在 300~350 g Wistar雄性大鼠前卤前 0.0 mm,距中线-2.8 mm,硬膜下 -5.0 mm坐标位置注射 100 nmol喹啉酸(见表1)。
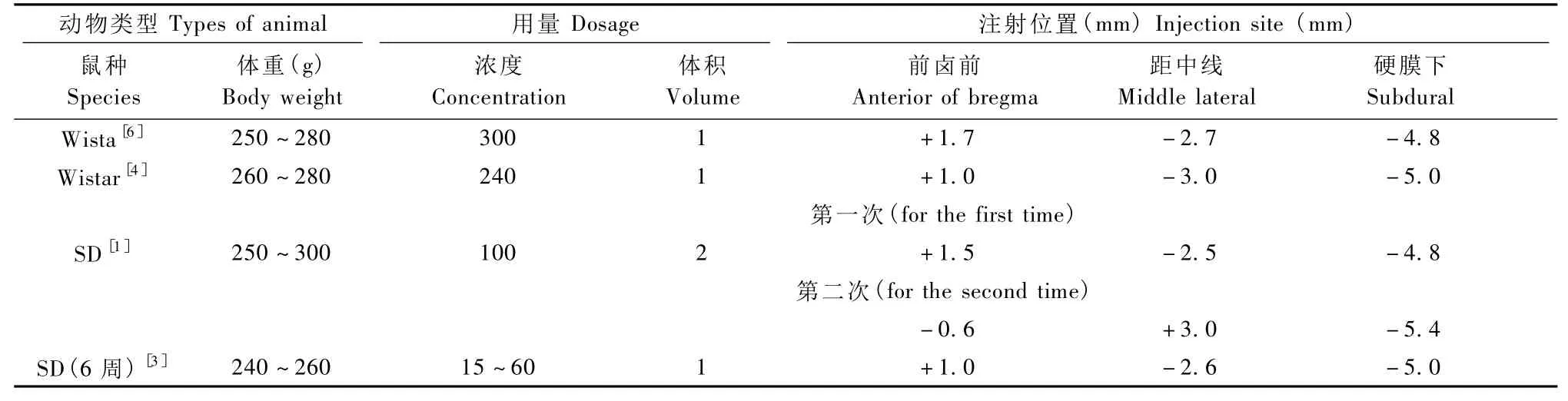
表1 不同剂量喹啉酸所致的动物模型Tab.1 Animal models induced by quinolinic acid at different doses
注入喹啉酸的大鼠在纹状体区表现出明显的神经元损失,主要使注射部位背纹状体内GABA能纹状体投射神经元损失。尤其是喹啉酸诱导产生的兴奋性毒性导致在24 h内含有氨基丁酸和P物质的背纹状体中等棘神经元的变性[6]。病变区以中央区明显的星形胶质细胞增生和神经元显著枯竭为特点[4],并且在进行 calbindin免疫组化染色观察中,模型组注射侧纹状体区calbindin阳性神经元的数目较假手术组注射侧和正常组同侧纹状体区明显减少,阳性细胞的平均灰度值较假手术组高,也即calbindin蛋白表达较假手术组低[3],其与神经病理检测中HD患者存在明显的纹状体神经元丢失相符合。
2.3 行为学改变
基底节运动通路受损引发运动过度,即亨廷顿病的主要临床症状-舞蹈样动作;大脑皮层受损导致患者认知功能障碍,晚期亨廷顿病多见痴呆。可通过以下行为学检测方法进行测试.
2.3.1 旷场实验(open-field test,OFT):该实验需要一个黑色环形的开放箱子,直径120 cm,高30 cm的音圆台。置于隔音的小室内,周围环境均一,除了条纹图案(20 cm×10 cm)的外壁。由红灯(80 W)照明。将5个不同的物体(A,B,C,D,E),凌置物体F作为非空间改变反应的对照。在实验中主要观察记录跨格次数、后腿站立次数及理毛次数,其中跨格次数及后腿站立次数是动物对新环境的探索行为及兴奋性的反映。理毛次数反映动物对环境的习惯化。喹啉酸大鼠显示出探索环境(无论是熟悉的或不熟悉的)需要花费更多的时间,在较长时间病变组尤其明显,这进一步支持了持续运动概况的假说[6]。Maria Luisa Scattoni等所做的旷场实验显示喹啉酸模型鼠对新环境的探索行为、兴奋性反应能力及适应性下降。这些结果表明,在不受活动与空间以及对物体新颖性辨别能力的影响下,体内注射喹啉酸产生的对新环境的一般探索模式中不同行为的进行性的改变。
2.3.2 Morris水迷宫实验 (Morris water maze,MWM):水迷宫装置的黑色内壁金属圆桶直径150 cm,水深20 cm,水温(26±1)℃,水墨染至非透明。在SW象限正中距离池壁30 cm处置一直径10 cm圆形黑色平台,没入水面下2 cm。图像自动采集系统同步记录大鼠的运动轨迹,Morris水迷宫数据采集分析软件记录相关数据及图像结果。于术后第14天开始测试,总共历时4 d。前3 d行定位航行实验,测试第4天行空间探索实验。①定位航行实验(navigation test):每天2次,分为间隔8 h以上的两个训练时段进行。每个时段训练4次,分别从4个坐标象限内标定的入水点将大鼠放入水中,其找到平台的时间为逃避潜伏期。如果120 s内未能找到平台,则将其引导至平台上,停留20 s,记录其逃避潜伏期为120 s。4次成绩的均值为该训练时段的成绩。各组动物的逃避潜伏期均随训练时段的增多而缩短,而HD模型的运动速度均较假手术和正常组慢,且运动速度随着训练次数的增加而逐渐减慢(速度减慢说明 HD模型鼠存在运动障碍)[5]。②空间探索实验(spatial exploration experiments):在进行了3 d定位航行实验后,撤去平台,取随机选取入水点将大鼠放入水中,记录其在120 s内的原平台象限记忆频度及4环内记忆得分。喹啉酸大鼠的视觉空间探索能力(损伤的大鼠出现空间和新事物的分歧,对通过替换或移走物体来重置的实验环境作出反应)表现出缺失。Maria Luisa Scattoni等人发现喹啉酸(QA)模型大鼠的学习记忆能力下降,空间参考记忆缺陷[5]。
2.3.3 对象检索迂回任务(object-retrieval detour task,ORDT):此测试需要被测者从一个原来只有一个开放透明的框边绕过框索取奖励。在猴子身上单侧局部损伤后部壳核导致在阿普吗啡注射后呈现出肌力失常和运动障碍。在非人类哺乳动物中双侧损伤后部壳核48 h后导致舞蹈样的症状,在双侧损伤非人类哺乳动物的尾状核和壳核导致在ORDT中缺失。ORDT检测程序性记忆力和对运动任务计划的操控能力并需要完整的前纹状体环路,这一线路在双侧喹啉酸模型中断,喹啉酸损伤的猴子表现出动力规划缺损。这些缺损可反映人类HD的认知能力改变,包括视觉空间认知的亏损、记忆力缺乏、程序记忆缺陷。
2.3.4 诱导旋转实验:在啮齿类动物中,单侧的喹啉酸损伤导致受阿普吗啡的诱导而产生与损伤侧大脑半球方向相同的不对称旋转行为。为了检测无药物损伤条件下的动力性能的损伤,身体摆动试验(body swing test)被用于喹啉酸损伤的大鼠:将单侧损伤的大鼠通过尾巴悬挂起来,当大鼠向损伤侧大脑半球摆动时,指示对侧纹状体的功能性损伤。旋转行为反映了喹啉酸诱导的HD模型大鼠与人类HD的基底核神经回路的失调具有相似性[5]。
总的来说,在人类亨廷顿患者中,以兴奋毒性、氧化应激和能量代谢受损及基因重复异常扩增等方式引起细胞的死亡,导致基底节、大脑皮层、纹状体-尾核和壳核损伤,在患者细胞中也可见到Htt蛋白、脑啡肽、P物质、钙结合蛋白、钙结合蛋白低分子量蛋白质、无棘中间神经元水平的上调以及GABA能中间棘神经元变性等一系列病变;通过在大鼠、小鼠、非人类灵长类动物主动注射喹啉酸(QA),在兴奋毒性作用下导致大脑皮层或纹状体-壳核损伤而建立的动物模型,产生了与人类HD患者类似的细胞病变。QA模型所表现出的运动机能亢进、阿普吗啡诱导的肌张力失常、运动障碍及高剂量QA注射下的不自主运动障碍等运动功能改变和对视觉空间的探索障碍、程序性记忆缺损及记忆能力下降等的认知功能下降,都能较好的与人类HD患者运动上呈现的舞蹈样不自主动作及高级认知功能的障碍相契合。
3 喹啉酸动物模型的应用
除了基因小鼠,喹啉酸损伤的老鼠可能是一个合适的用以测试新药物减缓HD疾病进展以及对HD细胞治疗研究等的有效手段。
3.1 测试新药物
鉴于喹啉酸动物模型很好地模拟了亨廷顿病的病理学和行为学的改变,目前已应用该模型进行药物治疗研究。如对丙酮酸(pyruvate)、洛利普兰(rolipram)的神经保护作用的研究,对苄甲炔胺(deprenyl)加强喹磷酸兴奋毒性作用以及精胺(spermine)[7]提高识别记忆的研究等都是较好的动物模型:喹啉酸的注射导致纹状体病变,丙酮酸使得该病变减少并明显改善不同类型纹状体神经元的生存[3]。与人亨廷顿病相同,在喹啉酸模型中也出现了CREB水平的降低。洛利普兰是一种磷酸二酯酶IV型抑制剂,可以提高cAMP反应性元素结合蛋白(CREB)的磷酸化作用,在HD中起到了一定的保护作用。因此,洛利普兰可以考虑作为HD治疗的有效方法[8]。在对苄甲炔胺诱导的神经毒性作用的检测时,Pablos等[9]发现在纹状体注射喹啉酸后,苄甲炔胺不能够防止喹啉酸诱导的损伤反而加强GABA阳性数量、星形胶质细胞数量的损耗和小神经胶质细胞的兴奋性降低。
3.2 细胞治疗研究
近年来,对于亨廷顿病的治疗方法除了药物治疗外,更引起人们广泛关注的似乎是细胞治疗等,喹啉酸动物模型作为很好的模拟亨廷顿病的动物模型已应用到对细胞治疗的研究中。研究表明亨廷顿病的动物模型及患者在应用了胎儿的纹状体移植取得了一致的成功[10];近期也有研究调查表明成年大鼠神经母细胞移植到纹状体后改善了喹啉酸损伤的亨廷顿病大鼠模型行为上的功能等等[11]。
4 喹啉酸动物模型的缺点
喹啉酸动物模型仍存在着一些不足,主要表现在以下几个方面。首先,在功能机制和HD基因间并无清晰地联系,其本身无mHtt的产生和错排,及伴随的神经和细胞质的包含物;细胞形成的包含物的排列是隔离毒素蛋白的保护机制还是细胞功能障碍较为直接的原因还未定论;此外,HD中的细胞死亡是进行性的,发病年龄也是与 mHtt中 CAG重复序列的数目成反比的,而喹啉酸诱导的动物模型细胞死亡是即刻的非进行性的;而且,HD患者的症状是随时间进行性发展的,认知功能上的一些改变通常在运动和性格改变等症状开始之前发生并且很严重。尽管此种动物模型可以复制患者的认知障碍等症状,但是却难以展现诸如抑郁、自杀倾向、躁狂和强迫性行为等性格上的改变;最后,由喹啉酸(QA)诱导的用于研究HD神经疗法的动物模型导致大量的细胞死亡,使得在研究该疾病的进行性特性变得无效。
尽管喹啉酸动物模型存在着诸如以上所说的缺点,但因其在发病机制,亦或是行为学病理学上能够较好的模拟HD,在对HD做进一步研究中仍是不错的模型,为治疗HD的前景建立了一个基础平台。
[1] Visnyei K,Tatsukawa KJ,Erickson RI.Neural progenitor implantation restores metabolic deficits in the brain following striatal quinolinic acid lesion[J].Exp Neurol,2006,197:465 - 474.
[2] Ramaswamy S,McBride JL,Kordower JH.Animal models of Huntington's disease[J].2007,48(4):356 -373.
[3] Ryu JK,Kim SU,McLarnon JG.Neuroprotective effects of pyruvate in the quinolinic acid rat model of Huntington's disease[J].ExpNeurol,2003,183:700 -704.
[4] 张伟,张本恕,王育新.喹啉酸所致 Huntington病动物模型的建立及行为学和组织病理学研究[J].神经解剖学杂志,2009,25(2):153 -158.
[5] Tattersfield AS,Croon RJ,Liu YW.Neurogenesis in the striatum of the quinolinic acid lesion model of Huntington's disease[J].Neuroscience,2004,127:319 -332.
[6] Scattoni ML,Valanzano A,Popoli P.Progressive behavioural changes in the spatial open-field in the quinolinic acid rat model of Huntington's disease[J].Behav Brain Res,2004,152:375 -383.
[7] Ferrante RJ.Mouse models of Huntington's disease and methodological considerations for therapeutic trials[J].Biochim Biophys Acta,2009,1792:506 -520.
[8] Velloso NA,Dalmolin GD,Gomes GM.Spermine improves recognition memory deficit in a rodent model of Huntington's disease[J].Neurobiol Learning Memory,2009,92:574 -580.
[9] DeMarch Z,Giampa C,Patassini S.Beneficial effects of rolipram in a quinolinic acid model of striatal excitotoxicity[J].Neurobiol Dis,2007,25:266 - 273.
[10] Pablos de RM,Herrera AJ,Tomás-Camardiel M.Deprenyl enhances the striatal neuronal damage produced by quinolinic acid[R].Molec Brain Res,2005,141:48 -57.
[11] Dunnett SB, Rosser AE. Stem cell transplantation for Huntington's disease[J].Exp Neurol,2007,203:279 - 292.
[12] Vazey EM,Chen K,Hughes SM.Transplanted adult neural progenitor cells survive,differentiate and reduce motor function impairment in a rodent model of Huntington's disease[J].Exp Neurol,2006,199:384 - 396.
[13] Gallina P,Paganini M,Lombardini L.Development of human striatal anlagen after transplantation in a patient with Huntington's disease[J].Exp Neurol,2008,213:241 - 244.
[14] Bantubungi K,Blum D,Cuvelier L.Stem cell factor and mesenchymal and neural stem cell transplantation in a rat model of Huntington's disease[J].Mol.Cell Neurosci,2008,37:454 -470.
[15] Lim HC,Lee ST,Chu K.Neuroprotective effect of neural stem cell-conditioned media in in vitro model of Huntington's disease[J].Neurosci Lett,2008,435:175 - 180.
Animal models of Huntington's disease induced by quinolinic acid
XiNG Qiu-yun1,LI Feng2
(1.Capital Medical University,Beijing 100069,China;2.Beijing Institute for Neuroscience,Capital Medical University,Beijing Center of Neural Regeneration& Repairing,Key Laboratory of Neurodegenerative Diseases of Ministry of Education of China,Beijing 100069)
Huntington's disease(HD)is an autosomal dominant genetic disease characterized by dance-like involuntary movements and progressive cognitive impairment.Excitatory toxicity is recognized as one of the mechanisms of HD pathogenesis.Quinolinic acid(QA)is an excitotoxic drug,which can lead to brain dysfunction by killing the related neurons in the brain,and being a further mimic of changes in HD.This article presents the merits and drawbacks of animal HD models induced by QA as well as the current application of the models in studies of drugs and treatment of this disease.
Huntington's disease(HD);Quinolinic acid(QA);Model,animal;Application
Q95-33,R33
A
1005-4847(2011)01-0084-05
10.3969/j.issn.1005 - 4847.2011.01.019
邢秋云(1988-),女,首都医科大学07级临床医学专业七年制本科生。E-mail:leo776712116@yahoo.cn。
李峰(1973-),女,博士,讲师,主要进行神经变性病再生修复研究。E-mail:lifeng@ccmu.edu.cn。
2010-08-12

