喜树碱含量的测定方法研究
方旭东,陈绍宇
(1.天津渤海职业技术学院,天津300402;2.广西钦州市水利电力勘测设计院,广西钦州535000)
喜树碱含量的测定方法研究
方旭东1,陈绍宇2
(1.天津渤海职业技术学院,天津300402;2.广西钦州市水利电力勘测设计院,广西钦州535000)
本文介绍了喜树碱含量的分析测定方法。样品采用了乙醇超声提取法从喜树叶中提取喜树碱,并用薄层层析法和高效液相色谱法分析测定喜树碱的含量。薄层层析法测定喜树碱的含量使用硅胶G做固定相,v(氯仿):v(丙酮)=70∶30、v(甲醇)∶v(氯仿)=10∶90做展开剂。高效液相色谱法用v(甲醇)∶v(水)=55∶45做流动相,并且流动相流速为1.0mL/min。在波长为254 nm,温度为25℃下检测。每次进样量为5μL。
喜树碱;高效液相色谱;薄层层析;分析测定方法
目前,农药残留、害虫抗药性以及作物药害等农药产生的副作用,是我们需解决的问题之一。生物农药采用天然产物,对人类、环境和作物是低毒、无毒且残留时间较短的。喜树碱是一种具有生物活性可广泛应用于生物农药的物质,本文利用薄层层析(TLC)法和高效液相色谱(HPLC)法对喜树叶中提取的喜树碱含量进行了分析与测定。该法简便、快捷、准确性高,为将来该领域研究提供了可靠的依据。
1 实验仪器、试剂与材料
1.1 实验仪器
高效液相仪、紫外光检测器、色谱工作站、超声波细胞粉碎机、高速离心机、电子天平。
1.2 实验试剂
甲醇,95%乙醇,无水乙醇,丙酮,氯仿,硅胶G(薄板层析用)。
1.3 植物材料
喜树叶于2010年8月采自钦州市水利局喜树园栽培3年生的喜树幼苗,采集喜树嫩叶(顶芽,顶芽以下1~2片叶)。
用天平称取采得的喜树叶约1000 g,并用自来水将其洗净后置于恒温干燥箱内,调整恒温干燥箱温度至40℃烘干24 h,直到材料发脆,再用60目的DWF-TOOA型粉碎机粉碎,将粉碎好的喜树叶装入密封袋后将其置于4℃冰箱中避光保存,待用。
用电子天平精确称取已经烘干及粉碎过的干燥喜树叶(60目)1.000 g置于25mL容量瓶中,向25mL容量瓶中加入95%乙醇16mL进行超声提取4min后,将其取出并冷却至室温,再用LG10—2.4A高速离心机进行离心处理,最后用乙醇定容,待用[1]。
2 喜树碱含量分析测定方法
2.1 TLC法[2~4]
2.1.1薄层板的制备
用电子天平精确称取6.3 g硅胶G(在硅胶中加入12%~14%作为粘合剂的石膏)将硅胶G与1%羧甲基纤维素钠(CMC-Na)调和成匀浆。用手动将已调制好的固定相均匀地涂铺在20 cm×5 cm玻璃板上。将铺好的薄板水平放置,室温下晾干,然后将其放入干燥器中,在110℃下活化0.5 h后在干燥器中保存备用。
2.1.2点样
用0.25mm点样毛细管吸取用乙醇超声法提取的提取液,轻轻垂直接触于点样线上(点样线即距离薄层板底边1~2 cm处),反复点样15次,每次点样必须在上一次点样干燥后再点。要求点样直径不超过2~3mm。
2.1.3展开
层析前将展开剂[展开剂用v(氯仿)∶v(丙酮)=70∶30、v(甲醇)∶v(氯仿)=10∶90]倒入层析缸中,让展开剂挥发使层析缸中气体达到饱和状态,将制好的薄层板并点有样品的一端浸在展开剂中,选用直立上行法展开,层析,完毕后取出薄层板并用铅笔标明溶剂前沿。
2.1.4定位
由于喜树碱对多种生物检测试剂均呈负反应,但在紫外光下有明显的蓝色荧光,因此,本试验将薄层板放入暗室中用紫外光来照射,使薄层板上的斑点显现出来从而检测样品中是否有喜树碱存在。
2.1.5定性
TLC法定性主要依据的是组分斑点的比移值Rf=该组分斑点到原点的距离/溶剂前沿至原点的距离。
2.1.6定量
将薄层板上的样斑取下,溶解,再用分光光度法测定。
2.2 HPLC法[5~7]
Waters600高效液相仪,Waters600泵,Waters 486型紫外光检测器;echsphereODS柱(25cm×4.6 mmID,5μm),流动相为v(甲醇)∶v(水)=55∶45,流速1.0mL·min-1,检测波长254nm,柱温25℃,进样量5μL;按照面积外标法计算。
3 结果与分析
3.1 薄层层析法分析
根据溶剂前沿和喜树碱斑点移动的距离,可以算出喜树碱在氯仿/丙酮展开剂中的比移值Rf(溶质移动距离与流动相移动距离之比)约为0.6;在甲醇/氯仿展开剂中的比移值Rf约为0.80。
3.2 高效液相色谱法分析条件[8~12]
3.2.1检测波长的确定
喜树碱在254nm处有最强吸收,大量研究也以254nm作为喜树碱的检测波长,因此,本试验采用254nm作为紫外检测器的检测波长。
3.2.2流动相的选择
乙腈/水、甲醇/水是高效液相色谱常用的流动相,但考虑到乙腈的毒性较大、成本高,且喜树碱溶于甲醇,所以选择甲醇/水作为流动相。因此,本试验选用流动相,v(甲醇)∶v(水)=55∶45,流速1.0mL·min-1,检测波长254nm,柱温25℃。在此条件下,喜树碱的保留时间适中,峰形良好,出峰时间7.5min左右。
3.2.3喜树碱标准曲线的绘制
用电子天平精确称取喜树碱标准品5.2mg于100mL容量瓶,以100%乙醇为溶剂,超声溶解并定容至刻度,作为对照品溶液。精确吸取对照品溶液0.1mL、0.5mL、1.0mL、2.0mL、5.0mL、8.0mL置于10mL的容量瓶中,用100%的乙醇溶液分别稀释定容至刻度,摇匀。按照上述色谱条件,分别进样分析,每个样品重复测定3次,分别取峰面积的平均值。标准品HPLC色谱图见图1。以峰面积为纵坐标,喜树碱溶液浓度为横坐标绘制标准曲线图(见图2),进行线性回归,得峰面积(Y)与喜树碱浓度(X)一元线性回归方程:y=6.0×10-5X-2.321,R2=0.998,线性范围:3.00~44.83mg·L-1。
根据方程可得喜树碱提取率的计算公式如下:
提取率‰=(浓度×体积×10-6/样品质量)×103

图1 喜树碱标准品HPLC色谱图
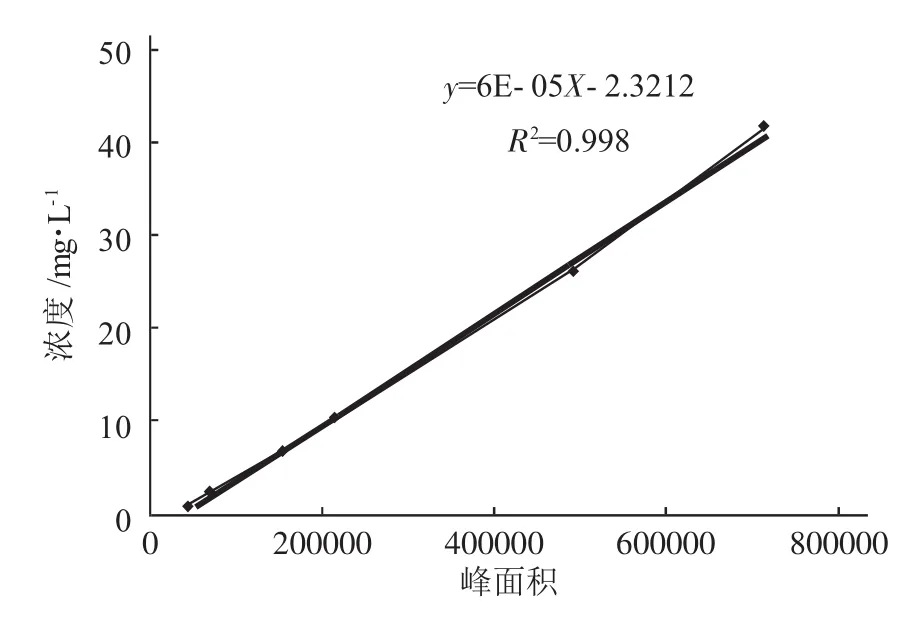
图2 喜树碱浓度-峰面积标准曲线
3.2.4精密度测定
按照3.2.1和3.2.2所确定的色谱条件,取同一浓度的喜树碱标准溶液连续进样,每次进样5μL。精密度测定当峰面积分别为:729347.9和782139.250时,标准偏差分别为:8425.4和7604.1,相对标准偏差为:1.16%和1.01%,可见标准偏差为7604.1,相对标准偏差约为1.01%时,标准偏差和相对标准偏差均很小,表明试验结果精密度良好。
3.2.5仪器稳定性试验
按照3.2.1和3.2.2所确定的色谱条件,取同一浓度的喜树碱标准溶液,分别于2 h,4 h,6 h,8 h,10 h,12 h测定其峰面积,每次进样5μL,重复操作三次。
求得标准偏差为152129.90,相对标准偏差为4.76%,见表1,标准偏差和相对标准偏差均较小,表明仪器的稳定性较好,试验数据精确,结果可靠。
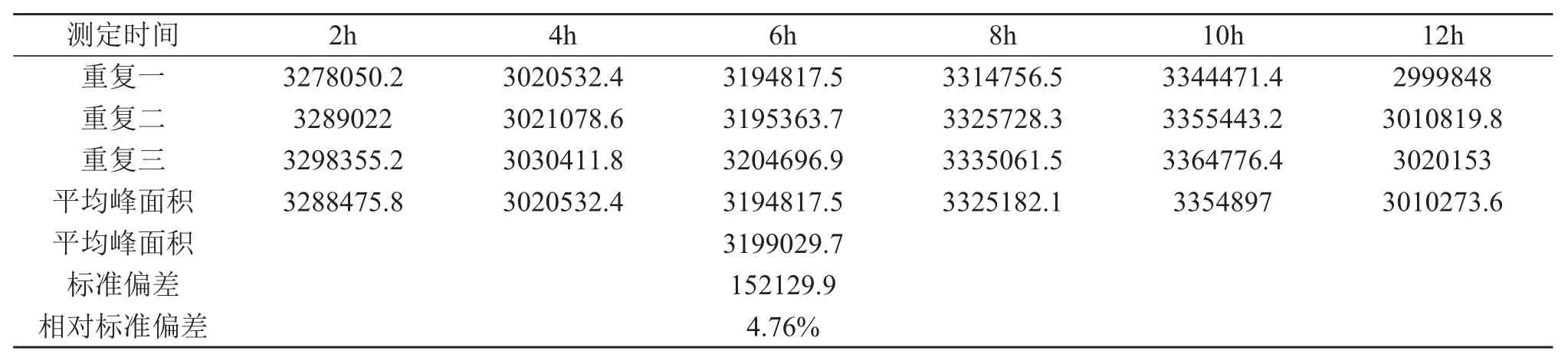
表1 仪器稳定性测定结果
3.2.6重现性试验
用电子天平精确称取同一样品5份,每份1.000 g采用乙醇超声法提取:乙醇含量60%,超声提取时间4min。按3.2.1和3.2.2所确定的色谱条件进行喜树碱含量的测定,每个样品重复测量3次。
测得标准偏差为86842.3,相对标准偏差为2.95%(见表2),表明本试验的重现性较好。

表2 重现性试验结果
3.2.7回收率的测定
精确称取同一样品5份,采用乙醇超声法提取,乙醇含量60%,超声提取时间4min。向提取液中分别加入52mg/L的喜树碱标准品溶液10mL,按3.2.1和3.2.2所确定的色谱条件测定喜树碱含量,计算回收率。
回收率(%)=[(加标样后喜树碱含量-样品中喜树碱含量)/加入标样量]×100%
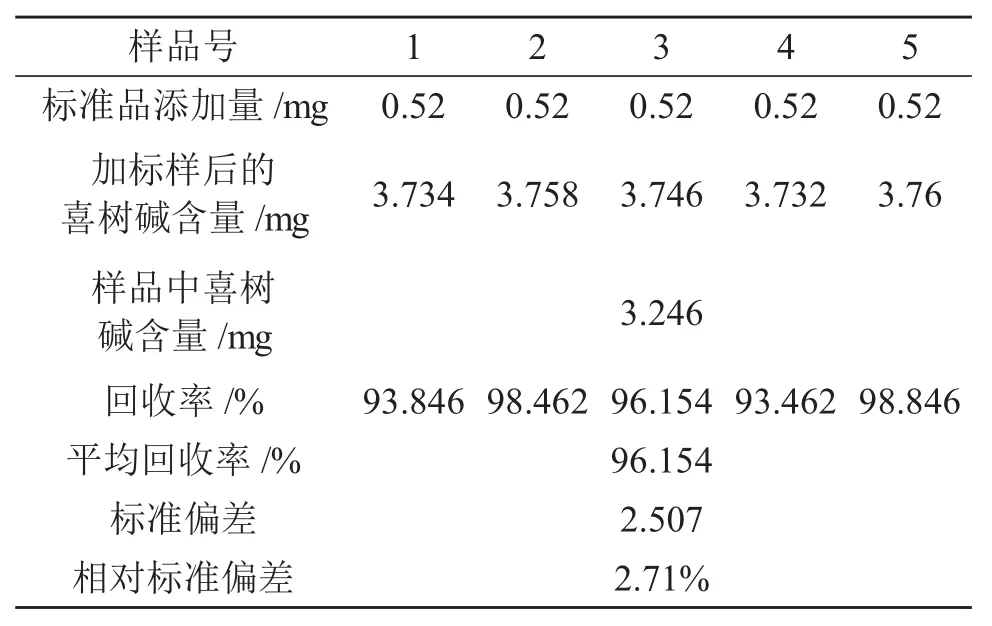
表3 回收率试验结果
可见,平均回收率较高,为96.154,且标准偏差和相对标准偏差均较小,表明以该方法提取喜树碱结果准确可靠。
[1]高洁.喜树碱提取工艺和喜树提取物对小菜蛾生物活性测定[D].四川农业大学,2005(2).
[2]周艳明,赵晓松.《现代农业仪器分析》[M].中国农业出版社,2003(12).
[3]冯天炯,孙远碧.薄层层析紫外分光光度法测定蜂王浆制剂中10-HDA的含量及其结果分析[J].中国药房,1993(2).
[4]林彩,刘松青,王章阳,贺俊英.白斑颗粒的薄层色谱鉴别[J].中国药业,2004(2).
[5]Enhancement of the Antitumor Effect of y-Ray Irradiation in Combination with Camptothecin against Human Colorectal Adenocarcinoma Dian-Sheng Wang;Yoshio Ueno;Hiyoshimaru Oyamada;Shuji Koji Biological & pharmaceutical bulletin,1996(19):3.
[6]Targeted disruption of the mouse topoisomerase I gene by camptothecin selection Scott G.Morham;Kimberly D.Kluckman;Nectarios Voulomanos;Oliver Smithies Molecular and Cellular Biology,1996(16):12.
[7]Differential cytotoxicity of clinically important camptothecin derivatives in P-glycoprotein-overexpressing cell lines.Hoki Y;Fujimori A;Pommier Y Cancer Chemotherapy and Pharmacology,1997(40):5.
[8]张丽艳,杨玉琴.反相高效液相色谱法测定喜树果实中喜树碱的含量[J].中国中药杂志,1997(4).
[9]阎秀峰,王洋,于涛,张玉红,殷丽君.喜树叶中喜树碱含量的高效液相色谱分析[J].分析测试学报,2002(3).
[10]姚培潢.HPLC测定喜树碱的含量[J].中国药学杂志,1994(3).
[11]涂文升,刘宗河.抗癌药物喜树碱的高效液相色谱测定[J].广西医科大学学报,1995(2).
[12]王长虹,刘军,郑立明,林伊梅,邹小广,陈鸣,孙殿甲.高效液相色谱法和薄层层析法鉴别骆驼蓬与骆驼蒿[J].新疆医科大学学报,2003(1).
10.3969/j.issn.1008-1267.2011.02.019
TQ450.7
A
1008-1267(2011)02-0046-04
2010-11-04

