黄蜀葵胶中的糖分析
王雪梅,施文婷,吴迷迷,汪莹莹
(安徽大学化学化工学院,安徽省绿色高分子重点实验室,安徽 合肥 230039)
黄蜀葵胶中的糖分析
王雪梅,施文婷,吴迷迷,汪莹莹
(安徽大学化学化工学院,安徽省绿色高分子重点实验室,安徽 合肥 230039)
目的:分析不同来源的黄蜀葵胶中的糖含量、多糖相对分子质量及其单糖组成。方法:采用3,5-二硝基水杨酸比色法测定4种黄蜀葵胶中还原糖、总糖和总多糖的含量,并解析其红外吸收光谱图;凝胶渗透色谱法测定纯化后的4种多糖的相对分子质量,气相色谱法分析其单糖组成。结果:4种黄蜀葵胶的还原糖质量分数分别为51.07%、9.00%、53.94%和11.46%,总糖质量分数分别为79.95%、78.99%、91.98%和61.13%,总多糖质量分数分别为28.88%、69.99%、38.04%和49.67%;红外谱图显示AMG-1、AMG-3中主要含α-D-吡喃葡萄糖,AMG-2和AMG-4中主要含有甘露糖;4种黄蜀葵胶中多糖的峰值相对分子质量分别为3.91×103、5.36×105、3.87×103和5.12×105;4种样品均含有甘露糖、葡萄糖和半乳糖,其物质量之比分别为0.42:1.00:0.27、1.00:0.15:0.54、0.27:1.00:0.15和1.00:0.12:0.48。结论:不同来源的黄蜀葵胶在还原糖、总糖和总多糖的含量,多糖相对分子质量及其单糖组成上均存在较大差异。
黄蜀葵胶;糖;含量;相对分子质量;组成
黄蜀葵胶(Abelmoschus manihotgum,简称AMG)是一种新型食品胶,系以锦葵科植物黄蜀葵根、茎经过整理、清洗、干燥、切碎、磨粉、过筛、精制而得,其外观为淡棕黄色或带绿色粉末,主要成分为黄蜀葵多糖,是一种较为丰富的可再生天然高分子资源,具有可降解性、生物相容性及安全性等特点,在食品工业中用作增稠剂和稳定剂。目前有关黄蜀葵胶的研究仅限高素莲等[1]对其多糖的分析,他们采用热水浸提、乙醇沉淀、鞣酸除蛋白,过氧化氢和活性炭脱色,微晶纤维素柱色谱分离,从黄蜀葵的根和茎中制备出多糖,并采用苯酚-硫酸比色法测定了多糖含量,薄层色谱法鉴定该多糖中含有半乳糖、阿拉伯糖和鼠李糖3种单糖组分,红外吸收光谱法分析鉴定黄蜀葵多糖的糖苷键为α-吡喃糖苷键,并测定了其比旋光度。但对黄蜀葵胶及其多糖的深入研究尚未见文献报道。
通常食品胶品质的优劣主要取决于其中糖的含量尤其是水溶性多糖的含量、多糖的相对分子质量以及多糖中单糖的组成。本实验将对几种不同来源的黄蜀葵胶的糖含量、多糖的相对分子质量及其单糖组成进行分析,并解析其红外谱图,以期从本质上了解黄蜀葵胶的物性。
1 材料与方法
1.1 材料、试剂与仪器
黄蜀葵胶样品:AMG-1 山东潍坊进出口食品有限公司;AMG-2 河南郑州世纪安华食品配料有限公司;AMG-3、AMG-4 河南郑州海特食品有限公司。
无水亚硫酸钠、盐酸、氢氧化钠、酒石酸钾钠、苯酚、氯仿、正丁醇、盐酸羟胺、吡啶、乙酸酐、溴化钾、氯化钠(均为分析纯);3,5-二硝基水杨酸(DNS)、三氟乙酸(均为化学纯);标准葡聚糖(Dextran T)T-500、T-200、T-70、T-40 和 T-10(Mr分别为500000、200000、70000、40000和10000) Pharmacia公司;单糖标准品阿拉伯糖(D-Ara)、甘露糖(D-Man)、葡萄糖(DGlc)、半乳糖(D-Gal)(均为生化试剂) 上海源聚生物科技有限公司;蒸馏水、超纯水,实验室自制。
TU-1901紫外-可见分光光度计 北京普析通用仪器有限公司;Nicolet 380傅里叶变换红外光谱仪 美国热电公司;RI-230型凝胶渗透色谱仪 大连依利特分析仪器有限公司;CP-3800气相色谱仪 美国瓦里安公司。
1.2 还原糖和总糖含量测定
1.2.1 DNS试液的配制[2]
称取6.3g DNS和21g氢氧化钠,加到500mL含有182g酒石酸钾钠的热水溶液中,再加5g苯酚和5g无水亚硫酸钠,搅拌溶解,冷却后加蒸馏水定容至1000mL,贮于棕色瓶中,7d后使用。
1.2.2 标准曲线的绘制
精密称取干燥至质量恒定的葡萄糖标准品0.1g,溶解后定容于100mL容量瓶中。分别移取0、0.1、0.2、0.4、0.6、0.8、1.0mL于25mL比色管中,补加蒸馏水至1mL;再加入3mL DNS试剂,混匀,置沸水浴中煮沸10min,流水迅速冷却,定容摇匀。以试剂空白为参比,在450~580nm波长范围内扫描,选择最大吸收波长处测定吸光度。
1.2.3 还原糖含量的测定
精确称取干燥后的AMG系列样品各0.1g,加水溶解后分别定容于100mL容量瓶中。准确吸取上述溶液各1.0mL,分别置于25mL比色管中,再各加3mL DNS试剂,按1.2.2节方法测定。
1.2.4 总糖含量的测定
取1.2.3节中配制的试液各30mL,分别置于250mL三角瓶中,加入稀盐酸(V浓盐酸:V水=1:2)10mL,置沸水浴中30min,取出冷却后,加20g/100mL氢氧化钠溶液调pH值至中性,移入100mL容量瓶中,定容。精密量取上述溶液各1.0mL,分别置于25mL比色管中,再各加3mL DNS试剂,按1.2.2节方法测定。
1.3 红外吸收光谱测定
分别取干燥的AMG试样约1mg,与约100mg的溴化钾在玛瑙研钵中研磨至混合均匀,在油压机上压制成透明的薄片,然后进行红外光谱测试,扫描范围为4000~400cm-1。
1.4 黄蜀葵胶的纯化
配制质量浓度为1g/100mL的AMG系列溶液,向该溶液中加入1/4体积的Sevag试剂(V氯仿:V正丁醇=4:1),剧烈振荡20~30min后静置30min,然后离心除去沉淀,再重复上述操作,至离心管中无变性蛋白,且紫外检测在260~280nm波长处无蛋白吸收峰[3-4]。将纯化后的样品真空干燥,制得AMG系列纯多糖样品。
1.5 相对分子质量测定
采用标准葡聚糖Dextran T系列在下述色谱条件下制作标准曲线,然后测定4种纯多糖在相同色谱条件下的色谱图及保留时间,从标准曲线上求出该多糖的相对分子质量[5-6]。
色谱条件:色谱柱:TSK-GEL G4000PWxl 7.8mm(i.d.)×300mm凝胶色谱柱;柱温45℃;流动相0.1mol/L NaCl溶液,流速0.9mL/min;柱压2.0MPa;溶液质量浓度为5mg/mL,进样量20μL。
1.6 单糖组成分析
1.6.1 色谱条件
CP-Sil24CB毛细管色谱柱,内径0.32mm,柱长30m,液膜厚度0.25μm,涂层材料50%苯基甲基聚硅氧烷。进样口温度270℃;载气为高纯氮气,流速28mL/min,氢气流速30mL/min,空气流速300mL/min;进样量2μL,分流比为1/25;氢火焰离子化检测器,检测器温度300℃。柱温采用程序升温,先在140℃保持1min,然后以10℃/min的速度升至250℃,保持3min。
1.6.2 单糖衍生物的制备[7]
准确称取标准单糖各10mg于25mL水解管中,分别加入10mg盐酸羟胺,1.0mL吡啶,在90℃水浴振荡反应30min,冷却至室温后,分别加入1.0mL乙酸酐,90℃水浴继续反应60min,生成的糖腈乙酸酯衍生物,直接注入GC分析。
1.6.3 多糖的水解和衍生[8-10]
称取纯化后的AMG系列多糖样品各10.0mg于具塞试管中,各加入2mol/L三氟乙酸4mL,充氮气封管后于120℃水解4~6h。取出于65℃水浴中用氮气吹干。将上述水解后的多糖,按照1.6.2节衍生条件,依次加入一定量的内标及各种试剂进行衍生化反应,反应产物直接进行GC分析。
2 结果与分析
2.1 黄蜀葵胶中还原糖、总糖和总多糖的含量
在碱性条件下加热,还原糖被氧化成糖酸等产物,DNS则被还原为棕红色的3-氨基-5-硝基水杨酸,在一定范围内,还原糖的量与该物质颜色深浅呈正比。单糖都是还原糖,多糖可用酸水解使其降解成有还原性的单糖进行测定,再分别求出样品中还原糖和总糖含量(还原糖以葡萄糖含量计),以总糖含量减去还原糖含量,即为总多糖的含量[11]。本实验中各标准样及待测样在紫外-可见吸收光谱图上的最大吸收峰均出现在490nm处,因此取490nm处的吸光度A和相对应的葡萄糖质量浓度c作标准曲线,得到回归线性方程:A=0.02896c-0.0144,相关系数r=0.9990。结果表明葡萄糖在4~40mg/L范围内与吸光度呈良好的线性关系。4种黄蜀葵胶中还原糖、总糖及总多糖的质量分数见表1。
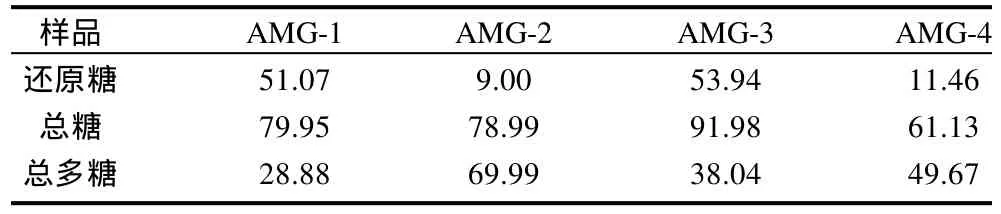
表1 黄蜀葵胶样品中糖的质量分数Table 1 Mass fractions of saccharides in AMG samples %
2.2 红外吸收光谱图分析
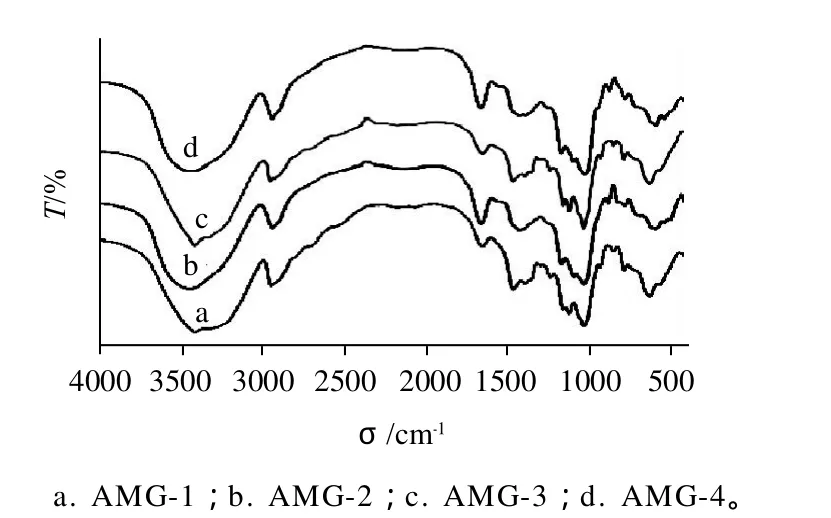
图1 黄蜀葵胶的红外谱图Fig.1 Infrared spectra of AMG samples
图1 为4种黄蜀葵胶的红外吸收光谱图,由图可知,3430、2927cm-1和1639cm-1分别为多糖的O—H、C—H伸缩振动吸收峰和O—H弯曲振动吸收峰;1145cm-1和1020cm-1的特征峰为C—O、C—O—C的伸缩振动和C—O—H的弯曲振动吸收。AMG-1和AMG-3在833cm-1有弱的吸收峰,表明含α-糖苷键,930cm-1和770cm-1两弱的吸收峰标示葡萄糖的绝对构型,为α-D-吡喃葡萄糖;AMG-2、AMG-4在807cm-1和867cm-1附近有两弱吸收峰,则表明含甘露糖苷键[12-14]。
2.3 黄蜀葵多糖的相对分子质量
在相应的色谱条件下,测得各色谱峰保留时间,以不同相对分子质量的标准葡聚糖的保留时间(tR)为横坐标,相对分子质量的常用对数值(lgMr)为纵坐标作图(图2)即可得到GPC校正曲线[15-16]。线性方程为lgMr= 8.261 -0.411tR,R2=0.9902。图3为纯化后黄蜀葵胶样品的GPC图,4种样品的保留时间分别为11.36、6.16、11.37min和6.21min;根据GPC校正曲线及各多糖样品的保留时间,计算出其相对分子质量的对数值,经转换即得出4种纯多糖样品AMG-1、AMG-2、AMG-3和AMG-4的峰值相对分子质量分别为3.91×103、5.36×105、3.87×103和5.12×105。
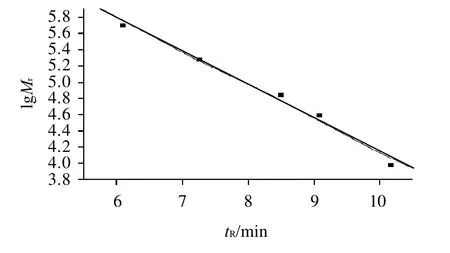
图2 葡聚糖的GPC校正曲线Fig.2 GPC calibration curve of dextran
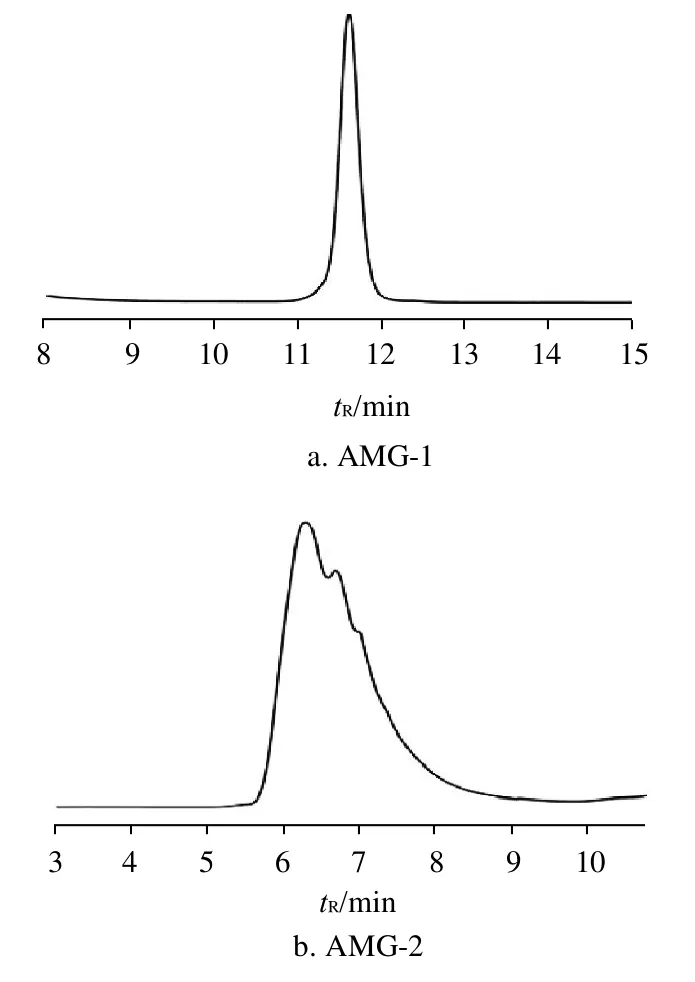

图3 纯化后AMG样品的凝胶渗透色谱图Fig.3 Gel permeation chromatograms of purified AMG samples
2.4 单糖组成的气相色谱分析
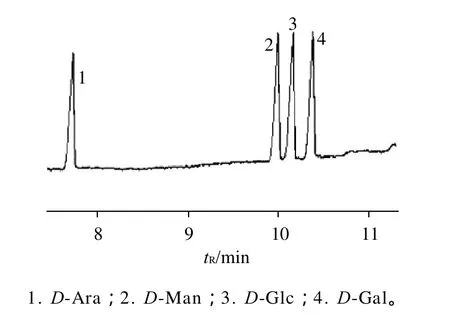
图4 标准单糖糖腈乙酸酯衍生物的气相色谱图Fig.4 Gas chromatograms of glycosyl-nitrile-acetate derivatives for standard monosaccharides
图4 为混合标准单糖糖腈乙酸酯衍生物的气相色谱图。由图可见,4种单糖均得以良好分离,保留时间分别为D-Ara 7.68min、D-Man 9.95min、D-Glc 10.13min和D-Gal 10.32min。各多糖样品水解后其单糖糖腈乙酸酯衍生化后的气相色谱图见图5。在相同色谱条件下,保留时间可作为定性分析的依据,通过与图4中标准单糖的保留时间相比较,可确定4种AMG多糖样品均含有甘露糖、葡萄糖和半乳糖,不含阿拉伯糖。以阿拉伯糖为内标物质,多糖中各单糖的物质量之比均通过相对校正因子求得[17],4种多糖中各单糖的物质量之比见表2。
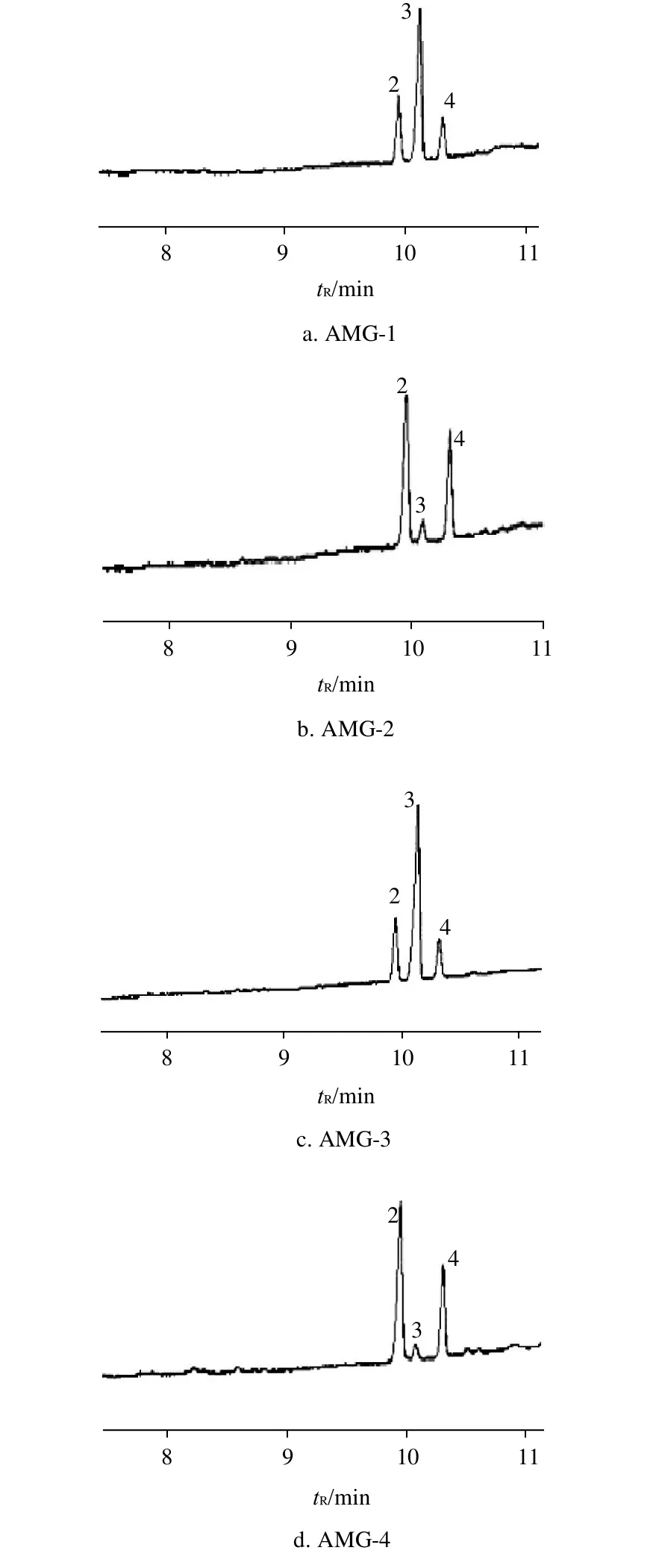
图5 纯化后AMG样品糖腈乙酸酯衍生物的气相色谱图Fig.5 Gas chromatograms of purified AMG glycosyl-nitrile-acetate derivatives

表2 纯化后AMG样品中各单糖的物质的量之比Table 2 Monosaccharide composition of purified AMG samples
3 结 论
3,5-二硝基水杨酸比色法可以同时测定还原糖和总糖含量,且在弱碱性条件下进行,反应条件温和,对环境的污染相对较小,实用性较强。
经实验探索,在水解温度为120℃时,AMG-1和AMG-2的最佳水解时间为6h,AMG-3和AMG-4的最佳水解时间为4h。
采用中等极性的CP-Sil24CB毛细管色谱柱,在11min内完成了4种单糖的分析,各单糖均能完全分离,分析过程中不产生异构峰,重复性较好,精密度和回收率均较高,可为黄蜀葵胶中单糖组成的测定提供一种较为准确可靠的分析方法。
由分析结果可知,几种黄蜀葵胶样品均由甘露糖、葡萄糖和半乳糖3种单糖组成,其还原糖、总糖和总多糖含量均不相同,多糖的相对分子质量也不相同,各单糖的物质量之比相差较大。与文献[1]报道不同,4种AMG样品均未检出阿拉伯糖和鼠李糖,可见不同来源的黄蜀葵多糖在单糖组成上均存在较大差异。
[1] 高素莲, 张秀真, 陈均. 黄蜀葵多糖的分析[J]. 分析测试学报, 2002,21(6): 72-74.
[2] 蔡荟梅, 蒋俊树, 刘斌. 3,5-二硝基水杨酸比色法测定木糖含量的研究[J]. 食品科技, 2008(5): 219-221.
[3] 蔡孟深, 李中军. 糖化学: 基础、反应、合成、分离及结构[M].北京: 化学工业出版, 2006: 363-369.
[4] GE Yu, DUAN Yufeng, FANG Guozhen, et al. Polysaccharides from fruit calyx ofPhysalis alkekengivar.francheti: Isolation, purification, structural features and antioxidant activities[J]. Carbohydrate Polymers, 2009,77(2): 188-193.
[5] 王玉峰, 王旻, 尹鸿萍. 金针菇菌丝体中多糖的分离、结构鉴定及免疫学活性[J]. 中国天然药物, 2008, 6(4): 312-315.
[6] 张泽生, 张建平, 史珅, 等. 高效凝胶渗透色谱法检测菊糖相对分子质量[J]. 食品科学, 2009, 30(12): 219-221.
[7] 张惟杰. 糖复合物生化研究技术[M]. 2版. 杭州: 浙江大学出版社,1999: 38-40.
[8] 邓永智, 李文权, 袁东星. 海水小球藻中多糖的提取及其单糖组成的气相色谱-质谱分析[J]. 分析化学, 2006, 34(12): 1697-1701.
[9] 李小定, 容建华, 吴谋成. 灰树花多糖粗品及各级分中单糖组成的气相色谱法测定[J]. 食品科学, 2003, 24(4): 110-113.
[10] LI Fei, YUAN Qipeng, RASHID F. Isolation, purification and immunobiological activity of a new water-soluble bee pollen polysaccharide fromCrataegus pinnatifidaBge[J]. Carbohydrate Polymers,2009, 78(1): 80-88.
[11] 章丽华, 张利平, 胡锦群, 等. 3,5-二硝基水杨酸比色法测定红毛五加中多糖的含量[J]. 中国中医医药信息杂志, 2008, 15(5): 49-51.
[12] CHEN Yi, XIE Mingyong, NIE Shaoping, et al. Purification, composition analysis and antioxidant activity of a polysaccharide from the fruiting bodies ofGanoderma atrum[J]. Food Chemistry, 2008, 107(1):231-241.
[13] SUN Yongxu, LIU Jicheng. Purification, structure and immunobiological activity of a water-soluble polysaccharide from the fruiting body ofPleurotus ostreatus[J]. Bioresource Technology, 2009, 100(2): 983-986.
[14] 张凯, 戴玲, 郑子瑞. 仙鹤草多糖的分离纯化及理化性质研究[J]. 中国生化药物杂志, 2008, 29(3): 171-174.
[15] 徐燕, 朱科学, 钱海峰, 等. 桃胶多糖的提取分离及组成性质研究[J].食品工业科技, 2008, 29(1): 66-71.
[16] ZHANG Mei, ZHANG Lina, CHEUNG P C, et al. Fractionation and characterization of a polysaccharide from the sclerotia ofPleurotus tuberregiumby preparative size-exclusion chromatography[J]. J of Biochemical and Biophysical Methods, 2003, 56(1/2/3): 281-289.
[17] 武汉大学. 分析化学: 下册[M]. 5版. 北京: 高等教育出版社, 2007:507-509.
Saccharide Analysis of Abelmoschus manihot Gum
WANG Xue-mei,SHI Wen-ting,WU Mi-mi,WANG Ying-ying
(Key Laboratory of Environment-Friendly Polymer Materials of Anhui Provice, College of Chemistry and Chemical Engineering,Anhui University, Hefei 230039, China)
Objective: To analyze the contents of saccharides, the molecular weights of polysaccharides and monosaccharide composition ofAbelmoschus manihotgum (AMG) from four different sources. Methods: The contents of reducing sugars, total saccharides and polysaccharides in four kinds of AMG samples were determined by 3,5-dinitros-alicylic acid (DNS) colorimetric method. Infrared spectra (IR) of AMG samples were also analyzed. The molecular weights of polysaccharides in purified AMG samples were characterized by gel permeation chromatography (GPC), and the monosaccharide composition of AMG samples were analyzed by gas chromatography (GC). Results: The contents of reducing sugars were 51.07%, 9.00%, 53.94%and 11.46%, respectively; the contents of total saccharides were 79.95%, 78.99%, 91.98% and 61.13%, respectively; and the contents of polysaccharides were 28.88%, 69.99%, 38.04% and 49.67%, respectivly, in four kinds of AMG samples. Infrared spectra indicated that AMG-1 and AMG-3 were mainly composed ofα-D-glucopyranose, while AMG-2 and AMG-4 were mainly composed of mannose. The peak molecular weights of AMG polysaccharides were 3.91 × 103, 5.36 × 105, 3.87 × 103and 5.12 × 105, respectivly. All four kinds of AMG samples contained mannose, glucose and galactose; and their molar ratios were 0.42:1.00:0.27, 1.00:0.15:0.54, 0.27:1.00:0.15 and 1.00:0.12:0.48, respectivly. Conclusion: The contents of reducing sugars, total saccharides and polysaccharides, the molecular weights of polysaccharides and monosaccharide composition apparently differ among AMG gums from different sources.
Abelmoschus manihotgum;saccharide;content;molecular weight;composition
O657
A
1002-6630(2011)06-0256-05
2010-05-05
王雪梅(1964—),女,副教授,硕士,研究方向为天然产物分析与应用。E-mail:wangxm929@yahoo.com.cn

