转Bt基因作物恒温扩增快速检测技术
汪 琳 赵胤泽 罗 英 周 琦 赖平安 张向东 柏亚铎
(北京出入境检验检疫局 北京 100026)
转Bt基因作物恒温扩增快速检测技术
汪 琳 赵胤泽 罗 英 周 琦 赖平安 张向东 柏亚铎
(北京出入境检验检疫局 北京 100026)
[目的]建立一种快速检测转Bt基因作物的方法。[方法]利用Bt的Cry1ab/ac基因序列设计特异性引物,建立LAMP检测方法以及优化反应体系,并进行LAMP的特异性和灵敏度试验。[结果]成功建立转Bt基因作物的LAMP检测方法,得到最优的反应体系。在特异性试验中,转Bt基因作物基因组DNA均呈阳性,而非转基因作物、转Bar基因作物、转CPTI基因作物、转EPSPS基因作物等均为阴性;在灵敏度试验中,转Bt基因作物的最低检测限为10个拷贝。[结论]LAMP方法具有很高的特异性和灵敏度,可用于转Bt基因作物的现场快速检测。
转Bt基因作物;环介导恒温扩增技术
1 前言
随着转基因产品大量进入市场,其生物安全性以及可能对人类健康和生态环境的影响引起了全世界越来越多的关注。因此,建立有效的转基因检测方法,快速鉴定转基因食品、植物、种子等,对于检验检疫、食品安全监管、农业执法部门和科研监测等具有重要的意义。转基因成分的检测有很多种方法,目前常用的有化学组织检测法、酶联免疫吸附法、外源基因整合鉴定法、Western杂交法、试纸条、生物测定检测法、基因芯片法、竞争性PCR、实时定量PCR和PCR-EL ISA等[1-3]。环介导等温扩增(LAMP)是Notomi等在2000年开发的一种核酸恒温扩增方法[4-5],这种方法不需要模板的热变性[6],扩增效率高,几十分钟扩增产物可达109-1010个拷贝;有无肉眼可见的焦磷酸镁白色沉淀可简单判断核酸是否扩增[7-8]。增加环引物的LAMP法,可使反应速度提高1/2-1/3[9]。目前LAMP法已广泛应用于包括DNA病毒、RNA病毒[10]、细菌[11]和寄生虫[12]等传染性疾病的定性和定量检测,但在转Bt基因作物检测中还没有报道。在本研究中,我们根据Cry1ab/ac基因设计LAMP引物,并用核酸试纸条对扩增产物进行检测,建立能对转Bt基因植物、种子作出有效、准确、快速鉴定的检测方法。
2 材料与方法
2.1 材料
2.1.1 样品
转基因大米BT63、转基因玉米品系Bt11、Mon810、NK603均由吉林出入境检验检疫局提供;转基因玉米品系M IR604、Bt11-sp0401由本局保存、提供。
2.1.2 主要试剂
甜菜碱(Betain):购自Sigma公司;dNTP:购自Promega公司;Bst大片段DNA聚合酶:购自New England Biolabs公司;基因组小量抽提试剂盒:购自上海生工生物工程有限公司;Milenia GenLine Hybri Detect试剂盒:为德国进口原装核酸试纸条。
2.1.3 主要仪器
高速冷冻离心机:5417R,Eppendorf,德国;恒温金属浴:TB02-1,HOR IBAO,日本;微量移液器:0.1-1000μL,Eppendorf,德国。
2.2 方法
2.2.1 样品DNA提取
用基因组小量抽提试剂盒提取转基因作物基因组DNA,按照制造商的说明所提取的DNA,溶于
50μL的TE中,储存在-20℃备用。
2.2.2 引物设计及合成
针对Genbank中Bt的Cry1ab/ac基因(Accession number EU816953),采用LAMP专用引物设计软件,结合Primer Premier5.0软件进行引物设计。设计的6条引物是:2条外引物(F3和B3),2条内引物(FIP和BIP),2条环引物(LF和LB,分别标记生物素和荧光素)。扩增Cry1ab/ac基因的位置从283至583区域301 bp目的基因片段,引物的名称和具体序列见表1。FIP由F1的一个互补序列和正向序列F2构成,BIP由B1的一个互补序列和正向序列B2构成,每条引物在基因组中的具体位置如图1所示。

表1 扩增Cry1ab/ac基因的LAMP引物序列

图1 用来设计LAMP引物的Cry1ab/ac基因的核酸序列
引物由上海英骏生物技术有限公司合成,纯度为HPLC级别。引物用灭菌双蒸水溶解,配制成20μmol/L母液。
2.2.3 LAMP反应体系的建立
根据已有文献,初步确定反应体系为20μL,其中包括FIP、BIP各1.6μmol/L,F3、B3各0.2μmol/L,LF、LB各0.8μmol/L,dNTPs为1mmol/L,Betaine为0.5mol/L,10×Thermo Pol Reaction buffer为2μL,MgSO4为0.6μL,8U的Bst DNA聚合酶大片段,模板DNA为2μL,用灭菌双蒸水补足至20μL(下称基础LAMP反应体系)。60℃孵育30min。然后以102拷贝/μL的Bt重组质粒为模板,依次对体系中的MgSO4浓度、引物浓度比、dNTPs浓度、Betaine浓度及反应温度进行优化。
2.2.4 LAMP反应中MgSO4浓度的优化
在2.2.3的基础LAMP反应体系中(无Mg-SO4),分别加入终浓度为1.0、2.0、3.0、4.0、5.0mmol/L的MgSO4,混匀后放置60℃孵育30min。
2.2.5 LAMP反应中引物浓度比的优化
2.2.5.1 内引物与外引物浓度比的优化
在2.2.3的基础LAMP反应体系中(无FIP、BIP),按照2:1、4:1、6:1、8:1、10:1的比例,依次加入对应浓度的FIP、BIP,混匀后放置60℃孵育30min。
2.2.5.2 环引物与外引物浓度比的优化
在2.2.3的基础LAMP反应体系中(无LF、LB),按照1:1、2:1、4:1、6:1、8:1的比例,依次加入对应浓度的LF、LB,混匀后放置60℃孵育30min。
2.2.6 LAMP反应中dNTPs浓度的优化
在2.2.3的基础LAMP反应体系中(无dNTPs),分别加入终浓度为0.5、0.75、1.0、1.25、1.5mmol/L的dNTPs,混匀后放置60℃孵育30min。
2.2.7 LAMP反应中Betaine浓度的优化
在2.2.3的基础LAMP反应体系中(无Betaine),分别加入终浓度为0、0.25、0.5、0.75、1.0mol/L的Betaine,混匀后放置60℃孵育30min。
2.2.8 LAMP反应温度的优化
将2.2.3的基础LAMP反应体系分别在60℃、62℃、64℃3个温度下孵育30min。
2.2.9 LAMP反应结果观察
反应结束后,取5-10μL LAMP扩增产物,用Milenia GenLine HybriDetect试剂盒检测。取100μL检测缓冲液于微孔板中,再用微量移液器吸取5-10μL LAMP扩增产物,加在试剂盒提供的试纸条上,5-15min内目测结果,观察试纸条是否出现紫色线条。
2.2.10 LAMP的特异性试验
抽提非转基因作物、转CPTI基因作物、转EPSPS基因作物、转Bar基因作物的基因组DNA,用最佳反应体系分别扩增,试纸条观察结果。
2.2.11 LAMP的敏感性试验
将含Bt目的基因片段的重组质粒DNA作10n倍比稀释,取100、101、102、103拷贝/mL 4个稀释度,用最佳反应体系进行扩增,试纸条观察其结果。
2.2.12 LAMP检测稳定性和可靠性试验
采用荧光定量PCR检测结果为阳性的转Bt基因玉米品系Mon810为试验样品对其外源基因Cry1ab/ac进行连续10次重复扩增,确定LAMP检测的稳定性。试验过程中设立阴性和空白对照。对不同类型的转Bt基因作物如大豆、玉米、棉花的基因组进行LAMP反应,确定LAMP检测的可靠性。
3 结果与分析
3.1 LAMP反应中MgSO4浓度的优化结果
使反应体系中MgSO4的终浓度依次为1.0-5.0mmol/L,在这几个浓度梯度下分别进行LAMP反应,产物用试纸条进行检测,结果如图2所示。
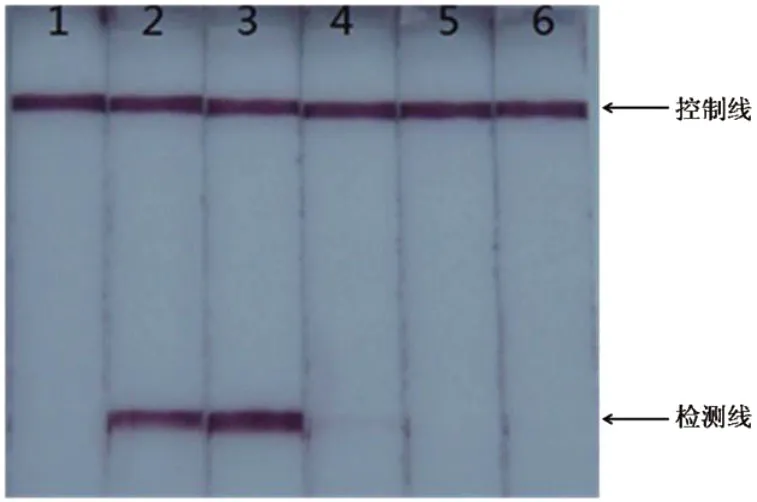
图2 LAMP反应中MgSO4浓度的优化
图2显示,当反应体系中MgSO4的终浓度为1.0mmol/L和5.0mmol/L的时候,试纸条上没有出现紫色的检测线;当反应体系中MgSO4的终浓度为2.0mmol/L和3.0mmol/L的时候,试纸条上出现明显的紫色检测线;当反应体系中MgSO4的终浓度达到4.0mmol/L的时候,检测线强度明显减弱。比较检测线的强度,最终确定20μL的反应体系中MgSO4的终浓度为3.0mmol/L。
3.2 LAMP反应中引物浓度比的优化结果
3.2.1 内引物与外引物浓度比的优化结果
使反应体系中内引物与外引物浓度比依次为2:1-10:1,在这几个浓度比下分别进行LAMP反应,产物用试纸条进行检测,结果如图3所示。

图3 LAMP反应中内引物与外引物浓度比的优化
图3显示,当反应体系中的内引物与外引物浓度比为2:1时,试纸条上未出现紫色的检测线;当反应体系中的内引物与外引物浓度比为4:1时,试纸条上出现淡淡的检测线;当反应体系中的内引物与外引物浓度比为6:1时,试纸条上出现明显的紫色检测线;当反应体系中的内引物与外引物浓度比达到8:1、10:1时,检测线强度明显减弱。因此最终确定20μL的反应体系中内引物与外引物的浓度比为6:1。
3.2.2 环引物与外引物浓度比的优化结果
使反应体系中环引物与外引物浓度比依次为1:1-8:1,在这几个浓度比下分别进行LAMP反应,产物用试纸条进行检测,结果如图4所示。
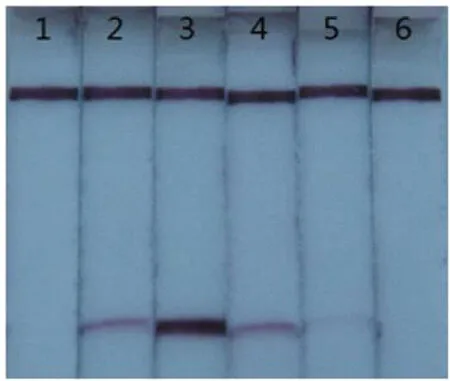
图4 LAMP反应中环引物与外引物浓度比的优化
图4显示,当反应体系中的环引物与外引物浓度比为1:1时,试纸条上未出现紫色的检测线;当反应体系中的环引物与外引物浓度比为2:1时,试纸条上出现淡淡的检测线;当反应体系中的环引物与外引物浓度比为4:1时,试纸条上出现明显的紫色检测线;当反应体系中的环引物与外引物浓度比达到6:1、8:1时,检测线强度明显减弱。因此最终确定20μL的反应体系中环引物与外引物的浓度比为4:1。
3.3 LAMP反应中dNTPs浓度的优化结果
使反应体系中dNTPs的终浓度依次为0.5-1.5mmol/L,在这几个浓度梯度下分别进行LAMP反应,产物用试纸条进行检测,结果如图5所示。
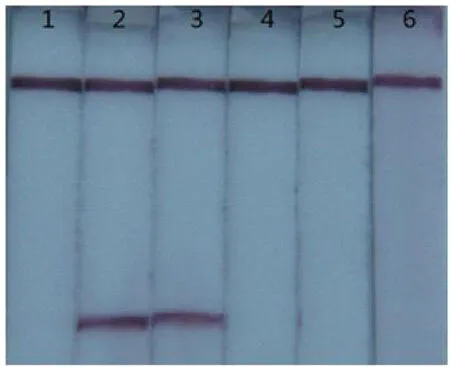
图5 LAMP反应中dNTPs浓度的优化
图5显示,当反应体系中的dNTPs终浓度为0.5mmol/L时,试纸条上未出现紫色的检测线;当反应体系中的dNTPs终浓度为0.75mmol/L时,试纸条上出现明显的紫色检测线;当反应体系中的dNTPs终浓度达到1.0mmol/L,甚至更高的时侯,试纸条上的检测线强度明显减弱,直至消失。所以最终确定20μL的反应体系中的dNTPs终浓度为0.75mmol/L。
3.4 LAMP反应中Betaine浓度的优化结果
使反应体系中Betaine的终浓度依次为0-1.0mol/L,在这几个浓度梯度下分别进行LAMP反应,产物用试纸条进行检测,结果如图6所示。
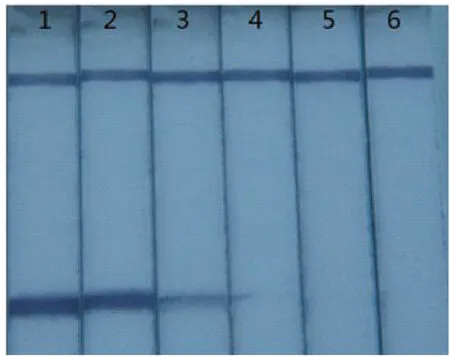
图6 LAMP反应中Betaine浓度的优化
图6显示,当反应体系中的Betaine终浓度为0时,试纸条上出现明显的紫色检测线;当反应体系中的Betaine终浓度逐渐增加时,试纸条上检测线出现明显减弱趋势,直至完全消失。所以最终确定20μL的反应体系中的Betaine终浓度为0。
3.5 LAMP反应温度的优化结果
分别采取60、62、64℃3个不同的温度进行LAMP反应,扩增产物用试纸条进行检测,结果见图7所示。

图7 LAMP反应温度的优化
图7显示,在60、62、64℃3个不同温度下进行LAMP反应,其中在62℃下进行LAMP扩增,试纸条上的检测线强度最强,60、64℃反应时的检测线强度较弱。所以本研究选择62℃作为LAMP的最适反应温度。
3.6 LAMP的特异性试验结果
将提取的不同类型的转Bt基因作物及非转Bt基因作物的基因组DNA进行LAMP反应,扩增产物用试纸条进行检测,结果试纸条上均未见明显的检测线。
3.7 LAMP的敏感性试验结果
将预先稀释好的不同浓度的Bt重组质粒进行LAMP反应,试纸条检测结果显示LAMP检测的最低检测限为10个拷贝,见图8。

图8 LAMP扩增灵敏度试纸条结果
3.8 LAMP的稳定性试验结果
对转Bt基因玉米品系Mon810进行10次重复LAMP反应,试纸条检测结果均呈现阳性信号,且试纸条检测线强度一致,表明LAMP检测具有很好的稳定性。
4 讨论
与传统的PCR检测相比,LAMP检测在恒温条件下进行,操作简便,快速省时,特异性较强,不需要使用昂贵、精密的仪器设备,而且可以用试纸条直接对检测结果进行判断,检测成本低,适宜在一些基层机构开展检测工作。然而LAMP法对反应条件有严格的要求,如果条件不当,本该出现的结果则不能显现。
本试验针对转Bt基因作物外源基因Cry1ab/ac的序列设计了一套LAMP反应引物,通过对LAMP法中的一些扩增条件进行优化,使扩增达到最佳效果。结果证实该方法的可靠性、特异性及稳定性良好,灵敏度可达到10拷贝/mL。
5 结语
LAMP技术为快速检测转Bt基因作物提供了新的发展方向,有望成为简易的常规检测手段,尤其适用于基层检验检疫机构。使用LAMP技术快速检测转Bt基因作物能为商检、海关、食品安全监管及农业执法部门等提供有益的借鉴。
[1] HardeggerM,Brodmann P,HemnannA.Quantitative detection of the 35S promoter and the NOS terminator using quantitative competitive PCR[J].Eur Food Res Technol,1999,209(2):83-87.
[2] Marra Hermandez,Teresa Esteve,Salome Prat,et al.Development of real-time PCR systems based on SYBR Green I,Amplifluor and TaqMan technologies for specific quantitative detection of the transgenic maize event GA21[J].Journal of Cereal Science,2004,39(1):99-107.
[3] Liua GB,Sua C W,Xua Q W,et al.Liquid-phase hybridization based PCR-EL ISA for detection of genetically modified organisms in food[J].Food Control,2004,15(4):303-306.
[4] Notomi T,Okayama H,MasubuchiH,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Research,2000,28(12):e63i-e63vii.
[5] Eiken Chemical Co.Ltd.The principles of LAMP method.http://loopamp.eiken.co.ip/e/tech/index.html.2003.
[6] Nagamine K,Watanabe K,Ohtsuka K,et al.Loop-mediated isothermal amplification reaction using a nondenatured template[J].Clinical Chemistry,2001,47(9):1742-1743.
[7] Yasuyoshi Mori,Tsuyoshi Hirano,Tsugunori Notomi.Sequence specific visual detection of LAMP reactions by addition of cationic polymers[J].BMC Biotechnology,2006,6:31.
[8] Mori Y,Nagamine K,Tomita,et al.Detection of loop-mediated isothermal amplification reaction by turbidity derived from magnesium pyrophosphate formation[J].Biochemical and Biophysical Research Communications,2001,289(1):150-154.
[9] Nagamine K,T Hase,T Notomi.Accelerated reaction by loopmediated isothermal amplification using loop primers[J].Molecular and Cellular Probes,2002,16(3):223-229.
[10] Munraym G,Thompsonwf.Rapid isolation of high molecular weight plant DNA[J].Nucleic Acid Res,1980,8:4321-4325.
[11] Shivappa R B,Savan R,Kono T,et al.Detection of spring viraemia of carp virus(SVCV)by loop-mediated isothermal amplification(LAMP)in koicarp,Cyprinus carpio L.[J].J Fish Dis,2008,31(4):249-258.
[12] Pandeyb D,Poudel A,Yoda T,et al.Development of an in 2 house loop-mediated isothermal amplification(LAMP)assay for detection of Mycobacterium tuberculosis and evaluation in sputum samples of Nepalese patients[J].J Med Microbiol,2008,57:439-443.
Rapid Detection of Transgenic Bt Crops by Isothermal Nucleic Amplification
Wang Lin,Zhao Yinze,Luo Ying,Zhou Qi,Lai Ping’an,Zhang Xiangdong,Bai Yaduo
(Beijing Entry-Exit Inspection and Quarantine Bureau,Beijing,100026)
s:[Objectives]To establish a specific,sensitive and rapid method for detecting transgenic Bt crops.[Methods]Cry1ab/ac gene was used for the design of primers,the reaction conditions were optimized and then LAMP method was established.Specificity and sensitivity evaluations also included in the experiment.[Results]LAMP method was established successfully,it was proved to be a high specific method which could detect all transgenic Bt crops,while results of detection of non-transgenic crops,transgenic Bar crops,transgenic CPTI crops,transgenic EPSPS crops,etc.were all negative.The detection limit of LAMP was 10copies/tube for transgenic Bt crops.[Conclusions]The established LAMP was a specific and sensitive method for detecting transgenic Bt crops and it can be used for Rapid detection of transgenic Bt crops.
Transgenic Bt Crops;Loop-Mediated Isothermal Amplification;LAMP
Q789
国家“十一五”转基因重大专项课题(2008ZX08012-005)

