家兔支气管败血波氏杆菌重组蛋白DNT1的原核表达及其间接ELISA方法的建立
赵 宁,恽时锋,王 芳,范志宇,胡 波,刘 涛
(1.江苏省农业科学院兽医研究所,农业部动物疫病免疫与诊断重点开放实验室,国家兽用生物制品工程技术研究中心,江苏 南京 210014;2.南京军区南京总医院比较医学科,江苏 南京 210002)
家兔支气管败血波氏杆菌重组蛋白DNT1的原核表达及其间接ELISA方法的建立
赵 宁1,恽时锋2,王 芳1,范志宇1,胡 波1,刘 涛1
(1.江苏省农业科学院兽医研究所,农业部动物疫病免疫与诊断重点开放实验室,国家兽用生物制品工程技术研究中心,江苏 南京 210014;2.南京军区南京总医院比较医学科,江苏 南京 210002)
目的 表达支气管败血波氏杆菌(Bordetella bronchiseptica,Bb)DNT蛋白,并以此建立检测Bb抗体的间接ELISA方法。方法 参照GenBank公布的猪源支气管败血波氏杆菌dnt基因序列(AB020025)针对其N-端设计了一对特异性引物,PCR扩增出相应的核苷酸片段。将PCR扩增产物连接至原核表达载体 pET-28a(+)载体中,以E.coli BL21(DE3)为表达菌株进行诱导表达,以纯化重组蛋白DNT1作为诊断抗原,通过探索最佳抗原包被量和抗体血清稀释倍数,建立检测支气管败血波氏杆菌重组蛋白DNT1抗体的ELISA方法。结果 成功克隆了dnt N-端的基因序列,并在E.coli BL21(DE3)中获得高效表达,经 SDS-PAGE、Western blot分析显示重组蛋白 DNT1具有良好的抗原性。应用重组蛋白DNT1为抗原建立了检测Bb血清抗体的间接ELISA诊断方法。试验确定重组蛋白DNT1抗原的包被浓度为6.25 μg/mL,最适血清稀释度为1∶100。结论 建立的ELISA检测方法,不仅为 Bb抗体检测提供了一种比较实用的血清学检测手段,也为进一步开发Bb检测试剂盒奠定了基础。
兔;支气管败血波氏杆菌;坏死毒素(DNT);原核表达;间接ELISA
支气管败血波氏杆菌(Bordetella bronchiseptica,Bb)是广泛感染家畜、野生动物和实验动物上呼吸道的一种革兰氏阴性球杆菌,常引起家兔发生传染性鼻炎和支气管肺炎,Bb的感染常导致多杀性巴氏杆菌、葡萄球菌等其它细菌的继发性感染[1,2],从而增加实验兔呼吸道疾病的发病率和严重程度,同时也为细菌学检查增加了难度。近年来,人们发现Bb可经动物传染给人,并在免疫功能缺陷或低下的人群(如AIDS患者)体内形成严重感染[3-5],因此本病具有一定的公共卫生意义。
Bb诊断主要是细菌学检查、血清学凝集试验、PCR等检测方法[6]。常规细菌学检查操作繁琐、费时费力;血清凝集试验和PCR方法常出现假阳性结果[7],因此,建立一种快速、高效、敏感、特异的检测方法对本病的防控尤为重要。研究表明,皮肤坏死毒素(dermonecrotic toxin,DNT)是Bb重要的毒力因子[8],由dnt基因编码,由 A-B两个亚单位构成,A亚单位(C端)为毒素的活性中心,B亚单位(N端)称结合单位,能使毒素分子特异性地结合在宿主易感组织的细胞膜受体上,并协助A亚单位穿过细胞膜[9-11]。本研究将 N端结合单位命名为 DNT1,并以临床病例中分离的高毒力Bb菌株(BJL0504)的基因组为模板,对其进行了克隆、序列分析及原核表达,并将表达蛋白作为抗原,建立了检测Bb抗体的间接ELISA方法,为更好地防治本病奠定基础。
1 材料和方法
1.1 菌种与血清
兔支气管败血波氏杆菌株(BJL0504,Ⅰ相菌),由范志宇等分离鉴定并保存[12];BL21(DE3)、原核表达载体pET-28a(+)由江苏省农业科学院兽医所保存;兔支气管败血波氏杆菌阴、阳性血清自行制备并保存;绵羊血采自江苏省农科院兽医所;待检血清100份采自江苏省境内4个兔场。
1.2 主要试剂
Sac I、HindⅢ、TaqDNA聚合酶和PCR回收纯化试剂盒、IPTG等购自大连宝生物工程有限公司;His Trap纯化柱购于GE Healthcare;EB、琼脂糖购于南京基天生物技术有限公司;牛血清白蛋白(BSA)、酶标羊抗兔IgG(HRP-IgG)购自生物晶美公司;TMBS购自Amersco公司。
1.3 引物设计与PCR扩增
参照GenBank公布的猪源支气管败血波氏杆菌dnt基因序列(AB020025)针对 N-端(DNT1)设计了一对特异性引物:
上游引物:5′-CATGAGCTCCGCCTGGATTAC-3′
下游引物:5′-TGGAAGCTTGGGCGTGGAAAA-3′
为了便于构建表达载体,在上、下游引物5′端分别加入Sac I和 HindⅢ酶切位点(引物中下划线部分)。PCR扩增条件为:以Bb I相菌基因组为模板,进行 PCR扩增,95℃预热 5 min;94℃变性 1 min,58℃退火 1 min,72℃延伸 1.5 min,35 个循环,72℃延伸10 min,冷却至4℃保存。取 PCR扩增产物10 μL,进行1%琼脂糖凝胶电泳,利用凝胶成像系统观察、拍摄、分析结果。用凝胶回收试剂盒回收PCR产物。
1.4 dnt1基因的克隆与鉴定
取PCR产物和原核表达载体 pET-28a(+)适量,用Sac I、HindⅢ 酶消化,连接,转化,得到重组质粒pET-28a-dnt1。将初选的阳性质粒分别进行 Sac I、HindⅢ 双酶切、PCR及测序鉴定。
1.5 重组蛋白的诱导表达与纯化
重组表达载体 pET-28a-dnt1转入 E.coli BL21(DE3)中。将含有阳性重组质粒 pET-28a-dnt1和pET-28a(+)空载体的 E.coli BL21(DE3)单个菌落,分别接种于3 mL LB(Kan+)液体培养基,37℃200 r/min摇振培养 2 h左右,使 A600达到 0.4~0.6。加入终浓度为1 mmol/L的 IPTG,37℃诱导表达6 h。取适量诱导表达后的细菌沉淀物经超声波裂解,加入含8 mol/L尿素的Binding buffer进行充分溶解,然后按His Trap纯化柱说明书进行纯化。
1.6 重组蛋白的SDS-PAGE及Western blot分析
按照文献[13]介绍的方法进行重组蛋白的SDS-PAGE及Western blot分析,一抗为兔抗 Bb高免血清,二抗为 HRP标记的羊抗兔 IgG,按照 DAB显色液试剂盒显色。
1.7 间接ELISA检测方法的建立
1.7.1 重组蛋白和待检血清最佳工作浓度的确定:将纯化后的重组蛋白DNT1用抗原包被液分别作100 、50 、25 、12.5、6.25、3.125 μg/mL 共 8 个梯度稀释,100 μL/孔,37℃孵育 2 h,4℃ 过夜。次日弃去包被液,PBST洗涤5次拍干。用2%BSA封闭,200 μL/孔,37℃封闭1.5 h。用血清稀释液将阴、阳性血清分别作 1:100、1:200、1:400 倍比稀释,做ELISA 方阵试验,100 μL/孔,37℃ 孵育 30 min,确定抗原和血清的最适工作浓度。HRP-羊抗兔 IgG做1:20 000 稀释,100 μL/孔,37℃ 孵育 60 min。新鲜配制的 TMBS-H2O2底物显色液,37℃避光显色10 min。每孔 50 μL 2 mol/L H2SO4中止反应,测定A450值。比较阳性血清和阴性血清A450比值(P/N),以确定合适的抗原包被浓度以及待测血清的最佳稀释度。
1.7.2 判定标准的确定:取鉴定为Bb抗体阴性的50份兔血清,按照已确立的间接ELISA方法进行检测。经统计学分析,得到A450平均值X和标准差 S。根据统计学原理,A450值≥X +3S时,判为阳性。A450值≤X+2S者判为阴性,介于二者之间者判为可疑。
1.7.3 阻断试验:取5份波氏杆菌阳性血清作最佳稀释,与等量重组蛋白抗原DNT1(50 μg/mL)混合,37℃作用2 h,10 000 r/min离心10 min,取上清液,与未经抗原处理的阴、阳性血清一起,同时作ELISA检测。计算(N-P)/N值,若此值大于0.5,则判为阻断阳性。
(N-P)/N=(未阻断孔A值-阻断孔A值)/未阻断孔A值
1.7.4 重复性试验:取6份阳性血清、3份阴性血清在不同时间相同条件下,重复检测3次,观察A450值的变化。
1.7.5 临床应用:分别对江苏省境内4个兔场的家兔采集血清,每个兔场随机采集25份,用建立的间接ELISA方法对这100份血清进行检测,初步评价应用效果及兔场Bb感染情况。
2 结果
2.1 dnt1基因的扩增
以支气管败血波氏杆菌Ⅰ相菌(BJL0504)为模板进行PCR扩增,产物经1%琼脂糖凝胶电泳分析,在1 600 bp左右处有特异条带,与预期大小相符(图 1)。

图1 dnt1基因的PCR结果Note:M: DNA marker(DL2000)1:PCR products of dnt1 geneFig.1 PCR products of dnt1 gene
2.2 重组表达质粒pET-28a-dnt1的鉴定
使用引物对重组表达质粒进行PCR扩增,在预期大小处得到了特异性条带;进一步对其进行双酶切鉴定,经琼脂糖凝胶电泳,得到与预期片段大小一致的特异条带(图2);测序结果显示,克隆的兔Bb dnt1基因序列与GenBank公布的4个猪源 dnt基因序列:U59687、AB020025、E17214、NP890512 相比,核苷酸同源性高达99%以上,说明成功构建了目的片段的重组表达质粒pET-28a-dnt1。
2.3 SDS-PAGE及Western blot结果
表达的重组蛋白经His Trap纯化柱纯化后,用12%的聚丙烯酰胺凝胶进行SDS-PAGE检测,结果表明pET-28a-dnt1在诱导后出现一条大小约为60 KDa的特异性蛋白条带,与预期大小基本一致,命名为DNT1(图3-4泳道),紫外分光光度计检测纯度为3 mg/mL。

图2 重组质粒pET-28a-dnt1的酶切鉴定Fig.2 Identification of recombinant plasmid pET-28adnt1 by enzyme digestion

图3 表达产物的SDS-PAGE结果和Western blot分析Fig.3 SDS-PAGE(B)and Western blot(A)analyses
Western blot显示,DNT1融合蛋白在约60KDa处出现很强的特异性反应条带(图3-2泳道),质粒pET28a(+)诱导表达后在预期位置处无反应条带(图3-1泳道),表明重组蛋白在大肠杆菌中得到了正确表达,并具有良好的反应原性。
2.4 间接ELISA检测方法的建立
2.4.1 重组蛋白和待检血清最佳工作浓度的确定:通过方阵滴定试验,不同梯度阴、阳性血清和抗原的反应结果见表1。确定重组蛋白DNT1抗原和血清的最佳工作条件为:抗原最佳包被浓度为6.25μg/ml,血清最佳稀释倍数为 1∶100。
2.4.2 结果判定:50份健康兔血清用建立的ELISA方法进行检测。结果表明,重组蛋白 DNT1包被板的平均 A450值(x)为0.066,标准差(SD)为0.052,临界值x+3S=0.222。据此,确定血清样品A450≥0.222,且 P/N≥2.1,方可判为阳性;A450≤0.170为阴性;介于二者之间判为可疑。
2.4.3 阻断实验:重组蛋白DNT1抗原处理血清的阻断抑制率为88.0%。证明重组蛋白DNT1对血清抗体与包被抗原的结合有很强的抑制作用,包被抗原与血清抗体的结合是特异的。
2.4.4 重复性试验:取同一批次重组蛋白包被酶标板,在不同时间相同条件下检测9份血清,重复检测3次。以结果判定为标准,所得检测结果完全相同。2.4.5临床应用:用建立的间接ELISA方法对采自江苏境内4个兔场的100份血清进行检测,总阳性率为56.7%,说明本地兔场Bb的感染率较高,应引起高度关注。
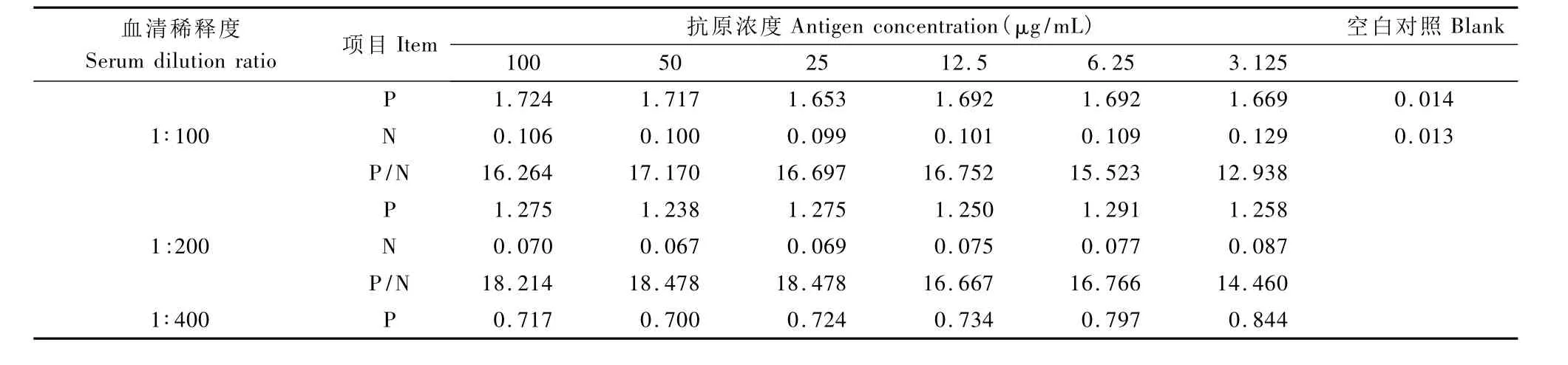
表1 重组蛋白DNT1和血清的不同稀释度反应结果Tab.1 Reaction results of the recombinant protein of DNT1 and different serum dilutions
3 讨论
DNT是 Bb的主要毒力因子,早在1979年,有人将I相菌经超声波处理后得到的无菌抽提物成功地人工复制猪萎缩性鼻炎,当接种于仔猪鼻腔后,可产生和自然感染时萎缩性鼻炎相似的鼻部损伤。此外,毒素也可能通过损坏呼吸道内正常保护层上皮细胞而间接地促进菌株附着作用[14-15]。DNT可以通过去酰氨基和多聚Rho蛋白来促进Bb纤毛运动,还可以促使宿主中DNT受体细胞膜的增殖以及内化的形成,从而加快粘附宿主细胞。天然DNT的分泌量非常有限,且纯化工艺复杂,人工表达全毒素的效率也较低,通过提纯天然和体外表达来制备DNT较困难。因此,本试验将结合位点命名为DNT1进行了克隆与表达,并将其作为ELISA包被抗原以检测动物体内特异的DNT抗体,从而诊断兔群是否发生了波氏杆菌病。
以自行分离的兔源Bb的基因组为模板进行克隆,克隆出的dnt基因通过核苷酸和氨基酸序列比对,发现与GenBank公布4个猪源DNT基因序列相比,均有99%以上的同源性。这表明该基因高度保守,可考虑作为波氏杆菌病的检测抗原和亚单位疫苗研究的候选基因。Western blot分析表明,重组蛋白DNT1呈现良好的特异性抗原反应。此外,该基因在大肠杆菌中获得大量表达,为进一步开发为诊断试剂盒抗原奠定基础。用建立的ELISA方法对江苏4个兔场进行了监测,100份血清样品的总阳性率为56.7%,这说明江苏地区兔场波氏杆菌的感染率较高,应引起高度关注。
以纯化的重组蛋白DNT1为包被抗原建立的检测Bb抗体的间接ELISA方法具有良好的重复性、特异性和敏感性。其克服了细菌分离鉴定较为繁琐费时和PCR检测易出现假阳性的缺点;此外,包被抗原易于纯化,ELISA操作方法简单。因此,本研究建立的新方法,有望成为一种准确、快速和实用的兔Bb病血清学诊断方法。
[1] 段会勇.肉兔巴氏杆菌与波氏杆菌混合感染的诊断[J].畜牧兽医杂志,2005(2):44-46.
[2] 余树民,邓俊良.獭兔金黄色葡萄球菌和波氏杆菌混合感染的诊治[J].四川畜牧兽医,2002,(B05):9-10.
[3] Viejo G,de la Iglesia P,Otero L,et al.Bordetella bronchiseptica pleural infection in a patient with AIDS[J].Scand J Infecious Dis,2002,34(8):628-629.
[4] Valencia ME,EnriquezA, Camino N, etal. Bordetella bronchiseptica pneumonia in patients with HIV[J].Enferm Infecc Microbiol Clin,2004,22(8):502-503.
[5] De J Y, Gonzalez S, Sante M. Respiratory pathogens in bronchoalveolar lavage in a Puerto Rican population infected with the human immunodeficiency virus[J].P R Health Sci J,2005,24(3):197-202.
[6] De Jong MF.Progressive and nonprogressive atrophic rhinitis.(In):Straw BE,d'Allaire S,Mengeling WL(eds.),Diseases of swine[M].Ames,IA: Iowa State University Press,1999:355-384.
[7] Charles IG,Dougan G,Pickard D,et al.Molecular cloning and characterization of protective outer membrane protein P.69 from Bordetella pertussis[J].Proc Natl Acad Sci,1989,86:3554-3558.
[8] 陆承平.兽医微生物学[M].北京:中国农业出版社,2001:275-278.
[9] Matsuzawa T,Kashimoto T,Katahira J,et al.Identification of a receptor-binding domain of Bordetella dermonecrotic toxin[J].Infect Immun,2002,70(7):3427-3432.
[10] HoriguchiY,SendaT,SugimotoN,etal. Bordetella bronchiseptica dermonecrotizing toxin stimulates assembly of actin stress fibers and focal adhesions by modifying the small GTP-binding protein rho[J].J Cell Sci,1995,108(Pt 10):3243-3251.
[11] Kashimoto T,Matsuzawa T,Katahira J,et al.Identification of functional domains of Bordetella dermonecrotizing toxin[J].Infect Immun,1999,67:3727-3732.
[12] 范志宇,恽时锋,薛家宾,等.新西兰白兔支气管败血波氏杆菌的分离鉴定[J].中国比较医学杂志,2007,17:278-282.
[13] Sambrcok J,Russel DW.黄培堂,译.分子克隆实验指南(第3版)[M].北京:科学出版社,2002.
[14] Pullinger GD,Adams TE,Mullan PB,et al.Cloning expression and molecular characterization of the dermonecrotic toxin gene of Bordetella spp[J].Infect Immun,1996 Oct,64:4163-4171.
[15] Brockmeier SL,Register KB,Magyar T,et al.Role of the dermonecrotic toxin of Bordetella bronchiseptica in the pathogenesis of respiratory disease in swine[J].Infect Immun,2002,70:481-490.
Prokaryotic Expression of Bordetella Bronchiseptica DNT1 Recombinant Protein from Rabbits and Development of an Indirect ELISA for Detection of Its Antibodies
ZHAO Ning1,YUN Shi-feng2,WANG Fang1,FAN Zhi-yu1,HU Bo1,LIU Tao1
(1.Institute of Veterinary Medicine,Jiangsu Academy of Agricultural Sciences,Key Laboratory of Animal Disease Diagnostics and Immunology,Ministry of Agriculture,National Center for Engineering Research of Veterinary Bio-Products,Nanjing 210014,China;2.Department of Comparative Medicine,Nanjing General Hospital of Nanjing Command,Nanjing 210002)
Objective To get expression of Bordetella bronchiseptic recombinant protein DNT1 and establish an indirect ELISA for detection of recombinant protein DNT1.Method According to a pair of specific primers designed toamplify DNT gene of Bordetella bronchiseptica in swines promulgated by Genbank,the fragment of the target gene was amplified by PCR and then constructed with prokaryotic expression vector PET-28a(+).The recombinant expression plasmids were transfected into BL21(DE3)strain.The optimal concentration of coated antigen recombinant protein DNT1 and serum dilution was determined to develop the ELISA technique.Results DNT1 gene of Bordetella bronchiseptica was successfully cloned and expressed.The SDS-PAGE and Western blot analysis unfolded the excellent immunogenicity of the recombinant proteins which were used as coating antigens to develop the ELISA method for Bb-specific antibody diagnosis.The peridium consistency of the recombinant protein DNT1 determined in this experiment was 6.25 μg/mL,and the optimal testing serum dilution was 1:100.Conclusion The development of DNT1 indirect ELISA offers a simple and practical way for monitoring antibody of Bb,and provides much information for laying a basis for development of a Bb diagnosis kit.
Rabbits; Bordetella bronchiseptica; Dermonecrotic toxin(DNT); Prokaryotic expression;Indirect ELISA
R33
A
1671-7856(2011)04-0047-05
2010-11-10
10.3969/j.issn.1671-7856.2011.04.011
农业部公益性行业科研专项(nyhyzx07-040);现代农业产业技术体系建设专项资金资助项目(nycytx-44);江苏省科技支撑计划——农业部分(BE2008372)。
赵宁(1985-),女,硕士,主要从事畜禽传染病防治学研究,E-mail:zhaoningnjau@126.com。
恽时锋(1965-),男,教授,博士,从事医学实验动物学专业,E-mail:yunshifeng1@163.com;王芳(1972-),女,副研究员,博士,主要从事畜禽传染病免疫机理及诊断方法研究,E-mail:rwangfang@126.com。

