恩诺沙星时间分辨荧光免疫分析方法的建立
赵莉莉,黄 飚,王晓岚*,宓晓黎,金 坚,陆茂林
(1.江南大学医药学院,江苏 无锡 214122;2.江苏省微生物研究所有限责任公司,江苏 无锡 214063;3.江苏省原子医学研究所,江苏 无锡 214063)
恩诺沙星时间分辨荧光免疫分析方法的建立
赵莉莉1,2,黄 飚3,王晓岚1,*,宓晓黎2,金 坚1,陆茂林2
(1.江南大学医药学院,江苏 无锡 214122;2.江苏省微生物研究所有限责任公司,江苏 无锡 214063;3.江苏省原子医学研究所,江苏 无锡 214063)
目的:采用时间分辨荧光免疫分析(time-resolved fluoroimmunoassay,TRFIA)技术建立高灵敏的恩诺沙星(enrofloxacin,ENR)快速检测方法。方法:以包被抗原(ENR-OVA)包被微孔板,与游离的恩诺沙星共同竞争抗恩诺沙星抗体,以铕(Eu3+)标记的羊抗兔抗体进行示踪。结果:方法的批内变异系数小于10%、批间变异系数小于15%,平均回收率为91.62%,灵敏度为5ng/L,可测范围为0.01~100μg/L,ED20、ED50和ED80分别为0.088、3.40μg/L和32.81μg/L。结论:ENR-TRFIA方法稳定性好、可测范围宽,具有很好的应用前景。
恩诺沙星;时间分辨荧光免疫分析;兽药残留
人工合成的新型抗菌药物恩诺沙星(enrofloxacin,ENR)是第三代氟喹诺酮类药物(FQNs)之一,在兽医学中很快取得广泛应用[1-2]。但长期应用ENR所产生的不良反应、畜禽产品中的残留以及在环境中的生态效应等方面的问题已引起广泛关注[3-7]。许多国家和组织等都将其列入限制使用的兽药范围,并制订出相应的最高残留限量[8]。目前,美国已经禁止在食用动物养殖中使用FQNs;欧盟对ENR在畜禽肌肉和内脏中的残留限量作了严格规定,要求ENR和环丙沙星总量的最高残留限量(MRL)为30μg/kg,日本2006年修改的恩诺沙星残留限量标准中明确限定此类药物在水产品中的最高限量为100μg/kg;我国国家质量监督检验检疫总局规定恩诺沙星在动物肌肉、肝脏中的最大残留限量分别为100、200μg/kg。因此加强对该药在动物性食品中的残留检测和监督非常必要。
目前对于恩诺沙星的检测多采用高效液相色谱法(high performance liquid chromatography,HPLC)或液相色谱-质谱联用法(liquid chromatography-mass spectrometry,LC-MS)等[9-11]理化检测方法,但这些方法所需设备昂贵、操作繁琐且灵敏度有限。近年来关于免疫分析的方法也有报道,应用最广的为酶联免疫法[12-15],但由于酶联免疫法检测范围有限,且标记物酶易失活,底物见光易分解,受环境影响较大,一定程度上限制了它的应用。
本研究采用时间分辨荧光免疫分析法(time resolved fluoroisnmunoassay,TRFIA)建立恩诺沙星的高灵敏的检测方法,该法具有灵敏度高、操作简便、示踪物稳定和定量分析量程宽及无放射性污染等优点,应全面完善其应用基础研究,并建立相关的检测试剂盒,以满足国内食品安全检测市场的迫切需要。
1 材料与方法
1.1 材料与试剂
ENR人工抗原(ENR-OVA)和兔抗ENR多克隆抗体 自制;ENR标准品 中国药品生物制品检定所;Eu3+标记盒 美国Perkin-Elmer公司;亲和层析纯化的羊抗兔IgG、牛血清白蛋白(BSA) 美国Sigma公司;PD-10柱、Sepharose CL-6B柱 美国Pharmacia公司。
去离子超纯水、增强液、洗涤液 自配;其他试剂均为国产分析纯;ELISA试剂盒 北京望尔生物技术有限公司。
1.2 仪器与设备
AutoDELFIA-1235全自动TRFIA检测仪 美国EG&G-Wallac公司;3550-UV酶标仪 美国Bio-Rad公司。
1.3 方法
1.3.1 Eu3+-羊抗兔抗体的制备
取0.5mg羊抗兔抗体,经PD-10柱转换缓冲条件,洗脱液为含0.155mol/L NaCl的50mmol/L Na2CO3-NaHCO3pH8.5缓冲液。收集蛋白峰,浓缩后取0.3mg羊抗兔抗体,加入含0.1mg的Eu3+-N2-[p-异氰酸-苄基]-二乙烯三胺四乙酸(Eu3+-DTTA)冻干粉的小瓶中,30℃磁力搅拌反应20h。反应液经用80mmol/L Tris-HCl pH7.8缓冲液平衡的Sepharose CL-6B柱(1cm×40cm)层析,A280监测收集蛋白峰,稀释后分装冻干保存。
1.3.2 试剂配制
ENR标准品:从ENR母液中稀释ENR,质量浓度分别为0.00、0.01、0.50、5.00、20.00、100.00μg/L,稀释液和零质量浓度点均为蒸馏水。
分析缓冲液:8mmol/L NaCl、0.1% BSA、50μmol/L二乙烯三胺五乙酸(diethylenetriamine pentoacetic acid,DTPA)、100mmol/L吐温-80和0.1% NaN3的Tris-HCl(50mmol/L,pH7.8)。
1.3.3 固相抗原的制备[16]
将包被抗原ENR-OVA用50mmol/L Na2CO3-NaHCO3pH9.6缓冲液稀释至所需质量浓度的包被液,96孔微孔板各孔加100μL,4℃放置过夜。弃去包被液,冲洗3次,加200μL含3g/L BSA的上述缓冲液封闭,4℃放置过夜。弃去封闭液,真空抽干,板条密封后置-20℃冷冻保存。
1.3.4 样品处理
分别称取(4±0.04)g鳗鱼试样置于50mL离心管中,加乙腈-0.1mol/L氢氧化钠溶液12mL,振荡混合5min,4000r/min离心5min;移取上清液6mL于50mL离心管中,加0.02mol/L磷酸盐缓冲液6mL,再加二氯甲烷7mL,振荡5min,4000r/min离心5min,取下层有机相6mL于10mL试管中,于50℃水浴下氮气吹干;加0.02mol/L磷酸盐缓冲液0.5mL,涡动混匀2min,加正己烷1mL,涡动混匀30s,4000r/min离心5min;取下层清液50μL分析。稀释倍数为0.5倍。
1.3.5 检测步骤
从-20℃冰箱中取出ENR-OVA板条,加入50μL/孔ENR标准品或处理好的样品,然后加入分析缓冲液稀释的兔抗ENR抗体,50μL/孔,37℃恒温振荡孵育1h,洗涤3次后,加入分析缓冲液稀释的Eu3+-羊抗兔抗体100 μL/孔,37℃恒温振荡孵育0.5h,洗涤6次后,加增强液200μL/孔,振荡5min后,用时间分辨免疫检测仪测定,绘制标准曲线,根据标准曲线计算样品中ENR含量。
1.3.6 间接竞争ENR-TRFIA方法的考核
1.3.6.1 灵敏度
计算10组标准曲线零质量浓度点计数的平均值(x)和标准差(s),从标曲线中找到x-2s所得值,对应质量浓度即为检测灵敏度。
1.3.6.2 稳定性
比较计数为零质量浓度点计数的20%、50%和80%时的效应值(effective dose,ED)ED20、ED50和ED80对应的质量浓度/(μg/L),根据长期多次和加速试验测定判断剂量反应曲线的位置漂移来考核方法的稳定性。
1.3.6.3 回收率
在确定本底的鳗鱼中分别添加5个浓度水平的恩诺沙星标准品,进行间接竞争TRFIA检测。计算实测值与理论值的比值。
1.3.6.4 精密度
用标准品稀释液配制不同质量浓度的样品,观察批内和批间变异系数(CV)。
1.3.6.5 特异性实验
按照1.3.5节检测步骤进行ENR-TRFIA检测,绘制标准曲线。根据各质量浓度点和零质量浓度点的荧光计数值计算抑制率,并以抑制率和恩诺沙星质量浓度的常用对数值作图,半数抑制质量浓度IC50为抑制率达到50%时所对应的恩诺沙星质量浓度。以恩诺沙星类似的其他喹喏酮类药物标准品为竞争物,按照同样操作条件进行与恩诺沙星抗体的竞争实验,分别计算各药物的半数抑制质量浓度IC50,并根据下式计算交叉反应率:交叉反应率/%=[IC50(恩诺沙星)/类似药物的IC50]×100。重复测定3次,取平均值。
1.3.6.6 基质效应性(健全性)
考察样品介质对方法的干扰。正常的健全性实验所得出的曲线应该与标准曲线重合或者平行。若存在干扰物质,则实验数值不成比例增加。取含ENR的鳗鱼样品,按一系列比例稀释,将稀释后的样品用ENR-TRFIA测量,将测得结果绘制成曲线。
1.3.6.7 方法比较
取鳗鱼样品若干份,分别用ENR-TRFIA和商品化ENR-ELISA试剂盒同时检测样品,比较两种检测方法的相关性。
2 结果与分析
2.1 Eu3+-羊抗兔抗体的理化和免疫学鉴定
Eu3+标记物经Sepharose CL-6B层析,收集第一洗脱峰,如图1所示。以Eu3+标准产品为参考,Eu3+-羊抗兔抗体第一洗脱峰的Eu3+浓度为36.7μmol/L、蛋白质浓度为3.2μmol/L,即平均每个羊抗兔抗体分子上连接了11.5个Eu3+。
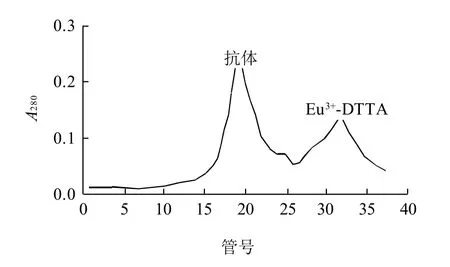
图1 A280检测Eu3+ IgG Sepharose CL-6B洗脱峰Fig.1 Elution profile of Eu3+ labeled IgG from a Sepharose CL-6B column
2.2 包被抗原和抗体工作质量浓度的选择
取不同质量浓度的ENR包被抗原板条,依次加入ENR标准品或样品,然后每孔依次加入抗ENR抗体(1:20000),进行ENR-TRFIA检测,绘制标准曲线,选择零质量浓度点计数高且曲线斜率大(灵敏度高)的包被抗原质量浓度,结果如图2所示。确定包被抗原的质量浓度为100μg/L。

图2 不同包被抗原质量浓度条件下的ENR-TRFIA标准曲线Fig.2 Effect of envelope antigen concentration on calibration curve of ENR-TRFIA
用不同质量浓度的抗ENR抗体建立检测方法,以各稀释度抗ENR抗体的荧光计数(B)与最高质量浓度抗ENR抗体的荧光计数(B0)的比值(B/B0,即结合率)为纵坐标、抗体稀释比例为横坐标绘制曲线,结果见图3。由于30%~50%抗体结合率对应的稀释度为最佳抗体反应稀释度,由图3得出此范围为96000~48000,因此合适的工作质量浓度应在此范围内,本实验选择1:60000倍稀释。

图3 ENR抗体稀释曲线Fig.3 Dilution curve of anti-ENR antibody by indirect competitive ENR-TRFIA
2.3 ENR-TRFIA标准曲线的绘制
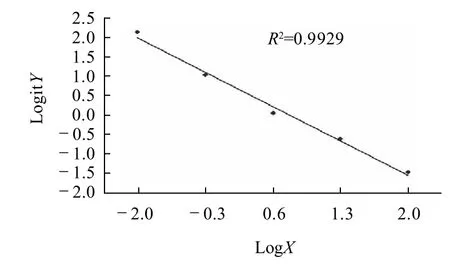
图4 间接竞争ENR-TRFIA标准曲线Fig.4 Calibration curve of indirect competitive ENR-TRFIA
间接竞争ENR-TRFIA的结果经Log-Logit函数数据处理所得的标准曲线见图4。LogitY=ln[Y/(1-Y)],Y=B/B0,式中B0为最大结合率的荧光计数值,即零质量浓度点的荧光计数值。以零质量浓度点发光值x-2s后的发光值在标准曲线上得到的相应值为检测的灵敏度,方法的灵敏度为5ng/L。由标准点所在的区间可得,该检测方法的检测范围为0.01~100μg/L。
2.3.1 方法的稳定性
6条不同时间进行的间接竞争ENR-TRFIA的效应点均值ED20、ED50和ED80分别为0.088、3.40μg/L和32.81μg/L(表1),3个效应点的批间变异系数(CV)均小于10%,说明剂量反应曲线的位置漂移小,方法的稳定性好。将检测用试剂置于37℃、7d(相当于4℃、6个月)后测定,各质量浓度点的结合率平均下降10.6%,如表2所示,因此说明试剂盒的货架期可以满足实际应用的需要。

表1 标准曲线的ED20、ED50和ED80值的稳定性比较Table 1 ED20, ED50 and ED80 of ENR-TRFIA
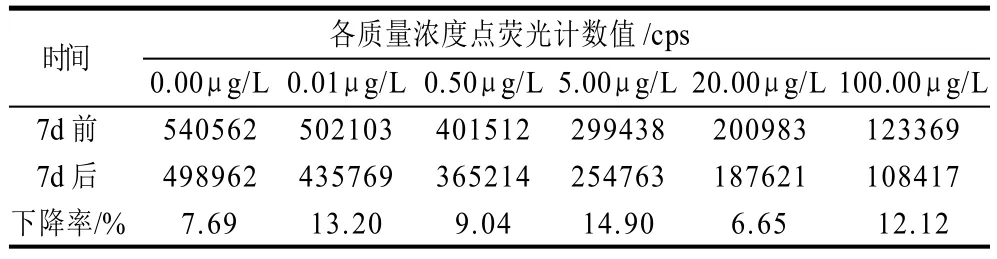
表2 方法的破坏性实验(37℃、7d)Table 2 Destructive test of ENR-TRFIA (37 ℃,7 d)
2.3.2 方法的回收率

表3 间接TRFIA测定样品中ENR的回收率Table 3 Recovery rate of ENR from eel samples determined by TRFIA
称取已处理的鳗肉样品(3.00±0.05)g,分别添加0.1、1.0、10.0、50.0、200.0μg/kg的恩诺沙星标准品,进行回收率的测定,高浓度点稀释到检测限范围内再测,结果如表3所示。各浓度点的回收率分别为73.5%、93.6%、95.8%、107.6%、87.6%,平均回收率为91.62%。
2.3.3 精密度
用标准品稀释液配制3份不同质量浓度的标准品,观察批内和批间变异系数,结果如表4所示。批内变异系数均小于10%,批间变异系数均小于15%,该结果符合免疫分析要求。

表4 ENR-TRFIA批内、批间变异率的考核Table 4 Intra- and inter-assays of ENR-TRFIA
2.3.4 方法的特异性
采用间接竞争ENR-TRFIA检测ENR抗体与其相关类似物的的交叉反应率,结果如表5所示。恩诺沙星抗体对其他药物的交叉反应率低,对恩诺沙星的特异性较好。

表5 间接TRFIA测定恩诺沙星抗体的特异性Table 5 Specificities of enrofloxacin antibody by TRFIA
2.3.5 方法的健全性
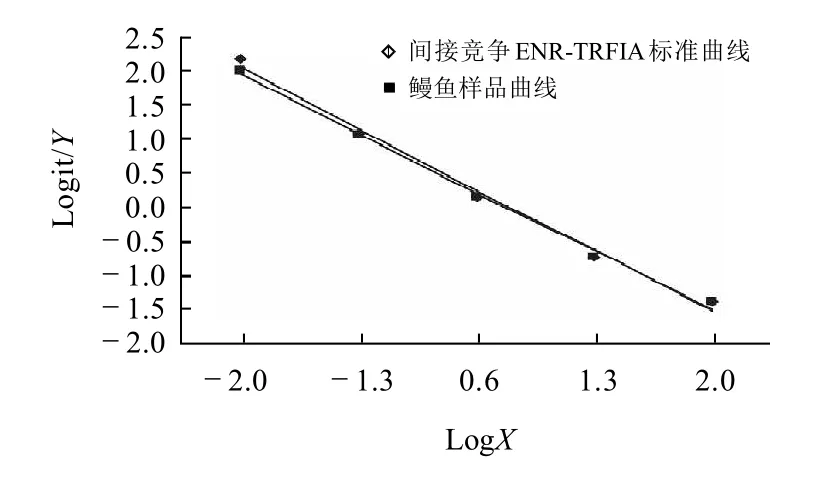
图5 鳗鱼样品稀释比例与测定值相关性Fig.5 Correlation between dilution rate and determination results in eel samples
取含定量ENR的鳗鱼样品,质量浓度为1000μg/L,按1:10、1:50、1:200、1:2000、1:100000比例稀释,将稀释后的样品用ENR-TRFIA测量,将测得结果绘制成曲线,与标准曲线比较。测定结果如图5所示。测定结果呈线性关系,表示此方法具有较好的健全性。
2.3.6 方法的相关性
用本实验室建立的ENR-TRFIA方法和国产商品化ENR-ELISA试剂盒同时检测15份鳗鱼样品,结果如表6所示。对两种方法的检测结果进行线性回归分析,相关系数为0.9772,表明两种方法的相关性很好(图6)。

表6 酶联免疫法和时间分辨免疫法的样品检测值Table 6 Comparative results of determining eel samples by ENR-ELISA and ENR-TRFIA
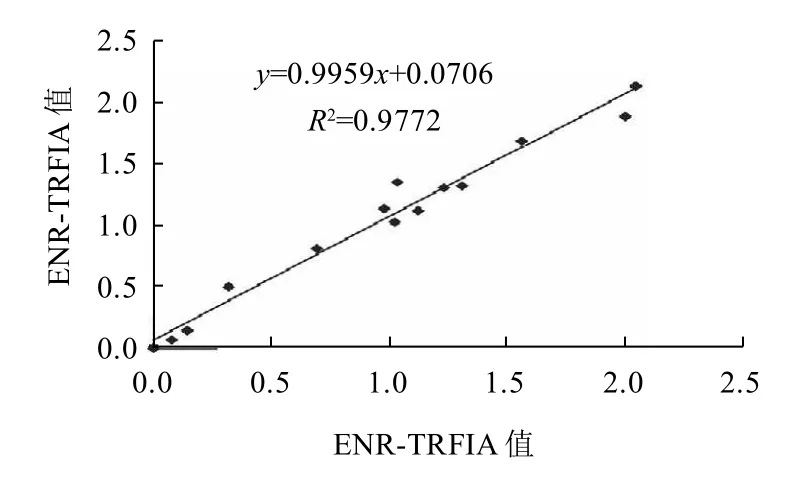
图6 ENR-TRFIA和ENR-ELISA相关性曲线图Fig.6 Correlation between ENR-TRFIA and ENR-ELISA in determining eel samples
3 结 论
TRFIA是超微量检测领域中一项新兴的检测技术[17],采用非放射性原子(三价稀土离子)标记技术,标记位点多,极大地提高了方法学的灵敏度;标记方法属原子标记,对生物活性影响小;激发光和发射光谱之间Stock位移大,可提高方法学的稳定性;相对长的荧光发射周期可有效避免环境因素的干扰。采用TRFIA方法建立的试剂盒具有有效期长、操作简便、灵敏度高、标准曲线量程宽、可全自动操作及应用范围广泛等优点[18-19]。
本研究采用稀土离子Eu3+标记技术建立EN RTRFIA,其检测的灵敏度较ELISA方法[12]有所增加,可达5ng/L,测量范围为0.01~100μg/L,向鳗鱼样品中分别添加0.1、1.0、10.0、50.0、200.0μg/kg五个水平的恩诺沙星标准品,平均回收率分别为7 3.5%、93.6%、95.8%、107.6%、87.6%。方法的批内变异系数小于10%,批间变异系数小于15%。特异性实验表明恩诺沙星抗体与其他喹诺酮类药物交叉反应均较低,抗体的特异性很好。从健全性实验可以看出,待测物质的免疫化学性质是基本相同的,通过标准品剂量反应曲线可以准确地测定待测物的含量,所以本方法的健全性很好。同批试剂连续6个月应用分析,发现标准曲线基本重合,无明显漂移,非常稳定。
ENR-TRFIA是一种快速、经济、可进行大批量样品筛查的简便方法,其在ENR检测中的应用,将有助于食品安全领域的研究。
[1] 马广鹏, 陈俭清, 张宇辉, 等. 动物常用喹诺酮类抗菌药物分析进展[J]. 畜牧兽医科技信息, 2008(6): 11-13.
[2] BROWN S A. Fluoroquinolones in animal health[J]. J Vet Pharmacol Ther, 1996, 19(1): 1-14.
[3] 成睿珍, 殷安宁. 喹诺酮类药物不良反应[J]. 天津药学, 2008, 20(3):33-35.
[4] 杜付彬, 谭建华. 动物性食品中氟喹诺酮类药物残留检测研究进展[J]. 动物医学进展, 2006, 27(12): 39-43.
[5] 李俊锁, 邱月明, 王超. 兽药残留分析[M]. 上海: 上海科学技术出版社, 2002: 257-258.
[6] HERNANDEZ-ARTESEROS J A, BARBOSA J, COMPANO R, et al.Analysis of quinolone residues in edible animal products[J]. J Chromatogr A, 2002, 945(1/2): 1-24.
[7] MAURER C, MEUNIER D, MADEC J Y, et a1. Shiga toxin Stx2 production is promoted by enrofloxacin in experimental in vitro-selected mutants of Escherichia coli O157:H7 resistant to fluoroquinolones[J].Foodborne Pathog Dis, 2009, 6(2): 257-259.
[8] 林维宣. 各国食品中农兽药残留限量规定[M]. 大连: 大连海事大学出版社, 2002: 1291-1381.
[9] 占春瑞, 温志海, 卜延刚, 等. 鸡肉中多种喹诺酮类兽药残留量的高效液相色谱测定研究[J]. 食品科学, 2005, 26(10): 172-176.
[10] GARCIA M A, SOLANS C, ARAMAY0NA J J, et a1. Simultaneous determination of enrofloxacin and its primary metabolite, ciprofloxacin,in plasma by HPLC with fluorescence detection[J]. Biomed Chromatogr,1999, 13(5): 350-353.
[11] 何碧英, 康莉, 李瑞园, 等. 鱼肉组织中(氟)喹诺酮类药物残留的液相色谱-质谱分析[J]. 华南预防医学, 2009, 35(4): 53-56.
[12] 郑晶, 黄晓蓉, 李耀平, 等. 鳗鱼中恩诺沙星残留量的酶联免疫检测方法[J]. 食品科学, 2004, 25(10): 247-250.
[13] HUET A C, CHARLIER C, TITTLEMIER S A, et a1. Simultaneous determination of (fluoro)quinolone antibiotics in kidney, marine products,eggs, and muscle by enzyme-linked immunosorbent assay (ELISA)[J]. J Agric Food Chem, 2006, 54(8): 2822-2827.
[14] 刘红, 曾振灵. 恩诺沙星ELISA快速检测方法的建立[J]. 中国兽药,2006, 40(11): 13-15.
[15] 李宗妍, 曹立民, 林洪, 等. 水产品中恩诺沙星残留的一步法酶联免疫检测研究[J]. 食品科学, 2009, 30(10): 231-235.
[16] HUANG Biao, XIAO Hualong, ZHU Liguo, et a1. Time-resolved fluoroimmunoassay ofα-fetoprotein[J]. Asian J Nucl Med, 2001, 1(1):40-42.
[17] HEMMILA I, DAKUBU S, MUKKALA V M, et al. Europium as a label in time-resolved immunofluorometric assays[J]. Anal Biochem, 1984,137(2): 335-343.
[18] 金晶, 赖卫华, 涂祖新, 等. 时间分辨荧光免疫分析技术的研究进展及在食品安全领域中的应用[J]. 食品科学, 2006, 27(12): 886-889.
[19] HUANG Biao, XIAO Hualong, ZHANG Jue, et a1. Dual-label timeresolved fluoroimmunoassay for simultaneous detection of aflatoxin B1 and ochratoxin A[J]. Arch Toxicol, 2009, 83(6): 619-624.
Establishment of a Time-resolved Fluoroimmunoassay for Measuring Enrofloxacin
ZHAO Li-li1,2,HUANG Biao3,WANG Xiao-lan1,*,MI Xiao-li2,JIN Jian1,LU Mao-lin2
(1. School of Medicine and Pharmaceutics, Jiangnan University, Wuxi 214122, China;2. Jiangsu Institute of Microbiology Co. Ltd., Wuxi 214063, China;3. Jiangsu Institute of Nuclear Medicine, Wuxi 214063, China)
A time-resolved fluoroimmunoassay (TRFIA) was developed for the rapid and sensitive detection of enrofloxacin(ENR). In indirect TRFIA format, the envelope antigen composed of ENR and ovalbumin (OVA) was coated onto the microplate,and followed by the incubation with free ENR and anti-ENR polyclonal antibody. A goat anti-rabbit IgG conjugated with europium (Eu3+) was used for the detection. The intra-assay CV (coefficient of variation) of the developed method was less than 10% and the inter-assay CV less than 15%. The average recovery rate was 91.62% and the sensitivity was 5 ng/L. The antibody had a linear response over the range from 0.01μg/L to 100μg/L. The ED20, ED50 and ED80 (80%, 50% and 20% effective doses)were 0.088, 3.40 μg/ L and 32.81 μg/ L, respectively. The high stability and broad detection range allows the TRFIA method to have promising application prospects.
enrofloxacin;time-resolved fluoroimmunoassay;veterinary drug residues
R155.5
A
1002-6630(2011)10-0110-05
2010-06-30
国家“863”计划项目(2008AA10Z425)
赵莉莉(1984—),女,硕士研究生,研究方向为食品安全评估。E-mail:zmf743@126.com
*通信作者:王晓岚(1962—),女,副教授,博士,研究方向为营养与食品卫生学。E-mail:wangxl@jiangnan.edu.cn

