骆驼蓬灵单独和与洗必泰联合对抗金黄色葡萄球菌悬浮菌和生物膜的抗菌活性研究
申凤鸽 邢明勋 刘丽慧等


摘要:采用微量稀释法测骆驼蓬灵和洗必泰(CHG)单独抗金黄色葡萄球菌悬浮菌和生物膜的最小抑菌浓度(MIC)和最小杀菌浓度(MBC);棋盘稀释法测定两种药物联合时的协同效果;以及激光共聚焦采集图片检测部分联合的效果。结果表明,骆驼蓬灵和CHG联合具有协同抗菌效果。在悬浮菌试验中,9株显示抗浮游菌协同活性,在生物膜试验中,11株显示协同抗生物膜活性。其余菌株显示相加活性,本试验中无颉颃作用。初步探索了体外试验协同作用的原因,为克服金黄色葡萄球菌耐药提供了一个可供选择的方法。
关键词:骆驼蓬灵;洗必泰;协同作用;抗菌活性
中图分类号:TQ464.4文献标识码:A文章编号:0439-8114(2011)16-3346-05
Antimicrobial Efficacy of Harmaline Alone and in Combination with Chlorhexidine Digluconate against Clinical Isolates of Staphylococcus aureus Grown in Planktonic and Biofilm Cultures
SHEN Feng-ge,XING Ming-xun,LIU Li-hui,YUAN Peng,SHI Qi-yun,YU Lu
(Institute of Zoonosis, Jilin University, Changchun 130062,China)
Abstract: Minimum inhibitory concentrations (MIC) and minimum bactericidal concentrations(MBC) of harmaline and chlorhexidine digluconate (CHG) against clinical isolates of Staphylococcus aureus were determined for each microorganism grown in suspension or biofilm using microbroth dilution method. Chequerboard assays were used to determine synergistic, indifferent or antagonistic interactions between harmaline and CHG; and some of the results were verified by confocal laser scanning microscopy. Harmaline and CHG showed effective antimicrobial activity against suspensions and biofilm cultures of S. aureus. Synergistic antimicrobial effects between harmaline and CHG were observed in 9 and 11 of the 13 S. aureus strains when in suspension and in biofilm, respectively. No antagonistic activity was observed in any of the strains tested. Synergistic activity of harmaline and CHG against clinical isolates of S. aureus (in suspension and in biofilm) were observed in vitro. This study might provide alternative methods to reduce the resistance of S. aureus both in suspension and biofilm.
Key words: harmaline; chlorhexidine digluconate; synergy; antimicrobial activity
金黃色葡萄球菌(S. aureus)是革兰氏阳性菌,是一种重要病原菌,隶属于葡萄球菌属,能导致人体的局部和全身感染[1],此外还能导致皮肤感染,食物中毒,关节炎,肺炎,脑膜炎,脊髓炎,心内膜炎和严重的并发症[2]。
金黄色葡萄球菌能产生生物膜,生物膜能将细菌表面粘连在一起,形成复杂的生物群落,这种复杂的生物群落嵌入自身产生的多糖基质中,能抵抗环境和微生物的威胁[3]。据报道,微生物因子抗生物膜的最低抑菌浓度(MICs)是悬浮菌的10~1 000倍[4]。因此,急需开发新的药物去治疗金黄色葡萄球菌的生物膜感染。
洗必泰(CHG)是一种很普遍的抗微生物因子,在临床实践中用于皮肤的消毒。洗必泰(CHG)具有很宽的抗菌谱,可抗多种革兰氏阳性菌和革兰氏阴性菌,如金黄色葡萄球菌[5]。尽管CHG具有抗微生物活性,但是它的水和含醇制剂对皮肤的穿透力很弱,而细菌能在皮肤的深层存活[6]。因此,开发有效的和迅速穿透皮肤深层的消毒剂是很必要的,以预防侵入相关的皮肤感染[7]。
植物和其他的天然物质是新的抗微生物因子或协作剂的有效资源[8]。研究显示其对耐药的菌株有较宽的抗菌谱[9]。骆驼蓬灵是一种生物碱,是骆驼蓬(Peganum harmala)种子提取物的主要成分,很多体外研究显示它具有抗菌活性[10]。研究表明,这种生物碱具有抗细菌、抗肿瘤、抗血孢子虫、抗癌、抗血管舒张和抗原虫的作用[11,12]。目前尚未发现骆驼蓬灵对金黄色葡萄球菌悬浮菌和生物膜的活性影响的相关报道。
本试验应用了微量稀释法和棋盘法调查骆驼蓬灵单独和与洗必泰联合抗金黄色葡萄球菌的活性。
1材料和方法
1.1材料
甘果红琼脂:0.08 g甘果红(Hopkins and Williams Ltd,Essex,UK),5 g蔗糖(Fisher Scientific, Leicestershire,UK)和1 g琼脂粉(Oxoid,Basingstoke,UK)与98 mL脑心浸液(Oxoid)混合制得,高压灭菌,备用。Mueller-Hinton agar (MHA) and Mueller-Hinton broth(MHB) (Oxoid,Basingstoke,UK)按说明书配制,高压灭菌,备用。20%的洗必泰(CHG)和骆驼蓬灵均购自美国 Sigma 公司。葡萄糖购自于Fisher Scientific。磷酸缓冲盐水(PBS)按说明书配置。96孔、6孔板及玻片购自于Nest Biotech.Ltd。
1.2菌株
12株临床分离株从吉林大学第一附属医院分离得到,ATCC 29213购自于中国医学微生物菌种保藏中心(National Center for Medical Culture Collection)(CMCC)。细菌在MHB或MHA(Oxoid, Basingstoke, UK)上37 ℃培养。
1.3药物准备
骆驼蓬灵用含0.1 mol/L H2SO4的去离子水配成20 480 μg/mL,-70 ℃储存。CHG用MHB稀释成512 μg/mL,备用。
1.4细菌悬液的准备
菌株在MHA板培养,37 ℃过夜。挑单菌落与MHB中摇床过夜,OD660nm 0.1(约108 CFU/mL)。接种物在MHB中稀释,使菌液的浓度到106 CFU/mL。
1.5悬浮菌的微量稀释法药物敏感试验
CHG和骆驼蓬灵的最低抑菌浓度(MIC)通过倍比稀释法按CLSI原则[13]测得。在96孔板中用MHB将抗菌药物做倍比稀释,得到100 μL的一系列药液。每孔加入稀释好的抗菌药物100 μL,每孔含菌1×105CFU;只加培养基的为对照孔;将96孔板置于37 ℃培养24 h。肉眼未见细菌生长的最低药物浓度即为该药的最低抑菌浓度(MIC)。所有抑菌的孔中取适量液体按原来的次序涂于MH琼脂板上,37 ℃培养24 h,肉眼未见细菌生长的最低药物浓度为最小杀菌浓度(MBC)。试验重复3次。
1.6悬浮菌的棋盘测定试验
CHG与骆驼蓬灵间的协同作用是经微量棋盘测定法测定的[14]。取50 μL用MHB倍比稀释的骆驼蓬灵(1/32×MIC~4×MIC)加于96孔板的横行,50 μL CHG的浓度梯度依次从1/256×MIC到4×MIC加于竖列。在孔中加入100 μL浓度为106 CFU/mL的菌液。第12列作为对照,每孔分别加200 μL MHB或100 μL 106CFU/mL 的菌液和100 μL培养基。37 ℃培养24 h。通过计算分级抑制浓度指数(FICI)来评价药物抗菌作用[15]。FICI=(MICa联合/MICa单药)+(MICb联合/MICb单药)。FICI≤0.5为协同;FICI>4.0为颉颃;0.5<FICI≤4为相加。试验重复2次。
1.7生物膜的建立
取能形成生物膜的菌株液200 μL,浓度为1×105 CFU/mL,加于96孔板,37 ℃培养48 h。
1.8生物膜的微量稀释药敏试验
弃去形成生物膜的96孔板中的悬液,用250 μL PBS洗去悬浮的残余菌液。用MHB倍比稀释的CHG和骆驼蓬灵。200 μL药物稀释液按顺序加入各孔,对照孔只加PBS液200 μL。37 ℃培养24 h。弃去悬液,用PBS洗一次,加入250 μL PBS,50 Hz超声波震荡30 min,每孔的250 μL液体分别涂于MHA上,制备生物膜[16],37 ℃培养24 h。肉眼可见与对照孔菌量一样或少于对照孔(加PBS的孔)的最低药物浓度为最小抑制膜生长的浓度(MBIC),未见细菌生长的最小药物浓度为最小杀生物膜浓度(MBBC)。试验重复3次。
1.9生物膜的棋盘测定试验
形成生物膜后,按上述方法用PBS洗1次,分别取100 μL CHG(1/256×MIC~4×MIC)和骆驼蓬灵(1/16×MIC~4×MIC)稀释液加于96孔板中,CHG加到豎列孔中,骆驼蓬灵加到横行。37 ℃培养24 h。弃去药液后再用PBS洗1次,用以前描述的方法得到生物膜,每孔250 μL涂到MHA上,37 ℃ 24 h培养后,评估FICI值。
1.10激光共聚焦(CLSM)
通过激光共聚焦摄像验证CHG和骆驼蓬灵单独和联合后的活性。2 mL菌液加于6孔板的含有灭菌玻片的各孔中,培养48 h,形成生物膜。玻片用PBS洗一次,将玻片移入含受试条件的药液中,培养24 h。然后用PBS洗,用LIVE/DEAD BacLight Bacterial Viability kit(Invitrogen Molecular Probes, Eugene,OR,USA)的说明书进行染色。用 Olympus FV1000激光共聚焦显微镜(Olympus,Tokyo,Japan)a×60 物镜采集图像.。采用Fluoview version 1.7.3.0.分析图像和输出图像。
2结果
2.1CHG和骆驼蓬灵对抗悬浮菌和生物膜的微量药敏试验
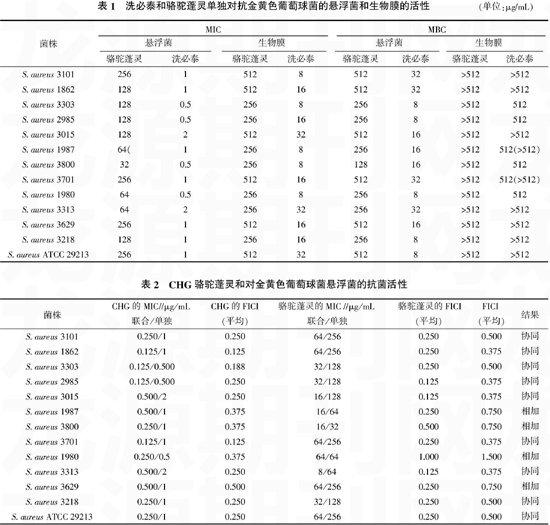
笔者对12株临床分离株和1株质控株ATCC 29213进行了调查,CHG和骆驼蓬灵单独对抗金黄色葡萄球菌的悬浮菌和生物膜的活性,见表1。
2.2CHG和骆驼蓬灵对抗悬浮菌和生物膜的棋盘试验
在悬浮菌中CHG联合骆驼蓬灵的抗菌活性,见表2。结果显示,在受试的悬浮菌中有9株具有协同作用,其FICI值0.375~0.500;4株有相加作用,其FICI值0.750~1.500。
在对抗生物膜的试验中,受试的13株金黄色葡萄球菌中11株具有协同活性,FICI值为0.250~0.500。S. aureus 3629和S. aureus 3218显示了相加的抗菌活性,其FICI值分别是0.750和1.500(表3)。在所有试验中均未出现颉颃作用。
2.3激光共聚焦试验
通过激光共聚焦试验评估CHG和骆驼蓬灵单独和联合抗生物膜活性(图1)。处理24 h后对照组可见大量的活菌生长(图1-E),与对照相比,4×MIC骆驼蓬灵处理后可见大量的细菌死亡,仅留部分菌在玻片上(图1-C),4×MIC CHG处理后与之相似,可见大量的细菌死亡(图1-A)。用CHG和骆驼蓬灵联合处理后,图片显示出极强的杀菌效果,仅有少量的菌存活(图1-F)。
4讨论
在本研究中,我们用棋盘稀释法初步分析了药物-药物相互作用。我们发现骆驼蓬灵抗金黄色葡萄球菌的活性较弱,但与CHG联合时具有较好的协同效果。据报道发现桉树油和CHG具有较好抗金黄色葡萄球菌生物膜活性[17],这与我们的结果一致。此外,有报道发现骆驼蓬灵具有毒性,但是其毒性很低[18]。据研究发现生物膜能增加了药物的耐药性[19]。同时,CHG和骆驼蓬灵对抗生物膜时有较高的MBCs值(≥512 μg/mL)。
在本研究中,骆驼蓬灵联合CHG抗受试的金黄色葡萄球菌的悬浮菌和生物膜均具协同效果。此外,在抗生物膜的试验中,结果显示二者联合使用具有协同的作用,仅在S. aureus 3629和S. aureus 3218表现出相加的效果。重要的是,我们对棋盘稀释法测得的结果用CLSM进行了进一步的证实。CLSM的图像显示骆驼蓬灵不仅能强有力地杀死细菌,而且也能很好地清除生物膜(图1-D)。与之相似的是,高浓度的CHG能有效地清除生物膜,但是它的杀菌作用较弱(图1-B)。
在临床中,CHG广泛被用于皮肤消毒。CHG具有亲水和疏水基因,研究表明生物膜的细胞外基质所带的阴离子阻碍了CHG阳离子的扩散,且能使细胞外基质的理化性质和三级结构改变[5]。二氢骆驼蓬碱和骆驼蓬灵是骆驼蓬种子提取物的主要生物碱,它用于控制自热感染和实验感染的牛血孢子虫[20]。也有研究表明骆驼蓬灵氨基氧化酶抑制子是一个Na+/Ca2+交换的弱的抑制子[21],它对NHE(Na+/H+交换)亚型显示出不同的亲和力[22]。我们发现骆驼蓬灵与CHG联合时在受试多数菌株中表现协同活性。此外,当骆驼蓬灵和CHG联合时能导致生物膜的结构破坏和细菌的死亡。骆驼蓬灵对抗金黄色葡萄球菌生物膜的机制目前尚不清楚。
综上所述,尽管骆驼蓬灵单独使用时的抗菌活性较弱,但与CHG联合对抗黄色葡萄球菌分离株和质控株ATCC 29213有潜在协同活性。该发现具有一定的临床价值。同时,对开发新型抗耐药金黄色葡萄球菌药物具有重要价值。
參考文献:
[1] LID,CHEUNG A. Repression of hla by rot is dependent on sae in Staphylococcus aureus[J]. Infection and Immunity,2008,76(3):1068-1075.
[2] BRONNER S,MONTEIL H,PREVOST G. Regulation of virulence determinants in Staphylococcus aureus:complexity and applications[J]. FEMS Microbiology Reviews,2004,28(2):183-200.
[3] JORGE P R, CELINE V,WARREN E R. et al. Activities of high-dose daptomycin, vancomycin, and moxifloxacin alone or in combination with clarithromycin or rifampin in a novel in vitro model of Staphylococcus aureus biofilm[J]. Antimicrobial Agents and Chemotherapy,2010,54(10):4329-4334.
[4] CERI H, OLSON M, STREMICK C,et al. The calgary biofilm device: new technology for rapid determination of antibiotic susceptibilities of bacterial biofilms[J]. J Clin Microbiol,1999, 37(6):1771-1776.
[5] HOPE CK,WILSON M. Analysis of the effects of chlorhexidine onoral biofilm vitality and structure based on viability profiling and an indicator of membrane integrity[J]. Antimicrob Agents Chemother,2004,48(5):1461-1468.
[6] KARPANEN T J, WORTHINGTON T, CONWAY B R. et al. Permeation of chlorhexidine from alcoholic and aqueous solutions within excised human skin[J]. Antimicrob Agents Chemother,2009,53(4): 1717-1719.
[7] KARPANEN T J, WORTHINGTON T, CONWAY B R. et al.penetration of chlorhexidine into human skin[J]. Antimicrobial Agents and Chemotherapy,2008,47(10):3633-3636.
[8] GUO N,LIU J,WU X,et al. Antifungal activity of thymol against clinical isolates of fluconazole-sensitive and-resistant Candida albicans[J]. J Med Microbiol,2009,58(8):1074-1079.
[9] Li L,Li Z,Guo N,et al. Synergistic activity of 1-(1-naphthylmethyl)-piperazine with ciprofloxacin against clinically resistant Staphylococcus aureus, as determined by different methods[J]. Lett Appl Microbiol,2011,52(4):372-378.
[10] ARSHAD N, NEUBAUER C, HASNAIN S, et al. Peganum harmala can minimize Escherichia coli infection in poultry, but long-term feeding may induce side effects[J]. Poult Sci,2008,87(2):240-249.
[11] CHEN Q, CHAO RH,CHEN HS, et al.Antitumor and neurotoxic effects of novel harmine derivatives and structure-activity relationship analysis[J]. Int J Cancer,2005,114(5):675-682.
[12] BERROUGUI H, MARTIN C,KHALIL A,et al. Vasorelaxant effects of harmine and harmaline extracted from Peganum harmala L. seeds in isolated rat aorta[J]. PharmacolRes,2006,54(2):150-157.
[13] Clinical and Laboratory Standards Institute (CLSI). Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically-eighth edition,Approved Standard M7-A8[M]. USA:Wayne PA,2009.
[14] SHIN S,LIM S. Antifungal effects of herbal essential oils alone and in combination with ketoconazole against Trichophyton spp[J]. J Appl Microbiol,2004,97(6):1289-1296.
[15] KARPANEN T J,WORTHINGTON T,HENDRY E R,et al. Antimicrobial efficacy of chlorhexidine digluconate alone and in combination with eucalyptus oil, tea tree oil and thymol against planktonic and biofilm cultures of Staphylococcus epidermidis[J]. Journal of Antimicrobial Chemotherapy, 2008, 62(5):1031-1036.
[16] ADAMS D,QUAYUM M,WORTHINGTON T,et al. Evaluation of a 2% chlorhexidine gluconate in 70% isopropyl alcohol skin disinfectant[J]. J Hosp Infect,2005,61(4):278-290.
[17] HENDRY E, WORTHINGTON T, CONWAY B, et al. Antimicrobial efficacy of eucalyptus oil and 1,8-cineole alone and in combination with chlorhexidine digluconate against microorganisms grown in planktonic and biofilm cultures[J]. Journal of Antimicrobial Chemotherapy,2009,64(6):1219-1225.
[18] DI C, DELMA F, OLLIVIER E, et al. In vitro activity of the beta-carboline alkaloids harmane, harmine, and harmaline toward parasites of the species Leishmania infantum[J]. Exp Parasitol,2004,106(3-4):67-74.
[19] SAGINUR R, STDENIS M,FERRIS W, et al. Multiple combination bactericidal testing of staphylococcal biofilms from implant-associated infections[J]. Antimicrob Agents Chemother,2006,50(1):55-61.
[20] FAN B, LIANGJ,MEN J, et al. Effect of total alkaloid of Peganumharmala L. in the treatment of experimental haemosporidian infections in cattle[J]. Trop Anim Health Prod,1997,29(Suppl. 4):77-83.
[21] SULEIMAN M S, REEVES J P. Inhibition of Na+-Ca2+ exchange mechanism in cardiac sarcolemmal vesicles by harmaline[J]. Comp Biochem Physiol C,1987,88(1):197-200.
[22] MORDECAI P,JONATHAN W. Sodium/Calcium exchange: its physiological implications[J]. Physiological Reviews,1999,
79(3):763-854.

