宁夏沙枣多糖的酶法提取工艺
王凯 王青

摘要:研究酶法提取宁夏沙枣(Elaeagnus angustifolia L.)中多糖的提取工艺。在单因素试验的基础上,采用正交设计考察了不同pH值、酶的添加量、酸提时间对多糖提取率的影响。结果表明,最佳工艺条件为酶提pH值4.38,添加酶的质量分数5%,酶提时间3 h,酶提温度60 ℃。最佳条件下多糖的提取率为72.93%。
关键词:宁夏沙枣;多糖;提取工艺;正交试验
中图分类号:S665.1文献标识码:A文章编号:0439-8114(2011)16-3368-03
Study on Enzymatic Extracting Conditions of Polysaccharide from
Elaeagnus angustifolia L. in Ningxia
WANG Kai1,WANG Qing2
(1. School of Chemistry and Chemical Engineering,Beifang University of Nationalities, Yinchuan 750021, China;
2. Shangqiu Medical College, Shangqiu 476100, Henan,China)
Abstract: The enzymatic extracting conditions of polysaccharide from Elaeagnus angustifolia L. in Ningxia was studied. Based on single factor test, the effects of pH, enzyme dosage, enzymolysis time on polysaccharide extracting rate were investigated and optimized by orthogonal test. The results showed that the optimum conditions for extracting polysaccharide from E. angustifolia by enzyme were pH 4.38, enzyme dosage 5%,enzymolysis time 3 h, enzymolysis temperature 60 ℃. Under optimal conditions, the extracting rate of polysaccharide was 72.93%.
Key words: Elaeagnus angustifolia L.; polysaccharide; extracting condition; orthogonal test
沙枣(Elaeagnus angustifolia L.)又名银柳、香柳、桂香柳、七里香、红豆等,为胡颓子科胡颓子属落叶(或常绿)乔木或灌木[1]。主要分布在我国华北、西北等省区,且以西北荒漠、半荒漠地区为分布中心[2]。沙枣多糖在抗肿瘤、消炎、抗病毒、降血糖、降血脂、抗衰老、抗凝血、免疫调节等方面有生物活性作用[3]。廉宜君等[4]对新疆的沙枣多糖的提取进行了研究,但宁夏本地产沙枣多糖的提取尚无报道。该试验采用正交试验对宁夏沙枣多糖的酶法提取工艺进行研究,为制定更加经济的沙枣多糖提取工艺提供试验依据。
1材料与方法
1.1材料
722S型分光光度计、PHS-3C型精密pH计、FA1004N型电子分析天平、JY3002型电子天平(均购自上海精密科学仪器有限公司);KA-1000型离心机(上海安亭科学仪器厂);101型电热鼓风干燥箱(上海申光仪器仪表有限公司)。
沙枣,采于宁夏回族自治区银川市西夏区同心南路,60℃干燥,磨碎,40目过筛,制成沙枣粉;果胶酶(北京化工厂)、醋酸、醋酸钠、葡萄糖、浓硫酸、苯酚均为国产分析纯。
1.2方法
1.2.1标准曲线的绘制①苯酚的配制。称取一定量的苯酚固体,45 ℃溶解为液体,加入100 mL的圆底烧瓶中,再加0.02 g的铝片和0.05 g碳酸氢钠,常压蒸馏收集180~182 ℃馏分,得白色针状苯酚结晶。加一定体积去离子水溶解,配成质量分数为5%的苯酚溶液,避光贮藏备用。②标准葡萄糖溶液的配制。精密称取60 ℃干燥至恒重的葡萄糖0.100 0 g,用去离子水溶解并定容在100 mL的容量瓶中,配制成浓度为1.000 0 mg/mL的标准葡萄糖溶液。③标准曲线的绘制。准确移取0.00、0.40、0.80、1.20、1.60、2.00、2.40、2.80 mL 1.000 0 mg/mL标准葡萄糖溶液于100 mL的容量瓶中,去离子水定容,摇匀。再分别精密移取上述8种浓度的溶液2.00 mL于10 mL的具塞刻度试管中,加5%(m/m,下同)的苯酚溶液1.00 mL,混匀,再加浓硫酸5.00 mL,40 ℃的水浴中恒温30 min,然后立即转移至冰水浴中冷却30 min,用试剂空白作参比,于490 nm波长处测定吸光度[5],结果见表1。标准曲线的回归方程为:
A=62.226 0C-0.001 2,r=0.999 7。标准曲线在0.000~0.007 mg/mL范围内线性良好。
1.2.2多糖提取工艺流程沙枣→60 ℃烘干→去核→粉碎→热水浸提30 min→酶提→灭酶(80 ℃,1 h)→离心分离6 min→稀释,定容→苯酚-硫酸法测吸光度。
1.2.3多糖含量的测定称0.50 g沙枣粉于50 mL的具塞三角瓶,加去离子水10 mL,摇匀,80 ℃恒温30 min,冷却至室温,加入用缓冲溶液定容的果胶酶,50 ℃水浴中恒温2 h,然后80 ℃恒温1 h灭酶,离心得样品液,准确移取上清液0.10 mL,定容至100 mL的容量瓶中,再移取该液2.00 mL于10 mL具塞刻度试管中,先加5%的苯酚溶液1.00 mL,混匀后加入浓硫酸5.00 mL。在40 ℃水浴中恒温30 min,冰水浴中冷却30 min,以试剂空白做参比,测定其吸光度。用标准曲线计算多糖含量。多糖的提取率=多糖的濃度/枣粉的浓度×100%。
1.2.4酶种类的选取根据其他植物多糖提取累积的经验,选取果胶酶、纤维素酶及其两者的复合酶为参考因素,确定酶的种类。为了保证试验的准确性,做3次平行试验,结果都显示果胶酶的作用大于纤维素酶和复合酶,因此试验采用果胶酶。表2为3次试验结果的平均值。
2结果与分析
2.1单因素试验结果
2.1.1pH值对沙枣多糖提取率的影响适当的pH值下,静电作用维持了酶活性中心的最佳三维构象,促进了酶和底物的结合;pH值不同,酶与底物所带电荷不同,酶的立体构象以及酶与底物的亲和力不同,催化速度也就不同。称取沙枣粉0.50 g,加去离子水10 mL,摇匀,80 ℃恒温30 min,冷却至室温,准确移取用pH值为3.40、3.81、4.38、4.92的缓冲溶液配制的质量分数为2%的果胶酶5.00 mL,酶提温度50℃、酶提时间2 h条件下,按1.2.3的方法操作,研究不同pH值对沙枣多糖提取率的影响。结果见表3。由表可见,开始时随着pH值的增大,提取率也在增大;在pH值为3.81时,提取率最大,为63.67%;随着pH值的继续增大,提取率开始下降,所以pH值选取3.81。
2.1.2酶的添加量对沙枣多糖提取率的影响生化反应中,在底物浓度相同条件下,酶促反应速度与酶的初始浓度成正比。但即使酶浓度足够高,随底物浓度的升高,酶促反应速度并没有因此增加,反而受到抑制。称取沙枣粉0.50 g,加去离子水10 mL,摇匀,80 ℃恒温30 min,冷却至室温,再准确移取pH值为3.81的缓冲溶液配制的质量分数为2%、3%、4%、5%的果胶酶5.00 mL,酶提温度50 ℃、酶提时间2 h条件下,按1.2.3的方法操作研究不同酶的添加量对沙枣多糖提取率的影响,结果见表4。由表可知,在酶的添加量为4%时提取率最大,为69.07%,但随着酶的添加量的继续增大,提取率开始出现下降。所以,酶的添加量选4%。
2.1.3酶提温度对沙枣多糖提取率的影响各种酶的活性都有合适的温度范围,温度过高或过低都會降低酶的催化效率,即降低酶促反应速度。温度太高,酶会被破坏,酶的催化作用完全丧失。称取沙枣粉0.50 g,加去离子水10 mL,摇匀,80 ℃恒温30 min,冷却至室温,再准确移取pH值为3.81的缓冲溶液配制的质量分数为4%的果胶酶5.00 mL,酶提温度分别为40、50、60、70 ℃,酶提时间为2 h,按1.2.3方法操作,研究不同酶提温度对沙枣多糖提取率的影响,结果见表5。由表5可知,随着酶提温度上升,酶的活性也在上升,提取率也随之增大。在60 ℃时出现最大值,说明此时酶达到最大活性,多糖提取率最大,达62.91%。随着酶提温度的继续升高,酶的活性开始下降,提取率也随之减小。所以酶提温度选60 ℃。
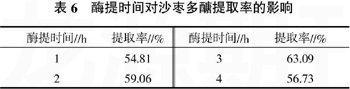
2.1.4酶提时间对沙枣多糖提取率的影响酶作用的时间和酶所反应的程度有密切的关系,如果反应的时间太短,则酶作用的不充分,而当酶作用的程度达到一定值时,提取率也不会随着酶提时间的延长而增大。称取沙枣粉0.50 g,加去离子水10 mL,摇匀,80 ℃恒温30 min,冷却至室温,再准确移取pH值为3.81的缓冲溶液配制的质量分数为4%的果胶酶5.00 mL,酶提温度为60 ℃,酶提时间分别为1、2、3、4 h,按1.2.3方法操作,研究不同酶提时间对沙枣多糖提取率的影响,结果见表6。由表6可知,在酶提时间为3 h时,提取率为63.09%,达最大。而后随着酶提时间增长,提取率开始下降。所以酶提时间选3 h。
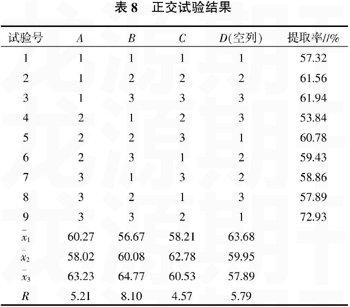
2.2正交试验设计及结果
在单因素试验的基础上,以沙枣多糖提取率为指标,选择pH值、酶的添加量、酶提时间3个因素,每个因素选取3个水平,采用L9(34)正交试验优选沙枣多糖的酶提工艺。工艺的因素与水平见表7。
根据表7的因素水平表,进行L9(34)试验,正交试验的顺序采取随机抽签的原则,以体现其随机性。而且为了提高试验的准确性,排除单次试验由于人为失误造成的误差,每个试验号都分别做3次平行试验,试验结果取平均值,结果见表8。
以多糖提取率为考察指标,分析果胶酶提取宁夏沙枣多糖的提取工艺,由表8可见,各因素影响主次顺序为:B>D>A>C,B因素即酶的添加量为影响宁夏沙枣多糖提取率的主要因素,A因素的水平3最大,B因素的水平3最大,C因素的水平2最大,因此,最佳水平组合为A3B3C2,即果胶酶提取沙枣多糖的最佳工艺为pH值4.38,添加酶的质量分数5%,酶提时间3 h。此条件即为正交试验中的9号试验,提取率达72.93%,为各次试验最大值,所以不用进行重复性验证试验。
3结论
试验结果表明,酶的添加量是影响宁夏沙枣多糖提取率的主要因素。果胶酶提取宁夏沙枣多糖的最佳工艺为pH值4.38,添加酶的质量分数5%,酶提时间3 h,酶提温度60℃。最佳条件下沙枣多糖的提取率为72.93%。
参考文献:
[1] 王雅,赵萍,王玉丽,等. 野生沙枣果实营养成分研究[J]. 甘肃农业大学学报,2006,41(6):130-132.
[2] 辛艳伟. 沙枣的开发和利用[J]. 安徽农业科学,2007,35(2):399-400.
[3] 王青宁,吕兴连,彭韵硕,等. 沙枣多糖EAP-2的提取纯化及初步分析[J]. 食品科学,2007,28(1):43-47.
[4] 廉宜君,李炳奇,刘红,等. 复合酶辅助超声波提取沙枣多糖的工艺研究[J]. 中国中医药信息杂志,2009,16(6):47-49.
[5] 李小平,陈锦屏. 油枣多糖的酶法提取及其对多糖分子量分布的影响[J]. 食品科学,2007,28(8):191-192.

