β-葡萄糖苷酶酶解淫羊藿苷制备宝藿苷Ⅰ的工艺研究Δ
张振海,陈玲玲,贾晓斌,贺俊杰,金 鑫(江苏省中医药研究院国家中医药管理局中药释药系统重点研究室,南京市 210028)
β-葡萄糖苷酶酶解淫羊藿苷制备宝藿苷Ⅰ的工艺研究Δ
张振海*,陈玲玲,贾晓斌#,贺俊杰,金 鑫(江苏省中医药研究院国家中医药管理局中药释药系统重点研究室,南京市 210028)
目的:研究用β-葡萄糖苷酶酶解淫羊藿苷制备宝藿苷Ⅰ的工艺。方法:采用β-葡萄糖苷酶酶解淫羊藿苷制备宝藿苷Ⅰ,以转化率为指标,通过单因素试验考察温度、pH值、酶与底物质量比、底物浓度和反应时间对转化率的影响。结果:酶解反应的优化条件为温度50℃、pH=5.0的枸橼酸-枸橼酸三钠缓冲液、酶与底物质量比1∶2、底物浓度1mg·mL-1、反应时间90min。结论:β-葡萄糖苷酶酶解淫羊藿苷制备宝藿苷Ⅰ,转化率高,工艺简单、可靠,反应条件温和。
淫羊藿苷;宝藿苷Ⅰ;β-葡萄糖苷酶;生物转化
宝藿苷Ⅰ为小檗科淫羊藿属植物淫羊藿Epimedium brevicornum Maxim.中的一种多羟基黄酮类单体成分,有较好的抗肺癌细胞活性,明显优于淫羊藿中其他黄酮苷类化合物,亦有文献报道其生物药剂学性质明显优于淫羊藿中其他黄酮类多糖苷[1]。药理研究表明,宝藿苷Ⅰ具有抗肿瘤、抗骨质疏松等作用[2~4]。有报道大鼠口服淫羊藿苷后在粪便和尿液中均检出宝藿苷Ⅰ,推测大鼠肠菌酶可将淫羊藿苷转化为宝藿苷Ⅰ,吸收入血的主要为宝藿苷Ⅰ[5]。宝藿苷Ⅰ在淫羊藿药材中的含量较低,由于极性相当的成分很多,故分离纯化较困难。酶解反应具有选择性高、反应条件温和、转化率高、分离纯化容易、对环境无污染及成本低廉等优点[6,7]。β-葡萄糖水解淫羊藿苷主要是C-7位去葡萄糖,能够选择性地切断淫羊藿C-7位的β-D-葡萄糖,效果优于纤维素酶。本试验研究了β-葡萄糖苷酶酶解淫羊藿苷制备宝藿苷Ⅰ的工艺,旨在为宝藿苷Ⅰ的工业化生产提供参考。
1 仪器与试药
高效液相色谱(HPLC)仪,包括600型泵、717自动进样器、2996DAD紫外检测器、Empower数据处理系统(美国Waters公司);数显气浴恒温振荡器(金坛市双捷实验仪器厂);AL204十万分之一天平(瑞士梅特勒-托利多仪器有限公司);离心机(上海安亭科学仪器厂)。
淫羊藿苷(陕西慧科植物开发有限公司,批号:ES20060310,纯度>98%);纤维素酶、β-葡萄糖苷酶(夏盛实业集团有限公司);柚皮苷酶(济宁和美生物工程有限公司);0.45μm微孔滤膜(江苏汉邦科技有限公司);宝藿苷Ⅰ标准品(笔者自制,纯度>98%);甲醇、乙腈为色谱纯,水为高纯水,其余试剂均为分析纯。
2 方法与结果
主要以淫羊藿苷为原料,选择酶解能力较强的纤维素酶、柚皮苷酶与β-葡萄糖苷酶为水解酶,从中筛选出最佳酶系。
2.1 淫羊藿苷酶解工艺
精密称取0.5g淫羊藿苷,置于50mL容量瓶中,纯净水定容,得10mg·mL-1的淫羊藿苷混悬液。分别称取0.4g纤维素酶、β-葡萄糖苷酶、柚皮苷酶置于10mL容量瓶中,纯净水定容,得浓度均为40mg·mL-1的各酶液。精密吸取适量的淫羊藿苷混悬液与1种酶液置于密闭容器中,反应液的pH值在酶水解活性范围内,酶活性适宜温度条件下,转速为50r·min-1,振摇反应完全后加入乙醇,过滤后除去乙醇,得宝藿苷Ⅰ粗品。
2.2 分析方法
2.2.1 色谱条件 色谱柱:Phenomenex Luna C18(250mm×4.6mm,5μm);流动相:甲醇-水(75∶25);检测波长:270nm;流量:1.0mL·min-1;柱温:30℃;进样量:20μL。在此色谱条件下分别进样标准品和供试品溶液,结果宝藿苷Ⅰ和淫羊藿苷的保留时间分别为9.088、2.474min。色谱见图1。
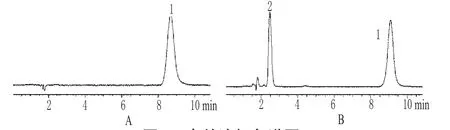
图1 高效液相色谱图A.宝藿苷Ⅰ标准品;B.酶解样品;1.宝藿苷Ⅰ;2.淫羊藿苷Fig 1 HPLC chromatogramsA.baohuosideⅠ standard substance;B.enzymolysis sample;1.baohuosideⅠ;2.icariin
2.2.2 标准品溶液的制备 精密称取105℃干燥至恒重的宝藿苷Ⅰ标准品2.85mg,置10mL容量瓶中,加乙醇适量,超声溶解,放冷,加乙醇定容,摇匀,得质量浓度为0.285mg·mL-1的标准品溶液,冰箱中贮藏,备用。
2.2.3 供试品溶液的制备 吸取淫羊藿苷混悬液和1种酶液置于10mL具塞试管中,加入一定的缓冲液,置于一定的温度下,反应一定时间,加入乙醇终止反应,并定容至10mL,摇匀,0.45μm微孔滤膜过滤后即得供试品溶液。
2.2.4 线性关系考察 精密量取宝藿苷Ⅰ标准品溶液适量,分别置于10mL量瓶中,用甲醇稀释并定容,得浓度分别为142.50、71.25、35.62、17.81、8.90μg·mL-1的标准系列溶液。分别精密吸取各标准溶液及“2.2.2”项下溶液10μL,注入液相色谱仪,记录峰面积。以宝藿苷Ⅰ检测浓度(X,μg·mL-1)为横坐标,峰面积积分值(Y)为纵坐标,进行线性回归,得回归方程为Y=192784X+1840729(r=0.9998,n=5)。结果表明,宝藿苷Ⅰ检测浓度在8.90~285.00μg·mL-1范围内与峰面积积分值呈良好的线性关系。
2.2.5 精密度试验 精密吸取71.25μg·mL-1的宝藿苷Ⅰ标准品溶液10μL,按上述色谱条件连续进样6次,测定峰面积。结果,宝藿苷Ⅰ峰面积的RSD=0.11%(n=6),表明仪器精密度良好。
2.2.6 稳定性试验 取同一份配好的供试品溶液,室温放置,分别于0、1、2、4、8、12、24h进样,按上述色谱条件测定。结果,宝藿苷Ⅰ峰面积的RSD=1.12%(n=7),表明供试品溶液在24h内稳定。
2.2.7 重复性试验 按供试品溶液的制备项下操作,平行制备6份样品,照上述色谱条件测定。结果,宝藿苷Ⅰ峰面积的RSD=1.56%(n=6),表明方法重复性良好。
2.2.8 加样回收率试验 精密量取已知宝藿苷Ⅰ浓度(浓度:0.3mg·mL-1)的供试品溶液6份,每份0.5mL,分别精密加入标准品溶液0.5mL,混匀后,照上述色谱条件测定,计算加样回收率。结果,平均回收率为96.54%,RSD=1.47%(n=6)。
2.2.9 宝藿苷Ⅰ转化率的测定宝藿苷Ⅰ转化率=cV/(m×M1/M2)×100%。式中,c为酶解后混悬液中宝藿苷Ⅰ的质量浓度;V为混悬液体积;m为酶解前淫羊藿苷的量(mg);M1为宝藿苷Ⅰ的相对分子质量;M2为淫羊藿苷的相对分子质量。
2.3 酶系筛选
精密吸取10mg·mL-1的淫羊藿苷混悬液200μL,分别加入50μL β-葡萄糖苷酶液、纤维素酶液、柚皮苷酶液,再加入1.75mL pH值为5.0的枸橼酸-枸橼酸三钠缓冲液,置于10mL具塞试管中,置于50℃气浴震荡箱中反应12h后,加入8mL乙醇终止反应,计算宝藿苷Ⅰ的转化率(每种酶系各平行做3份),结果见图2。

图2 各种酶对宝霍苷Ⅰ的转化率(n=3)Fig 2 Effect of different enzyme on the biotransformation of baohuosideⅠ(n=3)
由图2可以看出,在3种供试酶中,β-葡萄糖苷酶能在12h内将淫羊藿苷转化为宝藿苷Ⅰ,且转化率最高,达到100%,显著高于其他2个酶系,故选择β-葡萄糖苷酶作为最佳酶系。
2.4 β-葡萄糖苷酶酶解淫羊藿苷工艺研究
2.4.1 酶解反应最适温度 精密吸取10mg·mL-1的淫羊藿苷混悬液200μL、β-葡萄糖苷酶液50μL、1.75mL pH值为5.0的枸橼酸-枸橼酸三钠缓冲液,置于10mL具塞试管中,分别于30、37、50、60、70℃反应50min后,加入8mL乙醇终止反应,计算宝藿苷Ⅰ转化率(每个温度各平行做3份),结果见图3。
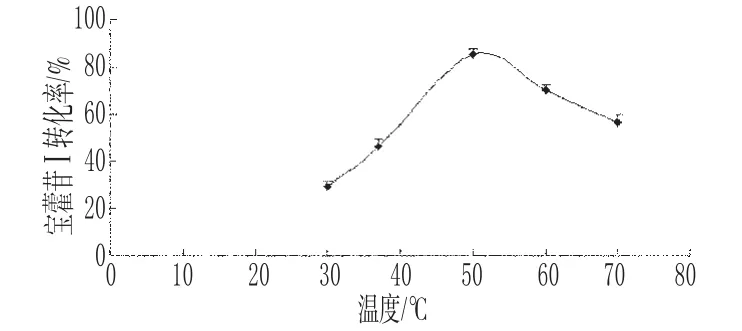
图3 温度对宝藿苷Ⅰ转化率的影响(n=3)Fig 3 Effect of temperature on the biotransformation of baohuosideⅠ(n=3)
温度是影响酶活力的一个重要因素,温度过低时,酶活性受到抑制;在一定的温度范围内,升高温度,使酶活化;温度过高则会使部分酶蛋白失活。由图3可知,宝藿苷Ⅰ转化率在50℃时最高,表明50℃是β-葡萄糖苷酶的最适温度点。
2.4.2 酶解反应最适pH值 分别配制pH值为4.5、5.0、5.5、6.0、6.5、7.0的磷酸氢二钠-磷酸二氢钠、醋酸-醋酸钠、枸橼酸-枸橼酸三钠缓冲体系。在温度为50℃条件下,精密吸取10mg·mL-1的淫羊藿苷混悬液 200μL、50μL β-葡萄糖苷酶液、1.75mL缓冲液,置于10mL具筛试管中,反应50min后加入8mL乙醇终止反应,计算宝藿苷Ⅰ转化率(每个样品各平行做3份),结果见图4。
酶解反应过程中,缓冲液的离子会改变酶的构象,从而影响其活性。适宜的pH环境,可以保持酶最佳活性,以达到较高的转化率。由图4可知,在3种缓冲体系中,当pH值为5.0时,β-葡萄糖苷酶具有较高的活性,推测β-葡萄糖苷酶在偏酸性条件下具有较高的活性;在相同pH值即反应体系中具有相同的氢离子浓度条件下,发现枸橼酸-枸橼酸三钠体系中的宝藿苷Ⅰ的转化率普遍高于其他2种体系。
2.4.3 酶与底物质量比对宝藿苷Ⅰ转化率的影响 精密吸取10mg·mL-1的淫羊藿苷混悬液5mL,共6份,分别加入5、10、15、25、30、40、50mg β-葡萄糖苷酶,用pH值为5.0的枸橼酸-枸橼酸三钠缓冲液稀释至50mL,在温度为50℃条件下酶解50 min后,加入200mL乙醇终止反应,计算宝藿苷Ⅰ转化率(每种质量比各平行做3份),结果见图5。

图4 pH对宝藿苷Ⅰ转化率的影响(n=3)a.枸橼酸-枸橼酸三钠缓冲体系;b.磷酸氢二钠-磷酸二氢钠缓冲体系;c.醋酸-醋酸钠缓冲体系Fig 4 Effect of pH values on the biotransformation of baohuosideⅠ(n=3)a.citric acid-sodium citrate buffer;b.disodium hydrogen phosphate-sodium dihydrogen phosphate buffer;c.acetate-sodium acetate buffer
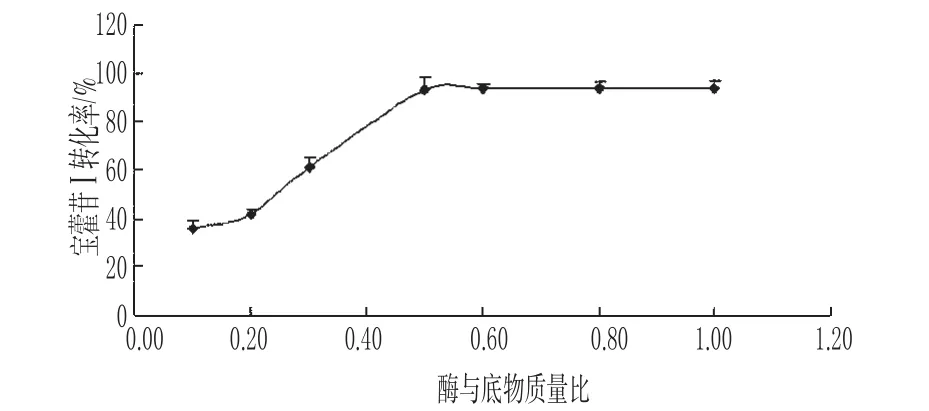
图5 酶与底物质量比对宝霍苷Ⅰ转化率的影响(n=3)Fig 5 Effect of ratio of enzyme to substract on the biotransformation of baohuosideⅠ(n=3)
为保证底物与酶充分接触,选择合适的酶与底物质量比也是影响转化率的关键。在温度为50℃条件下,在pH值为5.0的枸橼酸-枸橼酸三钠缓冲液中,在淫羊藿苷的浓度为1mg·mL-1时,酶解反应50min,当β-葡萄糖苷酶与淫羊藿苷的质量比为1∶2时,宝藿苷Ⅰ转化率达到最高,继续增加酶的用量,转化率没有相应增加。2.4.4 底物浓度对宝藿苷Ⅰ转化率的影响 按质量比1∶2称取β-葡萄糖苷酶和淫羊藿苷,加入pH值为5.0的枸橼酸-枸橼酸三钠缓冲液中,配制成淫羊藿苷含量分别为10、5、3、2、1、0.5mg·mL-1的混悬液,在温度为50℃条件下酶解50min后,加入乙醇终止反应,计算宝藿苷Ⅰ的转化率(每种底物浓度各平行做3份),结果见图6。
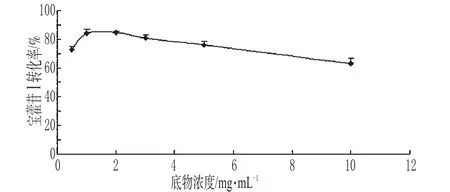
图6 底物浓度对宝霍苷Ⅰ转化率的影响(n=3)Fig 6 Effect of substract concentration on the biotransformation of baohuosideⅠ(n=3)
由图6可知,底物浓度为1mg·mL-1时转化率最高,较高和较低浓度时底物的转化率均降低。
2.4.5 反应时间对宝藿苷Ⅰ转化率的影响 按质量比1∶2称取β-葡萄糖苷酶和淫羊藿苷,加入pH值为5.0的枸橼酸-枸橼酸三钠缓冲液中,配制成淫羊藿苷含量为1mg·mL-1的混悬液,在温度为50℃条件下酶解,于 30、50、60、70、80、90min取样,计算宝藿苷Ⅰ转化率(每个时间点各平行做3份),结果见图7。

图7 反应时间对宝霍苷Ⅰ转化率的影响(n=3)Fig 7 Effect of reaction time on the biotransformation of baohuosideⅠ(n=3)
由图7可以看出,在50min以内,宝藿苷Ⅰ的转化率达85.26%,随着反应时间延长,宝藿苷Ⅰ转化率也增加,到90min时宝藿苷Ⅰ的转化率基本达到100%。
3 讨论
本研究表明,β-葡萄糖苷酶、纤维素酶、柚皮苷酶均可酶解淫羊藿苷制备得到宝藿苷Ⅰ,但在12h内,β-葡萄糖苷酶水解效果最好。为了解β-葡萄糖苷酶的性质,采用淫羊藿苷为底物,在淫羊藿苷的浓度为1mg·mL-1时,考察了温度、pH、酶与底物质量比、底物浓度、反应时间对酶解反应的影响,得到优化的工艺条件为温度50℃,pH值为5.0的枸橼酸-枸橼酸三钠缓冲液,酶与底物的质量比为1∶2,底物浓度为1mg·mL-1,此条件下酶解90min时淫羊藿苷基本100%转化为宝藿苷Ⅰ。
本研究直接采用β-葡萄糖苷酶酶解淫羊藿苷制备宝藿苷Ⅰ,主要是C-7位去葡萄糖,β-葡萄糖苷酶能够选择性地切断淫羊藿C-7位的β-D-葡萄糖。本试验主要研究β-葡萄糖苷酶酶解淫羊藿苷制备宝藿苷Ⅰ的工艺,旨在为更好地了解酶的性质和宝藿苷Ⅰ的工业化制备提供参考。
[1] 陈 彦,贾晓斌,Hu Ming.Caco-2细胞单层研究淫羊藿黄酮类成分的吸收转运[J].中草药,2009,40(2):220.
[2] 金晓勇,贾晓斌,孙 娥,等.炙淫羊藿炮制过程中5种黄酮类成分变化规律研究[J].中国中药杂志,2009,34(21):2738.
[3] 王丽芳,单保恩,刘丽华,等.香加皮单体成分宝藿苷Ⅰ对食管癌细胞增殖及凋亡的影响[J].肿瘤,2009,29(2):123.
[4] Huang J,Yuan L,Wang X,et al.Icaritin and its glycosides enhance osteoblastic,but suppress osteoclastic,differentiation and activity in vitro[J].Life Sci,2007,81(10):832.
[5] 刘铁汉,王 毅,王本祥,等.淫羊藿苷的肠菌代谢研究I.肠内细菌对淫羊藿苷的代谢转化[J].中草药,2000,31(11):834.
[6] 王 敏,高锦明,王 军,等.苦荞茎叶粉中总黄酮酶法提取工艺研究[J].中草药,2006,37(11):1645.
[7] 蔡 华,杨光义,叶 方,等.正交试验优选房陵丹参水溶性成分半仿生-纤维素酶提取工艺[J].中国药房,2011,22(3):222.
Preparation Technology of Baohuoside Ⅰ by Enzymolysis of Icariin with β-glucosidase
ZHANG Zhen-hai,CHEN Ling-ling,JIA Xiao-bin,HE Jun-jie,JIN Xin(Key Laboratory of New Drug Delivery System of Chinese Materia Medica,SACTM,Jiangsu Provincial Academy of Traditional Chinese Medicine,Nanjing 210028,China)
OBJECTIVE:To study the preparation technology of baohuoside Ⅰ by enzymolysis of icariin with β-glucosidase.METHODS:Taking bioconversion rate as index,β-glucosidase was used for enzymolysis of icariin and the effects of temperature,pH value,the ratio of enzyme to substrate,substrate concentration and reaction time on conversion rate of baohuosideⅠ were investigated by single factor test.RESULTS:The optimum reaction conditions were determined as follows:50℃,citric acid-citric acid sodium acetate buffer(pH 5.0),the ratio of enzyme to substrate 1∶2,substrate concentration 1mg·mL-1and reaction time 90min.CONCLUSION:It is simple and reliable to prepare baohuoside Ⅰ by the enzymolysis of icariin with β-glucosidase;the conversion rate is high and the technology is moderate.
Icariin;BaohuosideⅠ;β-glucosidase;Bioconversion
R284;R283
A
1001-0408(2011)43-4059-03
Δ国家自然科学基金资助项目(30973944)
*助理研究员,博士。研究方向:天然药物。电话:025-85608672。E-mail:davidpharm@yahoo.cn
#通讯作者:研究员,博士研究生导师。研究方向:天然药物。电话:025-85608672。E-mail:jxiaobin2005@hotmail.com
2011-07-03
2011-08-19)

