红花寄生叶3种溶剂提取物清除自由基活性
赖京菁,陈炳华,连俊蕊,周冰洁,肖义军
福建师范大学生命科学学院,福州350108
红花寄生叶3种溶剂提取物清除自由基活性
赖京菁,陈炳华*,连俊蕊,周冰洁,肖义军
福建师范大学生命科学学院,福州350108
采用4种方法测定了红花寄生(寄主桑树)叶的水、80%甲醇和80%丙酮提取物对自由基的清除活性,以芦丁和BHT为对照品。结果表明,3种提取物均具有较强的自由基清除能力,且表现出不同程度的量效依赖关系;在3种溶剂提取物中,80%甲醇提取物清除·OH和O-·2活性最强,半清除率浓度ρ(SC50)分别为0.212、0.139 mg/mL,而80%丙酮提取物则清除DPPH·和ABTS·+活性最强,ρ(SC50)分别为0.198、0.580 mg/mL。此外,3种溶剂提取物经酸水解后,HPLC均检出槲皮素和山奈酚等2种黄酮醇苷元,其含量范围分别为39.90~73.03 mg/g、4.82~9.19 mg/g间。可见,槲皮素及其苷类衍生物是红花寄生清除自由基活性的主要作用成分。关键词:红花寄生叶;溶剂提取物;自由基清除活性;槲皮素衍生物
红花寄生(Scurrula parasitica L.)是桑寄生科半寄生性灌木。其寄主较为广泛,已记录的寄主树种有桑树(Morus alba)、女贞(Ligustrum lucidum)、长梗柳(Salix dunnii)、夹竹桃(Nerium indicum)等[1]。红花寄生可代桑寄生(Taxillus chinensis)入药,用于治疗风湿痹痛、腰膝酸软、胎动不安、高血压等症[2]。前期研究显示,红花寄生提取物具有一定的抗癌活性,且活性高低与其寄主有关,其中夹竹桃和桑树上寄生的红花寄生总黄酮提取物对人白血病细胞株HL-60增殖的抑制效果较强,作用48 h的IC50值分别0.60 mg/L和2.49 mg/L[2];来源于夹竹桃上的红花寄生抗肿瘤活性最强,可能与其含有夹竹桃毒苷有关[3]。而抗氧化活性方面,作者研究发现长梗柳上寄生的红花寄生提取物具有一定的清除DPPH·和ABTS·+自由基的能力,且活性的高低与其酚类物质含量相关[4]。然而,对于寄主植物来源广泛的红花寄生,如福州地区野外调查显示就有30余种植物,它们是否具有相似的抗氧化活性,或是否与其抗肿瘤活性一样受寄主来源的影响较大?尤其是对于具有较强抗肿瘤活性,寄生于夹竹桃、桑树上的红花寄生,其自由基清除活性未见报道。
溶剂提取法是提取植物有效成分常用的方法,但没有单一的试剂能把不同极性和溶解性的抗氧化物质提取出来,而醇水溶液则是酚性物质的常用提取剂[5]。本实验以寄生于桑树上的红花寄生叶为材料,采用水、80%甲醇和80%丙酮为溶剂,制备了红花寄生3种不同溶剂提取物,采用了4种自由基评价体系(包括O–·2、·OH、DPPH·和ABTS·+)对上述3种不同溶剂提取物进行了检测,目的是在于评价红花寄生(桑树寄生)叶提取物的自由基清除活性,进而比较3种溶剂提取间自由基清除活性及其作用成分的差异,旨在探讨红花寄生自由基清除活性与其黄酮含量之间的相关性,为红花寄生作为抗氧化药物的基础研究提供科学依据。
1 材料与方法
1.1 材料与仪器
1.1.1 实验材料
红花寄生叶采自福州市仓山区,寄主为桑树Morus alba。取其叶,除杂、洗净后,经80℃烘干、粉碎后过60目筛,存于4℃冰箱中备用。
1.1.2 试剂和药品
1,1-二苯基苦基苯肼(1,1-diphenyl-2-picrylhydrazy1,DPPH)、罗丹明B(Rhodamine B)均为美国Sigma公司产品;吩嗪硫酸甲酯(Phenazin methosulfate,PMS)、2,2'-联氮-双(3-乙基苯噻唑啉-6-磺酸)(2,2'-azino-bis(3-ethylbenzthiazoline-6-sulfpnic acid),ABTS)为Fluka公司产品;还原性辅酶Ⅱ钠盐(Reduced β-nicotinamide adenine dinucleotide,NADH)购自Roche Diagnostics公司;硝基四氮唑蓝(Nitroblue tetrazolium,NBT)购自Amresco公司;槲皮素和山奈酚购自中国药品生物制品检定所(编号分别为100081-200406和110861-200405);芦丁、2,6-二叔丁基-4-甲基苯酚(BHT)等,均为国产分析纯。
1.1.3 主要仪器
Ultra-spec2100 pro紫外可见光分光度计(美国Amersham Biosciences公司)、HP Agilent 1100型高效液相色谱仪(美国安捷伦科技有限公司)、F-4600型荧光分光光度计(日本日立公司)、VC750型超声波细胞破碎仪(美国 Sonics&Materials公司)、RE52CS-1旋转蒸发器(上海亚荣生化仪器公司)、Heto LyoLab3000冷冻干燥机(丹麦Heto-Holten公司)等。
1.2 方法
1.2.1 不同溶剂提取物制备
以去除叶绿素的红花寄生叶为材料,分别以高纯水、80%甲醇和80%丙酮为提取剂,制备水提取物、80%甲醇和80%丙酮提取物,具体做法参照文献[4]。贮于-20℃冰箱中备用。
1.2.2 自由基清除活性的测定
1.2.2.1 羟自由基(·OH)清除能力
参照Liang等[6]等的方法。以Fenton反应产生·OH,在试管中依次加入0.1 mL样液、0.02 mol/L HCl-NaAc缓冲液(pH4.95)1 mL、5.02 mmol/L Fe-SO40.1 mL、20 mmol/L KI 0.2 mL、0.1 mmol/L罗丹明B 0.6 mL、水2.85 mL和43.2 mmol/L H2O2溶液50 μL,快速摇匀,室温静置5 min后,在激发波长358 nm条件下同步扫描其荧光发射光谱,并记录发射波长575 nm处的荧光强度Fs。空白管以0.1 mL水代替样液,测得体系中荧光强度为F0,对照管以0.1 mL水代替样液,50 μL水代替H2O2溶液,测得体系中荧光强度为F。
样品对羟自由基的清除率%=100×(Fs-F0)/(F-F0)
1.2.2.2 超氧阴离子自由基(O–·2)清除能力
参考Wang等[7]的方法,略有改进。反应体系总体积为3 mL16 mmol/L,pH=8.0的Tris-HC1缓冲液,其中内含78 μmol/L NADH、50 μmol/L NBT、10 μmol/L PMS、以及不同质量浓度的样液,其中PMS最后加入体系以引发反应。25℃温浴中反应5 min后,用分光光度计于560 nm波长处测定反应液的吸光度As。空白管Ab不加用PMS,用Tris-HC1缓冲液代替,对照管Ac用Tris-HC1缓冲液代替样品液。
样品对超氧阴离子自由基的清除率%=(1-(As-Ab)/Ac)
1.2.2.3 有机自由基DPPH·清除能力
参照Kim等[8]的方法,略有改进。取0.1 mL样液或对照品于试管中,加入100 μmol/L DPPH甲醇液1.9 mL,漩涡摇匀,室温静置20 min后,于517 nm处测定反应液的吸光度As;对照管以0.1mL甲醇代替样液为Ac;空白管以1.9 mL甲醇代替DPPH甲醇液为Ab。
样品对DPPH·的清除率%=100×[1-(As-Ab)/Ac]
1.2.2.4 ABTS·+清除能力
参照Ozgen等[9]的方法,略有改进。由5 mL 7 mmol/L ABTS和88 μL 140 mmol/L K2S2O8混合,在恒温(30℃)、避光条件下静置约16 h,制成ABTS·+储备液。使用前用20 mmol/L醋酸钠缓冲液(pH 4.5)稀释成ABTS·+工作液,要求在30℃、734 nm波长下的吸光度为0.70±0.02。测定时,取30 μL的样液于试管中,加入3 mL ABTS·+工作液,混合10 s,30℃静置6 min,以醋酸钠缓冲液调零在734 nm波长下读取吸光度。
以自由基清除率为50%时样品的质量浓度ρ(SC50),被用作比较样品间自由基清除能力的差异。ρ(SC50)值越小,表明样品清除自由基的能力越强。
1.2.3 作用成分分析
总黄酮含量采用 A1Cl3显色法,具体参照文献[10]。槲皮素、山奈酚含量采用 RP-HPLC法测定[11],色谱柱:Hypersil ODS(4.6×250 μm,5 μm);检测波长360 nm;移动相:甲醇-0.4%磷酸(体积比55∶45);流速1.0 mL/min;柱温36℃;进样量20 μL。样品处理采用酸水解法[12],取0.02 g提取物,用20 mL 60%甲醇溶解,加入3 mL体积分数25% HCl,于90℃恒温水浴1.5 h后,冷却定容至50 mL,0.45 μm滤膜过滤后,进样。
1.2.4 数据分析
实验数据用means±SD(n≥3)表示,采用SPSS v 16.0软件进行数据统计和分析,并进行差异显著性分析。
2 结果与分析
3种溶剂制备的红花寄生叶提取物得率为12.98%~26.68%间(见表2),其中以水为溶剂的得率最高,达26.68%,80%甲醇次之,80%丙酮最低,仅12.98%,三者间差异显著(P<0.05)。
2.1 ·OH清除能力
·OH是氧化能力最强的自由基。目前,离体检测·OH较为可靠的方法有荧光法[6]、电子自旋共振法等,文中采用荧光法结果见图1。图1表明红花寄生不同溶剂提取物对·OH均有一定的清除作用,且效果随质量浓度的增大而增强,当达到一定浓度时,清除率趋于稳定,最大清除率维持在80%左右。在一定质量浓度范围内,水、80%甲醇和80%丙酮提取物对·OH的清除率(y)与浓度(x)间均具有显著的量效关系,其相关系数 R2分别为0.9762(y=156.93x-10.156,0.1~0.6 mg/mL)、0.9395(y=192.12x+9.3349,0.05~0.40 mg/ mL)、0.9812(y=195.61x+2.3199,0.05~0.40 mg/mL)。从提取物对·OH的半数清除浓度ρ(SC50)比较看(见表1),清除·OH大小顺序为:芦丁>80%甲醇提取物>80%丙酮提取物>水提取物,其中80%甲醇和80%丙酮提取物具有较强的·OH清除能力,且活性相近。
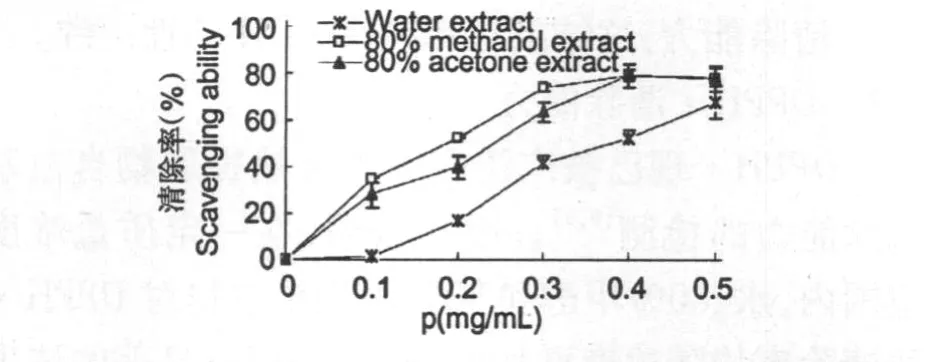
图1 红花寄生不同溶剂提取物对·OH的清除率Fig.1 Savenging ability of various solvent extracts from Scurrula parasitica leaves on hydroxyl radicals
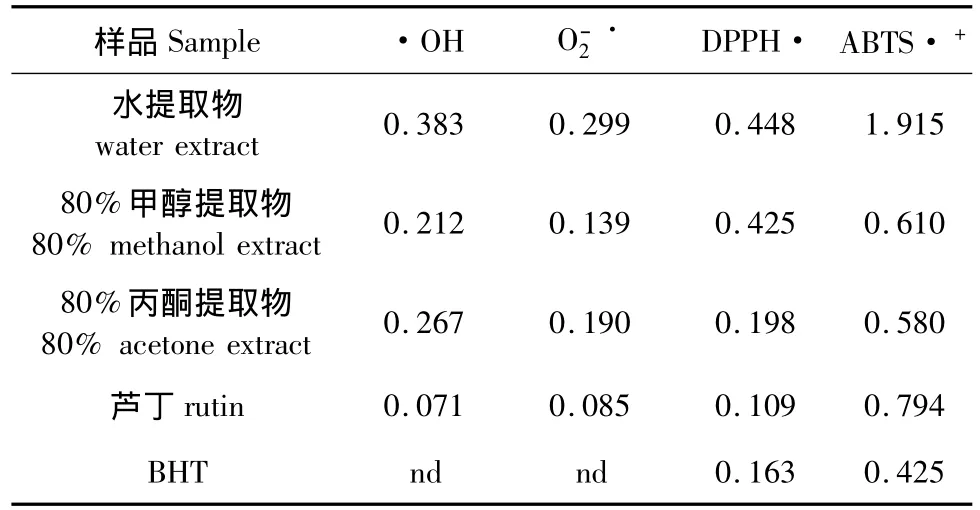
表1 红花寄生叶不同溶剂提取物和对照品的ρ(SC50)值比较1)Table 1 SC50value(mg/mL)of different solvent extracts from Scurrula parasitica leaves,rutin and BHT1)

图2 红花寄生叶不同溶剂提取物对O-·2 的清除率Fig.2 Scavenging ability of various solvent extracts from Scurrula parasitica leaves on superoxide anion radicals
采用PMS/NADH-NBT体系,测定了红花寄生不同提取物对超氧阴离子自由基清除能力,结果用对的清除率表示(图2)。3种提取物均具有清除活性,清除率随浓度的升高而增强,在一定浓度范围内(0.05~0.40 mg/mL)内,浓度的对数与清除率相关性明显,相关系数R2分别为0.9827、0.9781和0.9816。从提取物对的半数清除浓度ρ(SC50)比较看(见表1),清除大小顺序为:芦丁>80%甲醇提取物>80%丙酮提取物>水提取物,其中80%甲醇和80%丙酮提取物具有较强的清除能力,这结果与其清除·OH活性一致。
2.3 DPPH·清除能力
DPPH·现已被广泛应用于天然提取物自由基清除能力的检测[8,9]。图3表明,在一定质量浓度范围内,水、80%甲醇和80%丙酮提取物对DPPH·的清除率均随浓度增加而增大,表现出显著的浓度依赖型,且DPPH·清除率(y)与浓度(x)间均存在良好的线性关系,其相关系数R2分别为0.9879(y =101.93x+4.3304,0.1~0.8 mg/mL)、0.9822(y =107.53x+4.3514,0.1~0.8 mg/mL)、0.9913(y =202.54x+9.8026,0.05~0.4 mg/mL)。
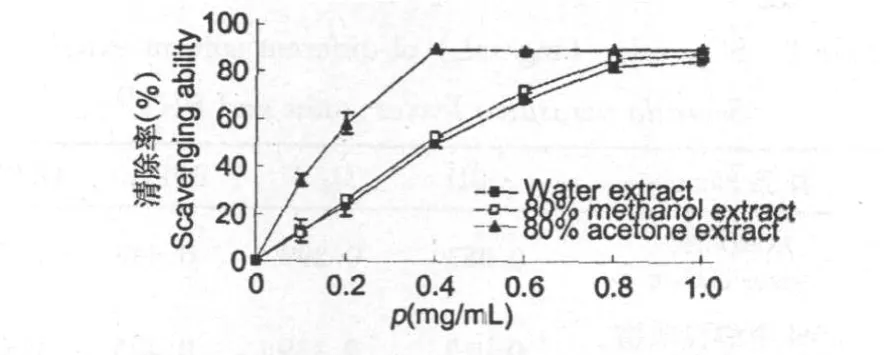
图3 红花寄生叶不同溶剂提取物对DPPH·的清除率Fig.3 Scavenging ability of various solvent extracts from Scurrula parasitica leaves on DPPH radicals
从提取物对DPPH·的半数清除浓度ρ(SC50)比较看(见表1),80%丙酮提取物ρ(SC50)值(0.198 mg/ mL)最小,说明其对DPPH·的清除能力最强,这结果与其清除·OH、O–·2不完全一致;3种提取物和对照品对DPPH·的清除能力大小顺序为:芦丁>BHT>80%丙酮提取物>80%甲醇提取物>水提取物(见表1)。
2.4 ABTS·+清除能力
ABTS·+是另一种人工合成的自由基,具有比DPPH·更多的用途,主要因为ABTS·+体系可用来评价极性和非极性样品的清除能力,且检测的波长较长(734 nm),避免了其他物质的干扰[9]。为此,有必要进一步用此法评价对ABTS·+的清除能力。
不同质量浓度的红花寄生叶提取物对ABTS ·+的清除率见图4。图4表明,3种溶剂提取物对ABTS·+清除率均随浓度的增大而增大,当质量深度为1.5 mg/mL时,80%丙酮和80%甲醇提取物的清除率均已接近最大,约为93%。统计分析表明,在质量浓度(0.1~1.0 mg/mL)范围内,两者对ABTS·+清除率(y)和浓度(x)间线性关系明显,相关系数 R2分别为 0.9963(y=81.289x+ 2.8716)、0.9869(y=83.867x-1.1921)。而水提取物对ABTS·+清除率在最大检测ρ(2.0 mg/mL)时,清除率仅为53%,未达到最大值,显示水提取物的自由基清除率较弱。
从提取物对ABTS·+的半数清除浓度ρ(SC50)比较看(见表1),3种溶剂提取物及对照品的清除ABTS·+能力大小顺序为:BHT>80%丙酮提取物>80%甲醇提取物>芦丁>水提取物(见表1),这结果与其清除DPPH自由基的能力不完全一致。可见,除黄酮类(如槲皮素苷类)外,还有大分子酚性成分的协同作用[13]。类似的结果在榕属植物提取物清除ABTS·+能力[14]已有报道。
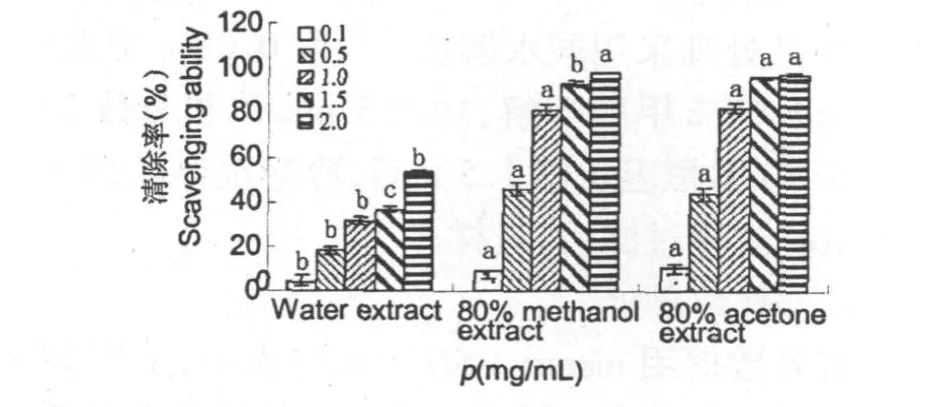
图4 红花寄生叶不同溶剂提取物清除ABTS·+能力Fig.4 Scavenging ability of various solvent extracts from Scurrula parasitica leaves on ABTS radicals
2.5 作用成分分析
红花寄生黄酮类物质含量丰富,不少研究显示[5,12,15],提取物中黄酮类物质的含量与其抗氧化活性呈显著正相关,红花寄生叶不同溶剂提取物的黄酮含量见表2。
表2表明,红花寄生80%丙酮提取物中总黄酮含量最高,达111.96 mg/g,80%甲醇提取物其次,水提取物最低,且不同提取物间总黄酮含量的差异显著(P<0.05)。可见,80%丙酮是提取红花寄生抗氧化物质的有效溶剂。依据HPLC结果,在红花寄生叶水、80%甲醇及80%丙酮提取物的水解液(见图5)中均检出槲皮素和山奈酚2种黄酮醇苷元,其含量范围分别为39.90~73.03 mg/g、4.82~9.19 mg/g间,其中槲皮素约占全部苷元的90%(表2)。由此推定提取物中黄酮类物质主要是槲皮素及其苷类衍生物。而槲皮素、山奈酚及其苷类衍生物在结构中含活泼的酚羟基,具有很强的抗氧化活性。
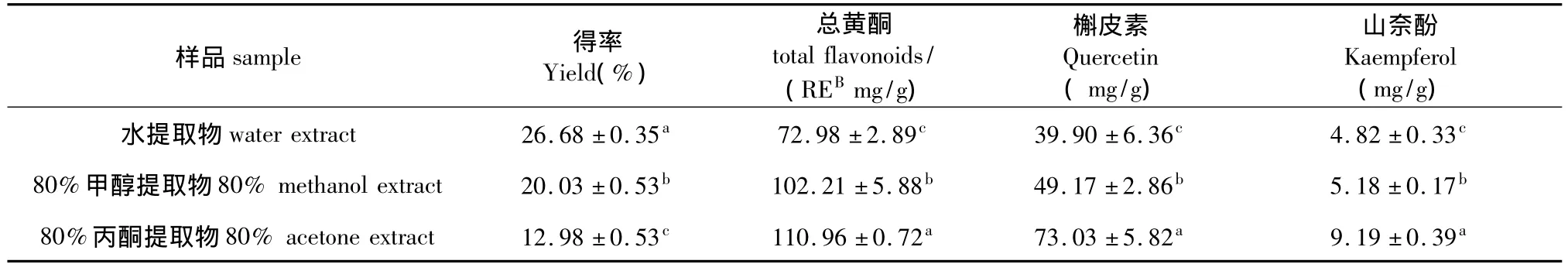
表2 红花寄生叶不同溶剂提取物的得率及其黄酮含量Table 2 Extract yield and flavonoids contents of different solvent extracts from Scurrula parasitica leaves(mg/g of extract,dry matter basis)
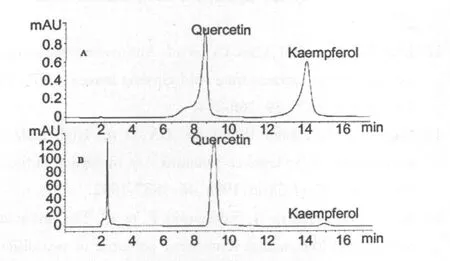
图5 红花寄生叶80%丙酮提取物水解液(B)及标准黄酮(A)的HPLC谱图Fig.5 HPLC chromatograms of acid hydrolysed 80%acetone extract from Scurrula parasitica leaves(B) and standard flavonoid(A)at 360 nm.
3 讨论与结论
溶剂提取法是制备植物有效成分常用的方法,用不同极性提取剂制备红花寄生叶提取物,并开展不同提取物间自由基清除活性及其作用成分比较分析,有助于制备提取物最佳提取剂的选择。本文实验结果表明不同提取剂对红花寄生提取物中总黄酮质量分数及其自由基清除活性影响显著,就提取物中总黄酮,尤其是槲皮素质量分数而言,以体积分数80%丙酮为提取剂获得的提取物最高,分别达110.96 mg/g和73.03 mg/g;在4种不同自由基体系中,红花寄生溶剂提取物的自由基清除活性,也以80%甲醇和80%丙酮为溶剂获得的提取物显著高于以水为溶剂制备的提取物。由此可见,醇水溶液(80%甲醇或80%丙酮)是提取红花寄生抗氧化物质的合适溶剂,这一结果与其他材料(如榕属植物[14]、桑叶[5])等得到的结果一致。
在清除氧自由基(·OH和O2–·)和有机自由基(DPPH·和ABTS·+)具体活性方面,80%甲醇提取物和80%丙酮提取物又表现出明显的差异。在氧自由基体系中,80%甲醇提取物清除·OH和能力最强,其半清除率浓度ρ(SC50)分别为0.212 mg/mL和0.139 mg/mL,而在人工自由基体系中,80%丙酮提取物的活性最强,其清除DPPH·和ABTS·+的半清除率质量浓度ρ(SC50)分别为0.198、0.580 mg/mL。如果将自由基清除能力与其所含的黄酮质量分数进行比较,发现3种溶剂提取物中总黄酮质量分数高低,尤其是槲皮素质量分数与其有机自由基(DPPH·和ABTS·+)清除能力强弱相关,槲皮素质量分数高,其DPPH·和ABTS·+清除能力也强,这结论得到其它材料[12]的证实;但对于·OH、清除能力却不完全一致,80%甲醇提取物清除·OH和能力最强,说明除黄酮外,还有其他酚类物质等组成一个抗氧化体系起协同或颉颃作用。不同的溶剂对红花寄生中抗氧化物质的提取具有选择性,且不同提取物中抗氧化物质的量有所差异,最终表现在自由基清除能力的强弱上。
红花寄生叶中黄酮等酚性次生代谢产物,尤其是以槲皮素和山奈酚等为苷元的黄酮醇类物质含量丰富。由此推定,槲皮素及其苷类衍生物是红花寄生抗氧化作用主要成分,而对于其活性成分本质的纯化和抗氧化机理的研究正在进行中。
1 Qiu HX,Michael G Gilbert.Flora of China,Loranthaceae 5.Beijing:Science Press,2003.220-239.
2 Xiao YJ(肖义军),Chen YZ(陈元仲),Chen BH(陈炳华),et al.Study on cytotoxic activities on human leukemia cell line HL-60 by flavonoids extracts of Scurrula parasitica from four different host trees.China J Chin Mater Med(中国中药杂志),2008,33:427-432.
3 Xiao YJ(肖义军),Chen YZ(陈元仲),Chen BH(陈炳华),et al.Nispex inhibits myeloid leukemia cell HL-60 growth in vitro and in mice.Chin Oncol(中国癌症杂志),2007,17:461-465.
4 Lai JJ(赖京菁),Chen BH(陈炳华),Lian JR(连俊蕊),et al.Polyphenol contents and antioxidant activity of various solvent extracts from Scurrula parasitica leaves.Subtrop Plant Sci(亚热带植物科学),2008,38(3):38-42.
5 Saeedeh AD,Asna U.Antioxidant properties of various solvent extracts of mulberry(Morus indica L.)leaves.Food Chem,2007,102:1233-1240.
6 Liang AH,Zhou SM,Jiang ZL.A simple and sensitive resonance scattering spectral method for determination of hydroxyl radical in Fenton system using rhodamine S and its application to screening the antioxidant.Talanta,2006,70:444-448.
7 Wang HY,Zhao MM,Yang B,et al.Identification of polyphenols in tobacco leaf and their antioxidant and antimicrobial activities.Food Chem,2008,107:1399-1406.
8 Kim D,Lee KW,Lee HJ,et al.Vitamin C equivalent antioxidant capacity(VCEAC)of phenolic phytochemicals.J Agric Food Chem,2002,50:3713-3717.
9 Ozgen M,Reese RN,Tulio JAZ,et al.Modified 2,2-Azinobis-3-ethylbenzothiazoline-6-sulfonic acid(ABTS)method to measure antioxidant capacity of selected small fruits and comparison to ferric reducing antioxidant power(FRAP)and 2,2'-Diphenyl-1-picrylhydrazyl(DPPH)methods.J Agric Food Chem,2006,54:1151-1157.
10 Lin JY,Tang CY.Determination of total phenolic and flavonoid contents in selected fruits and vegetables,as well as their stimulatory effects on mouse splenocyte proliferation.Food Chem,2007,101:140-147.
11 Ye M,Li Y,Yan YN,et al.Determination of flavonoids in Semen Cuscutae by RP-HPLC.J Pharm Biomed Anal,2002,28:621-628.
12 Jung CH,Seog HM,Choi IW,et al.Antioxidant properties of various solvent extracts from wild ginseng leaves.LWT-Food Sci Technol,2006,39:266-274.
13 Hagerman AE,Riedl KM,Jones GA,et al.High molecular weight plant polyphenolics(tannins)as biological antioxidants.J Agric Food Chem,1998,46:1887-1892.
14 Manian R,Anusuya N,Siddhuraju P,et al.The antioxidant activity and free radical scavenging potential of two different solvent extracts of Camellia sinensis(L.)O.Kuntz,Ficus bengalensis L.and Ficus racemosa L..Food Chem,2008,107:1000-1007.
Free Radical Scavenging Activities of Three Solvent Extracts from Scurrula parasitica Leaves
LAI Jing-jing,CHEN Bing-hua*,LIAN Jun-rui,ZHOU Bing-jie,XIAO Yi-jun
College of Life Sciences,Fujian Normal University,Fuzhou 350108,China
The free radical-scavenging activities of water,80%methanol and 80%acetone extracts from Scurrula parasitica leaves(parasitic on Morus alba)were determined and compared with rutin and bulylated hydroxytoluene(BHT)using four kinds of methods.The results showed that all the leaf extracts had strong free radical-scavenging capacity with varying degrees of efficacy on a dose-dependent manner.Among the three solvent extracts,the 80%methanol extract had the highest scavenging activities on·OH andwith the value of SC500.212 mg/mL and 0.139 mg/mL,respectively.The 80%acetone extract exhibited the highest scavenging activities on DPPH·and ABTS·+with the value of SC500.198 mg/mL and 0.580 mg/mL,respectively.In addition,when the solvent extracts were hydrolysed by acid,flavonol aglycones of quercetin and kaempferol were identified by HPLC in all solvent extracts with concentration ranges between 39.90~73.03 mg/g and 4.82~9.19 mg/g,respectively.Therefore,quercetin and its derivatives are the main active components accounting for the free radical-scavenging activities of Scurrula parasitica.
Scurrula parasitica leaves;solvent extracts;free radical scavenging activity;quercetin derivatives
1001-6880(2011)06-1127-06
2010-01-22 接受日期:2010-06-12
福建省大学生创新性实验计划项目(Fjnu2007-011);福建师范大学大学生课外科技项目(BKL2009-074);福建师范大学国家级生物学实验教学示范中心本科生创新性研究计划项目(2009ls007)
*通讯作者 E-mail:bhchen@fjnu.edu.cn
Q949.741.5;Q946.83;R284.2
A

