一株高效稻草纤维素降解真菌的筛选与鉴定
熊格生,刘 志,吴莎莎,卢向阳,刘如石
(1. 湖南农业大学a.科学技术师范学院,b.生物科学技术学院,中国 长沙 410128;2.湖南师范大学生命科学学院,中国 长沙 410081)
随着我国经济快速发展,能源缺口不断扩大[1],开发可再生的生物能源成为我国能源发展的大趋势[2].但是发展生物能源的关键是高效优质的纤维素酶的获得.
自从 1906 年在蜗牛消化道发现纤维素酶以来,纤维素的微生物降解问题就得到了国内外学者的很大关注[3-5].国外对纤维素酶的研究有近 40 年的历史, 里氏木酶是公认产纤维素酶最高的菌种之一[6].我国从上世纪 70 年代开始通过筛选、诱导突变、基因工程技术成功培育出众多的优良菌株, 如绿色木霉、康氏木霉, 黑曲霉等,在食品、酿造、纺织、洗涤、畜牧、造纸、环保、制药等方面均有广泛的应用[7-8].
本研究用刚果红羧甲基纤维素钠培养基法结合传统的酶活性方法,从来自长白山原始森林的腐烂枯木、落叶泥土和常年堆积木头的腐质土中分离筛选到一株高效的纤维素分解菌,然后将筛选的优质菌株进行分类,并进行酶活评估和稻草发酵试验,为今后农作物废弃物的综合利用和生物质能的发展提供可靠的实验参考.
1 实验材料与方法
1.1 材料
1.1.1 样品 采自长白山原始森林的腐烂枯木、落叶泥土和常年堆积木头的腐质土.
1.1.2 主要试剂和仪器 DNS试剂 (二硝基水杨酸试剂)、柠檬酸缓冲液、乳酸石炭酸棉蓝染色液,羧甲基纤维素(购自上海生工),新华定性滤纸(型号102,杭州新华纸业有限公司),0.125 mm孔径稻草粉的制备:将稻草秸秆切成 2~3 cm小片段,烘干后粉碎至0.125 mm孔径,不经过其他步骤处理,纤维素质量分数为40.2%.
1.1.3 培养基 (1)纤维素分解菌富集培养基:CMC-Na 5 g, NaNO31 g, Na2HPO4·12H2O 1.6 g,KH2PO40.9 g, KCl 0.5 g, MgSO4·7H2O 0.5 g,酵母浸膏 0.5 g, 蛋白胨 0.5 g, ddH2O 1 000 mL;(2)羧甲基纤维素钠培养基[9-10];(3)滤纸崩解实验培养基:蛋白胨 0.1 g,酵母浸膏1.0 g, (NH4)2SO40.4 g, K2HPO40.2 g, MgSO4·7H2O 0.01 g,1.0 g 灭菌滤纸条2条,ddH2O 100 mL;(4)滤纸筛选观察培养基:蛋白胨0.5 g,酵母浸膏0.05 g, NaCl 0.5 g,CaCO30.2 g,1.0 g 灭菌滤纸条2条,ddH2O 100 mL;(5)稻草产酶发酵培养基:0.125 mm孔径稻草粉 1.5 g, NH4NO30.1 g,KH2PO40.1 g, MgSO4·7H2O 0.05 g, ddH2O 100 mL;(6)液体产酶发酵培养基:CMC-Na 1.5 g,NH4NO30.1 g,KH2PO40.1 g,MgSO4·7H2O 0.05 g, ddH2O 100 mL.
1.2 方法
1.2.1 菌种的富集与分离 用无菌方法分别称取长白山原始森林腐烂枯木、落叶泥土和常年堆积木头的腐质土等各 5 g 分别置于 200 mL带玻璃珠的装富集培养基中的锥形瓶中,29 ℃,200 r/min,振荡培养 4 d.将样品的富集培养基上清进行稀释,取3个梯度10-4、10-5、10-6涂板于羧甲基纤维素钠培养基平板(终浓度为8 mg/L),29 ℃于恒温培养箱中倒置培养5 d 左右,根据水解圈直径与菌落直径的比值大小和水解圈清晰程度确定初筛菌株.然后将初筛的菌株划线分离,得到纯培养.
1.2.2 菌种菌落形态及生理生化特性测定 观察菌落和菌种形态特征(采用水浸片法和平板插片法观察法),并参照《真菌鉴定手册》和中国真菌志(第35卷)进行菌种鉴定.
1.2.3 菌株18S rDNA序列鉴定 总DNA的提取:称取100 mg 湿菌(滤纸吸干水分),加入2.7 mL DNA提取缓冲液(100 mmol/L Tris·HCl,100 mmol/L EDTA-Na2,100 mmol/L 磷酸盐,1.5 mol/L NaCl,1% (质量分数)CTAB,pH 8.0)和33 μL蛋白酶K(10 g/L),混匀后37 ℃ 反应0.5 h;再加入0.3 mL 20%(质量分数) SDS,65 ℃ 反应2 h;4 ℃,6 000×g离心20 min,收集上清;沉淀用上述方法重复抽提2次,将上清合并,加入与上清等体积的酚、氯仿、异戊醇混合液(v酚∶v氯仿∶v异戊醇=25∶24∶1)纯化DNA,然后用0.6倍体积的异丙醇沉淀,70%(体积分数)乙醇洗涤后将DNA重悬于200 μL TE缓冲液中.
18S rDNA PCR扩增:采用ITS1(5′-TCCGTAGGTGAACCTGCGC-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)引物扩增菌株的18S rDNA.PCR反应体系为20 μL,反应条件为:94 ℃ 4 min;94 ℃ 40 s,58 ℃ 50 s,72 ℃ 30 s,30 cycle;72 ℃ 10 min.PCR扩增产物进行测序分析,用NCBI网Blast 程序对数据库中的序列进行比较分析,然后用MEGA4.1的最大简约法(Maxiumum Parsimong)进行系统发育树的构建.
1.2.4 菌种的滤纸降解能力测定 滤纸崩解能力测定:接种200 μL 菌液于以滤纸条为唯一碳源的 50 mL 滤纸崩解实验培养基中,在29 ℃ 和 120 r/min的条件下,振荡培养 24 h,观察滤纸条崩解溃烂情况.
失重法测定纤维素分解活性:接种 5mL 菌液于 100 mL以滤纸为唯一碳源的滤纸筛选观察培养基滤纸(每组设3个重复), 29 ℃静止培养 6 d 后,7 000×g 离心,倒上清液,用盐酸和硝酸的混合液冲洗而消除菌体,离心,清水洗,离心,105 ℃ 烘干后称重,计算失重率.
1.2.5 纤维素酶活力测定[11]纤维素粗酶液的制备:用无菌生理盐水适当调节孢子悬液浓度,血细胞计数为4.8×107个/mL,然后接种1 mL孢子悬液于50 mL液体发酵产酶培养基,29 ℃ 220 r/min 条件下培养.培养液经12 000×g 离心 10 min,取上清液作为粗酶液测定酶活.
羧甲基纤维素酶(CMCase)活力测定:取适当稀释的粗酶液0.5 mL,加入到含有 1.5 mL CMC-Na柠檬酸缓冲液(pH 4.8)的血糖管中,50 ℃水浴 30 min,采用DNS法测定糖浓度的方法测定粗酶液水解CMC-Na生成葡萄糖的量来确定其酶活性.定义每分钟1 L催化底物水解生成 1 μg 葡萄糖所需的酶量为16.67 nkat.
全酶活-滤纸酶(FPase) 活力测定:将适当稀释的酶液0.5 mL,加入到50 mg折成M型的双圈滤纸和1.5 mL 0.05 mol/L pH 4.8柠檬酸缓冲液的血糖管中,轻轻摇匀,使滤纸完全浸泡在液体中,50 ℃保温 1 h,立刻按 DNS法测定糖浓度,酶活性单位定义同上.
2 结果与分析

图1 分离菌株纯培养在刚果红羧甲基纤维素钠培养平板上产生的水解圈
2.1 菌种筛选分离
将采样上清涂布于刚果红羧甲基纤维素钠培养基初筛平板上培养 5 d 后,发现有许多菌落周围产生了不同大小的水解透明圈,从形态上看有细菌、放线菌和真菌,其中细菌和放线菌的透明圈模糊,比值很小.真菌的水解圈相对较大而且清晰,其中3株丝状真菌透明圈清晰而且水解直径和菌落比值较大,确定其为产纤维素菌株,将筛选到的该菌株再以划线分离纯化,然后保存备用.其中透明圈最清晰透明的一株在刚果红羧甲基纤维素钠培养基上形成的菌落和水解圈见图1,初步表明初筛菌株具有较好的纤维素分解能力,命名为 CBS-1.
2.2 菌株的酶活性研究

图2 菌株培养24 h 的滤纸降解情况
2.2.1 滤纸崩解能力与失重率的计算 将初筛的3株产纤维素酶的菌株进行滤纸降解实验,是菌株整个纤维素酶系酶活的总体现,代表了纤维素酶的3种酶组分的协同作用.选取1张新华滤纸,将其剪成同样大小和质量的滤纸条,将滤纸条单独灭菌,采用无菌操作将灭菌滤纸转移到滤纸崩解实验培养基中, 分别接种 200 μL 3菌株菌液于以滤纸条为唯一碳源的 50 mL 滤纸崩解实验培养基中,在29 ℃和 80 r/min 的条件下轻微振荡培养,24 h 后取出冲洗拍照,CBS-1菌株对滤纸的崩解能力最强,可以明显观察到接种有CBS-1菌株的滤纸边缘被酶解,而且整个滤纸片明显分解为糊状,滤纸变得蓬松,对照组滤纸边缘和内部平整(见图2),另外两株的崩解力较弱.
滤纸失重实验按照1.2.4方法进行后,将接种CBS-1菌株的滤纸和没有接种菌株的对照滤纸7 000×g 离心,倒上清液,用盐酸/硝酸的混合液冲洗而消除滤纸片上的吸附菌体,清水洗涤后离心,105 ℃烘干至恒重后称重,按下面的公式(1)计算失重率.结果(表1)进一步说明,在刚果红CMC-Na培养平板上水解透明圈最大而且清晰、滤纸崩解能力最大的的CBS-1菌株分泌纤维素酶的能力最强,具有较好的应用潜力.

(1)
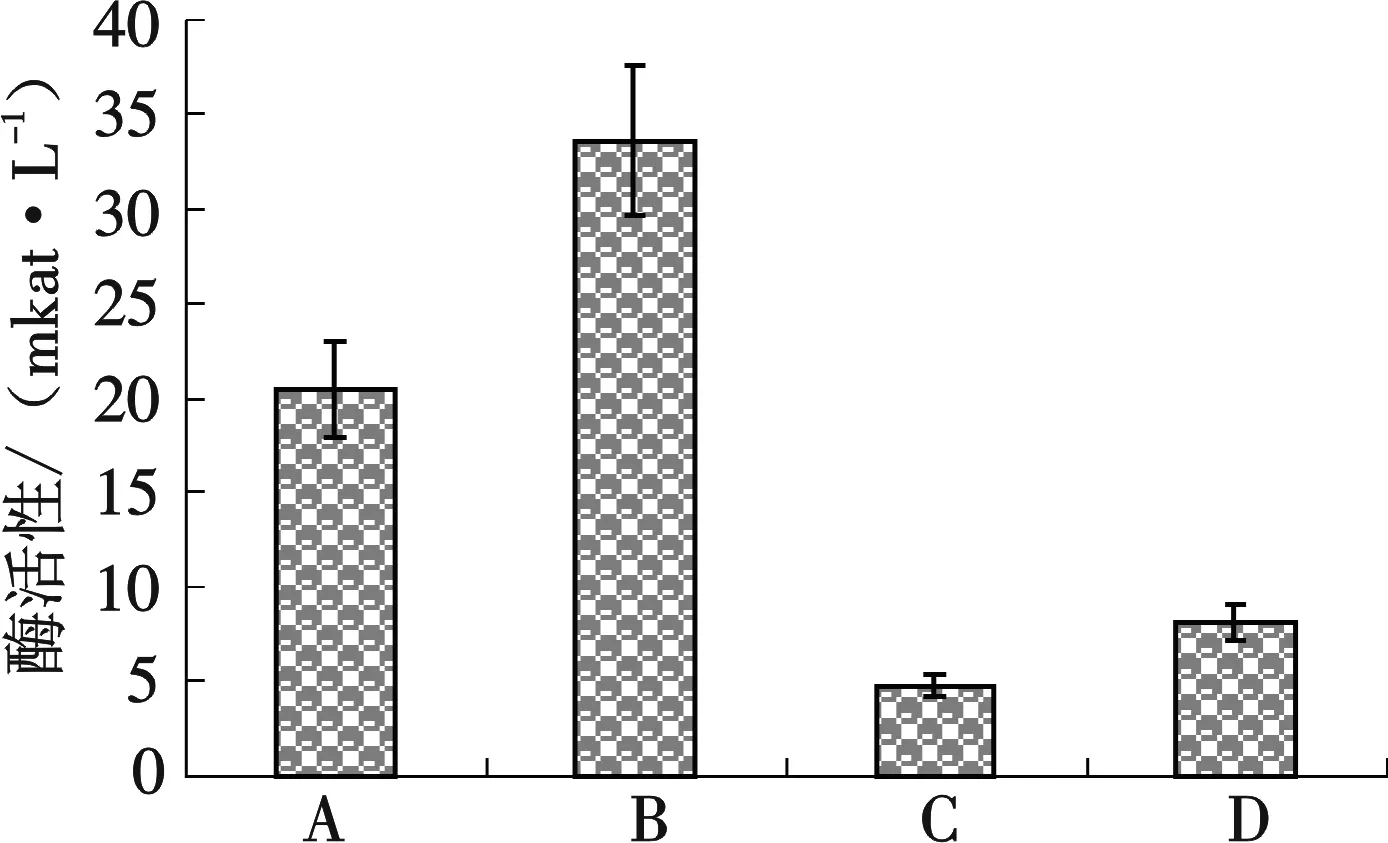
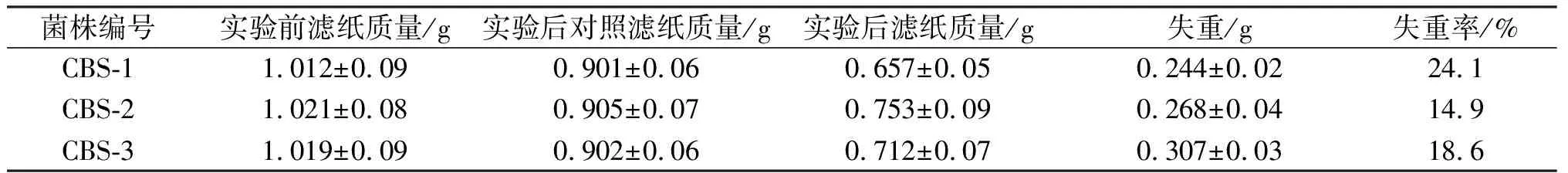
图3 菌株发酵120 h后以稻草粉和以CMC-Na为底物时的CMC酶活性和TFA酶活性(A:稻草为底物时CMC酶活性;B:CMC-Na为底物时CMC酶活性;C:稻草为底物时FPA酶活性;D:CMC-Na为底物时FPA酶活性)
2.2.2 CMC酶活和FPA酶活测定 根据标准曲线数据,得到标准葡萄糖浓度和吸光度的回归曲线方程:y=3.704 3x- 0.006 1,y为纵坐标葡萄糖含量(g/L),x为横坐标吸光度,根据吸光度计算葡萄糖的浓度,再根据葡萄糖的浓度计算CMC酶和FPA酶活性,定义在pH 4.8时 50 ℃水浴恒温 30 min下每分钟1 L催化底物水解生成 1 μg 葡萄糖所需的酶量为16.67 nkat.
分别以0.125 mm孔径稻草粉和CMC-Na为底物,28 ℃~29 ℃ 220 r/min 条件下培养 120 h 后,12 000×g 4 ℃ 离心10 min 收集粗酶液,测定的CMC酶活和FPA酶活见图3.结果说明,本实验筛选到的菌株无论是以稻草粉为底物,还是以CMC-Na为底物,该纤维素菌株产酶活性都很高,其酶活高于目前文献所报道的CMC酶活和TFA酶活,尤其是120 h 时,以0.125 mm孔径稻草粉为碳源的CMC酶活为33.6 mkat/L,且生长迅速,说明该菌对农作物秸秆的降解具有较大的应用价值.
2.3 纤维素降解菌株的鉴定
根据滤纸崩解与滤纸失重实验和酶活力测定实验,菌株CBS-1有强的纤维素降解能力,具有应用研究的潜力,因此利用菌落形态、菌丝与孢子的特性以及ITS序列进行了菌株的鉴定.结果表明菌落密毡状、蔓延、菌落反面呈淡黄色,气生菌丝初期为白色有隔菌丝,然后逐渐变为淡绿色,基内菌丝为白色;分生孢子梗直立、光滑、无足细胞,有扫帚状不对称分枝,椭圆形浅绿色分生孢子并排以扫帚状长于最后一节分生孢子梗分支上,产孢结构多轮生.根据形态《真菌鉴定手册》和中国真菌志(第35卷),初步鉴定属于青霉属.在此基础上采用引物对ITS1/ITS4扩增菌株的18S rDNA,经过上海生工测序(图4)后,将序列在NCBI网站上进行同源性比较,发现该序列与产黄青霉的同源性大于99%,再构建系统发育树(图5),遗传距离与产黄青霉最近,结合形态学特点,鉴定该菌株为产黄青霉.

图4 菌株CBS-1的18S rDNA序列
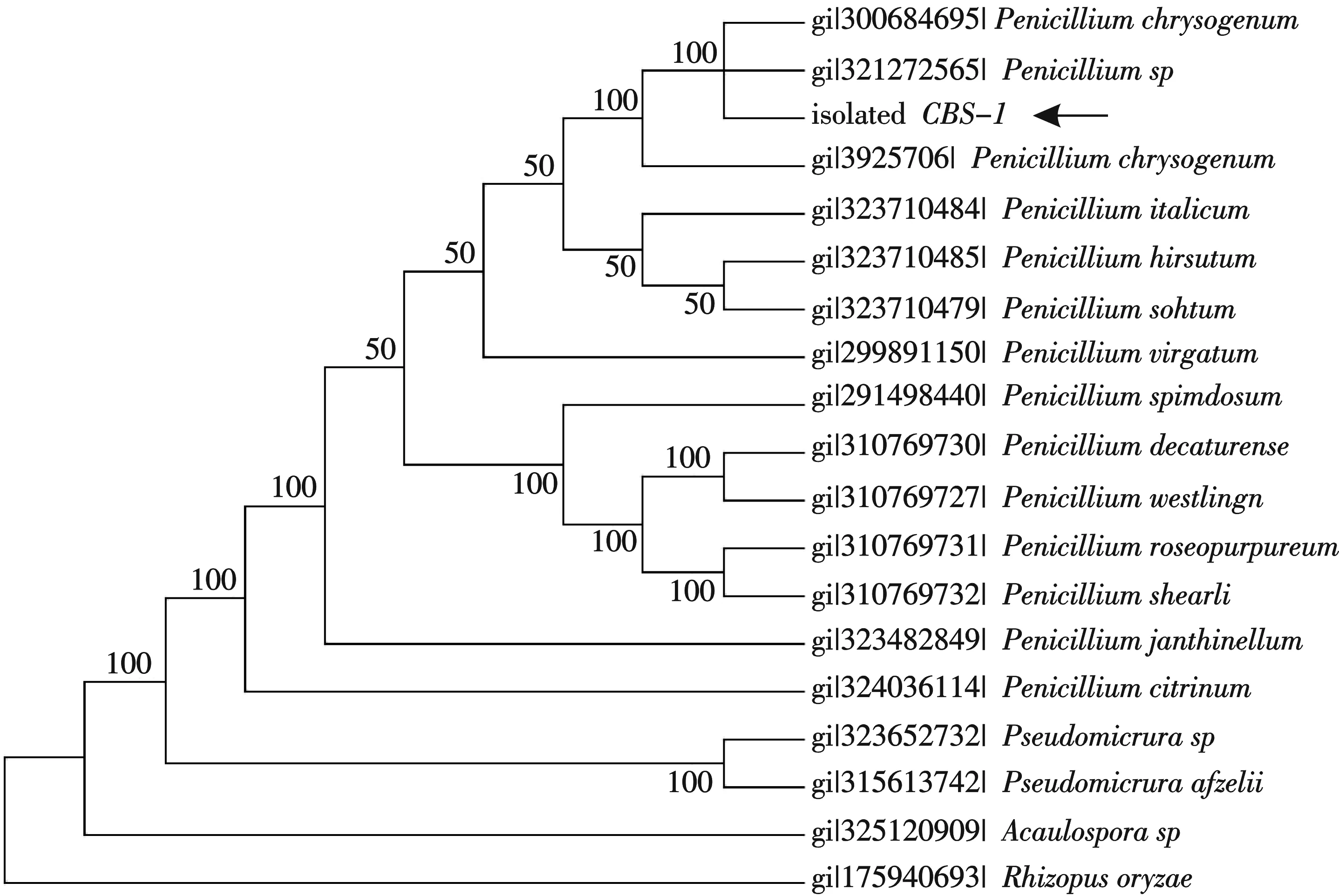
图5 菌株CBS-1的基于18S rDNA 序列同源性构建的系统发育树
3 讨论
本研究使用的分离培养基是将查氏培养基中的蔗糖改成羧甲基纤维素钠,同时在培养基上直接添加刚果红,筛选到了一株高产纤维素酶菌株,该方法可初步判定酶活性高低,是一种优于传统的筛选方法.尽管Teather和 Wood指出仅以透明圈大小作为菌株产纤维素酶活大小的唯一定量指标不可靠[12].但作者筛选的CBS-1菌株在透明圈与酶活两方面皆明显,滤纸失重率为24.1%,尤其120 h 时,以0.125 mm孔径稻草粉为碳源的CMC酶活为33.6 mkat/L,且生长迅速,说明该菌株以稻草作为唯一碳源时,具有较好的产纤维素酶活性,而且转化效率高.从产酶的监控过程来看,该菌株酶活值基本上呈随时间推移而上升的趋势,可能其产酶属于生长偶联型的,具有潜在的开发应用价值.因而,菌株CBS-1是本研究获得的纤维素酶活力最高的菌株,明显高于许多已经报道的菌株[9,11,13-14].为进一步提高纤维素酶活力,本研究室还将对分离的高产纤维素酶菌株CBS-1进行人工诱变,以期望获得更加高产纤维素酶的菌种,实现纤维素物质的高效转化.
作者结合形态学和现代分子生物学技术对CBS-1菌株进行了鉴定,并构建了系统发育树,认为该菌株为产黄青霉.这为今后进一步优化其产酶条件,或对其进行人工诱变提高酶活打下了一定的基础;还可以利用该优良菌株研究混菌发酵制备高催化活性的纤维素酶,为生物再生能源的开发应用和科学研究提供参考依据.
参考文献:
[1] 石元春.生物质能源主导论[J].科学时报,2010, 5094:1.
[2] 李 涛,卓海峰,王文富,等. 探讨秸秆焚烧的危害与秸秆的综合利用[J].科技信息,2008(20):35-37.
[3] HESS M, SCZYRBA A, EGAN R,etal. Metagenomic discovery of biomass-degrading genes and genomes from cow rumen[J]. Science, 2011,331(6016):463-467.
[4] PRASETYO J, ZHU J, KATO T,etal. Efficient production of cellulase in the culture of Acremonium cellulolyticus using untreated waste paper sludge[J]. Biotechnol Prog, 2011, 27(1):104-110.
[5] BHAT M K. Cellulases and related enzymes in biotechnology[J]. Biotechnol Adv,2000,18(5):355-383.
[6] AHAMED A, VERMETTE P. Culture-based strategies to enhance cellulase enzyme production from Trichoderma reesei RUT-C30 in bioreactor culture conditions[J].Biochem Eng J,2008,40(3): 399-407.
[7] 邱雁临. 纤维素酶的研究和应用前景[J]. 粮食与饲料工业, 2001(8):30-31.
[8] 张 超,李艳宾,张 磊,等. 纤维素―刚果红培养基鉴定产纤维素酶真菌的机理研究[J]. 纤维素科学与技术,2007, 15(2): 39-42.
[9] PETR BALDRIAN V V K. Degradation of cellulose by basidiomycetous fungi[J]. FEMS Microbiol Rev,2008,32(3): 501-521.
[10] SUKUMARAN R K, SINGHANIA R R, MATHEW G M,etal. Cellulase production using biomass feed stock and its application in lignocellulose saccharification for bio-ethanol production[J]. Renew Energ, 2009, 34(2): 421-424.
[11] 石贤爱,刘 月,陈 飞,等. 长梗木霉纤维素酶基因的克隆及序列分析[J]. 微生物学通报,2010, 37(5): 671-676.
[12] TEATHER R D, WOOD P J. Use of congo red-ploysaccharide interaction in enumeration and characterization of cellulolytic bacteria from the bovine rumen[J]. Appl Environ Microb, 1982, 43(4): 777-780.
[13] JORGENSEN H, MORKEBERG A, KROGH K B R,etal. Production of cellulases and hemicellulases by three Penicillium species: Effect of substrate and evaluation of cellulose adsorption by capillary electrophoresis[J]. Enzyme Microb Technol,2005,36(1): 42-48.
[14] WYK V J P H, MOHULATSI M. Biodegradation of wastepaper by cellulase from Trichoderma viride[J]. Bioresour Technol, 2003, 86(1): 21-23.

