多酚姜黄素类似物的一步合成*
杜志云, 涂增清, 张 焜, 莫容清, 汤志恺
(广东工业大学 轻工化工学院,广东 广州 510006)
姜黄素(Chart 1)是传统中药姜黄的主要活性成分,具有抗氧化、抗炎、抗病毒、抗癌等生物活性[1~3]。近年来以姜黄素为先导,根据靶向不同的生物靶点设计合成了大量姜黄素衍生物,并对其构效关系进行研究,发现其活性与苯环上的取代基(尤其是酚羟基)密切相关,在苯环上引入羟基能不同程度地改善生物活性[4,5]。由于酚羟基很不稳定,在碱性及强酸性环境中易被氧化成醌,因此要在姜黄素中引入羟基比较困难。
姜黄素类似物的合成为醛酮缩合反应,主要合成方法有: (1)加热条件下,以胺为催化剂,采用酸化法[6]; (2)室温下或者加热(50 ℃~65 ℃),稀碱溶液为催化剂,采用酸化法[7]; (3)以硫酸、盐酸及三氯化铝等Lewis酸为催化剂,采用直接合成法[8,9]。方法(1)存在操作复杂、反应时间长、酚羟基不稳定等缺点;方法(2)仅适用不含多酚羟基的芳香醛,对含两个或两个以上羟基的芳香醛需要先将酚羟基保护起来,反应完成后再脱保护,操作麻烦且产率不高[10,11];方法(3)适用含酚羟基芳香醛与酮直接反应。
Chart1
本文以方法(3)[8,9]为基础,在酸性条件下,含酚羟基的芳香醛(1a~1d)分别与丙酮,环戊酮或环己酮发生醛酮缩合反应,合成了12个多酚姜黄素类似物(2a~4d, Scheme 1),产率62%~98%,其结构经1H NMR, MS, IR和元素分析表征。
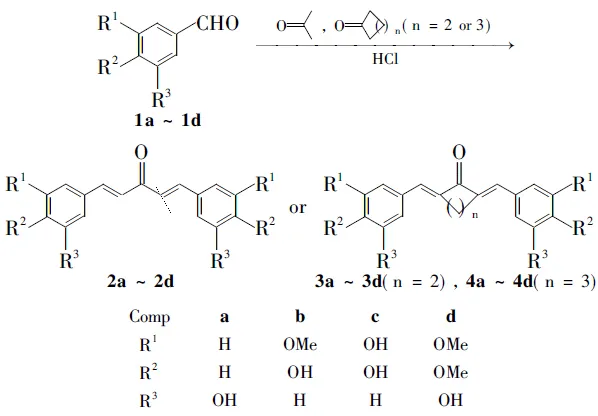
Scheme1
该方法操作简便、成本低、收率高,具有良好的应用前景。
1 实验部分
1.1 仪器与试剂
双目镜X-6型显微熔点仪(温度未校正);Varian Unity INOVA 300型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Bruker EQUINOXSS型红外光谱仪(KBr); LCMS-2010A型质谱仪;Varian EI Ⅲ型元素分析仪。
1,分析纯,Sigma公司;其余所用试剂均为分析纯。
1.2 合成通法
在圆底烧瓶中加入110 mmol,酮5 mmol,用少量无水乙醇(或THF)溶解,冰水浴冷却,搅拌下缓慢滴加浓盐酸0.1 mL(6 D·min-1),滴毕,于室温(25 ℃~30 ℃)反应30 min;静置2 d(TLC跟踪)。加水20 mL,过滤,滤饼经洗涤、重结晶、真空干燥得2。
用类似方法合成3和4,结果见表1。
1,5-双(4-羟基苯基)-1,4-戊二烯-3-酮(2a)(用冰水洗涤,乙醇重结晶):1H NMRδ: 10.01(br, 2H, OH), 7.64(d,J=16 Hz, 2H, =CH), 7.60(d,J=8.1 Hz, 4H, ArH), 7.08(d,J=16 Hz, 2H, =CH), 6.82(d,J=8.1 Hz, 4H, ArH); IRν: 3 318, 1 592, 1 510, 1 439, 1 356,1 226, 1 167, 1 114 cm-1; ESI-MSm/z: 265{[M-1]-}; Anal.calcd for C17H14O3: C 76.68, H 5.30; found C 76.56, H 5.23。
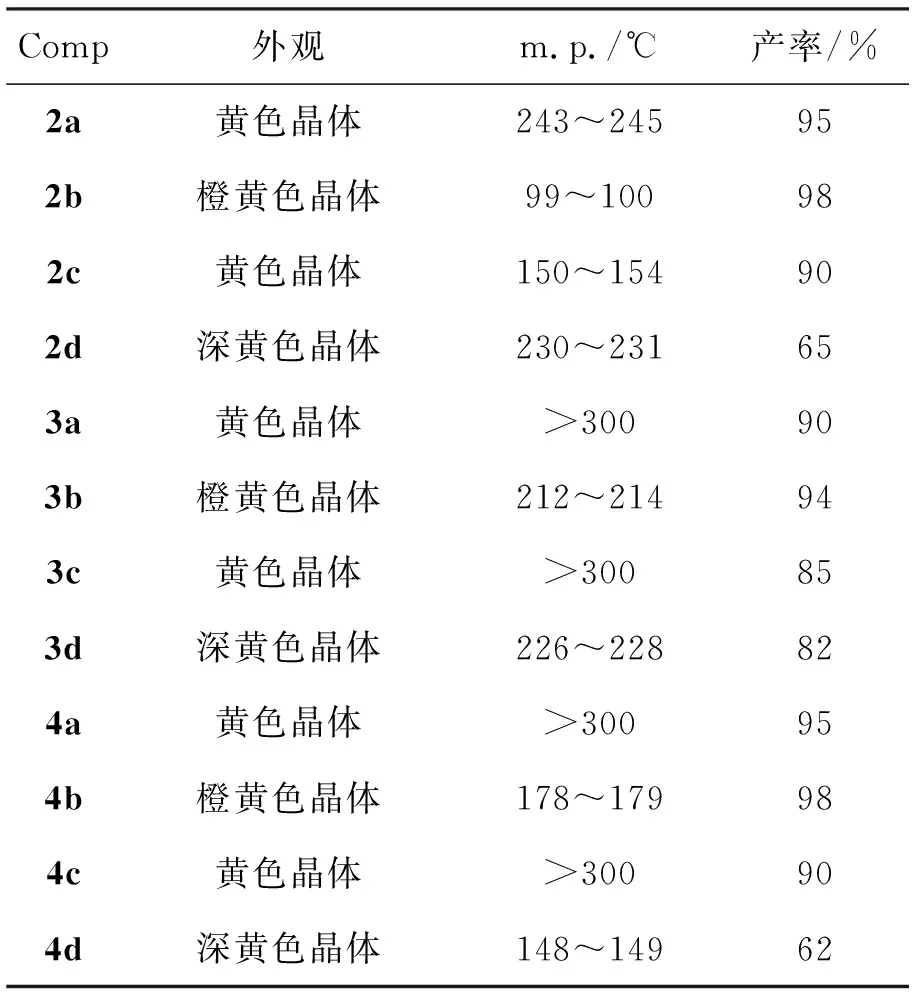
表 1 合成2~4的实验结果*
*反应时间分别为1.5 d(3), 2.0 d(2)和3.0 d(4),其余反应条件同1.2
2b(用冰水洗涤):1H NMRδ: 9.60(br, 2H, OH), 7.63(d,J=16 Hz, 2H, =CH), 7.35(s, 2H, ArH), 7.18(d,J=8.1 Hz, 2H, ArH), 7.12(d,J=16 Hz, 2H, =CH), 6.81(d,J=8.1 Hz, 2H, ArH), 3.84(s, 6H, OCH3); IRν: 3 420, 2 972, 1 636, 1 590, 1 541, 1 508, 1 456, 1 124, 1 030, 736 cm-1; ESI-MSm/z: 325{[M-1]-}; Anal.calcd for C19H18O5: C 69.93, H 5.56; found C 69.79, H 5.51。
2c(用乙醇重结晶):1H NMRδ: 9.58(br, 2H, OH), 9.11(br, 2H, OH), 7.54(d,J=16 Hz, 2H, =CH), 7.13(s, 2H, ArH), 7.06(d,J=8.1 Hz, 2H, ArH), 6.98(d,J=16 Hz, 2H, =CH), 6.78(d,J=8.1 Hz, 2H, ArH); IRν: 3 485, 3 386, 1 592, 1 523, 1 444, 1 380, 1 281, 1 196, 1 165, 1 111, 981 cm-1; ESI-MSm/z: 297{[M-1]-}; Anal.calcd for C17H14O5: C 68.45, H 4.73; found C 68.26, H 4.67。
2d(用20%丙酮冰水洗涤):1H NMRδ: 9.00(br, 2H, OH), 7.63(d,J=16 Hz, 2H, =CH), 7.17(d,J=16 Hz, 2H, =CH), 7.07(s, 4H, ArH), 3.83(s, 12H, OCH3); IRν: 1 601, 1 510, 1 457, 1 425, 1 335, 1 287, 1 213, 1 154, 1 110 cm-1; ESI-MSm/z: 385{[M-1]-}; Anal.calcd for C21H22O7: C 65.28, H 5.74; found C 65.21, H 5.68。
2,5-双(4-羟基苯亚甲基)环戊酮(3a)(用甲醇重结晶):1H NMRδ: 10.01(br, 2H, OH), 7.51(d,J=8.1 Hz, 4H, ArH), 7.31(s, 2H, =CH), 6.85(d,J=8.1 Hz, 4H, ArH), 3.01(s, 4H, CH2); IRν: 3 298, 1 667, 1 591, 1 570, 1 508, 1 432, 1 385, 1 255, 1 164, 1 111, 988, 838 cm-1; ESI-MSm/z: 291{[M-1]-}; Anal.calcd for C19H16O3: C 78.06, H 5.52; found C 77.93, H 5.46。
3b(用乙醇重结晶):1H NMRδ: 9.64(br, 2H, OH), 7.34(s, 2H, =CH), 7.23(s, 2H, ArH), 7.15(s, 2H, ArH), 6.87(d, 2H,J=8.1 Hz, ArH), 3.83(s, 6H, OCH3), 3.06(s, 4H, CH2); IRν: 3 494, 2 930, 1 582, 1 510, 1 446, 1 249, 1 211, 1 179, 1 123, 1 030, 995 cm-1; ESI-MSm/z: 351{[M-1]-}; Anal.calcd for C21H20O5: C 71.58, H 5.72; found C 71.50, H 5.68。
3c(用乙醇重结晶):1H NMRδ: 9.53(br, 2H, OH), 9.18(br, 2H, OH), 7.23(d,J=8.1 Hz, 2H, =CH), 7.10(s, 2H, ArH), 7.00(d,J=8.7 Hz, 2H, ArH), 6.82(d,J=8.1 Hz, 2H, ArH), 3.00(s, 4H, CH2); IRν: 3 399, 1 593, 1 522, 1 447, 1 377, 1 256, 1 166, 1 114 cm-1; ESI-MSm/z: 323{[M-1]-}; Anal.calcd for C19H16O5: C 70.36, H 4.97; found 70.18, H 4.89。
3d(用乙醇重结晶):1H NMRδ: 9.03(br, 2H, OH), 7.36(s, 2H, =CH), 6.96(s, 4H, ArH), 3.82(s, 12H, OCH3), 3.12(t,J=6.7 Hz, 4H, CH2); IRν: 3 484, 1 612, 1 512, 1 456, 1 327, 1 254, 1 219, 1 154, 1 111 cm-1; ESI-MSm/z: 411{[M-1]-}; Anal.calcd for C23H24O7: C 66.98, H 5.87; found C 66.83, H 5.82。
2,6-双(4-羟基苯亚甲基)环己酮(4a)(用甲醇重结晶):1H NMRδ: 9.88(br, 2H, OH), 7.52(s, 2H, =CH), 7.38(d,J=8.1 Hz, 4H, ArH), 6.82(d,J=8.1 Hz, 4H, ArH), 2.84(t,J=5.7 Hz, 4H, CH2), 1.72(q,J=5.7 Hz, 2H, CH2); IRν: 3 241, 2 943, 1 649, 1 593, 1 542, 1 505, 1 436, 1 376, 1 276, 1 243, 1 213, 1 166, 968, 839 cm-1; ESI-MS : 305{[M-1]-}; Anal.calcd for C20H18O3: C 78.41, H 5.92; found C 78.28, H 5.83。
4b(用乙醇重结晶):1H NMRδ: 9.48(br, 2H, OH), 7.53(s, 2H, =CH), 7.08(s, 2H, ArH), 7.01(d,J=8.1 Hz, 2H, ArH), 6.82(d,J=8.1 Hz, 2H, ArH), 3.79(s, 6H, OCH3), 2.87(t,J=6.7 Hz, 4H, CH2), 1.71(q,J=6.7 Hz, 2H, CH2); IRν: 3 370, 1 930, 1 577, 1 513, 1 421, 1 284, 1 256, 1 165, 1 129 cm-1; ESI-MSm/z: 365{[M-1]-}; Anal.calcd for C22H22O5: C 72.12, H 6.05; found C 72.03.48, H 6.02。
4c(用乙醇重结晶):1H NMRδ: 9.43(br, 2H, OH), 9.12(br, 2H, OH), 7.43(s, 2H, =CH), 6.96(s, 2H, ArH), 6.85(d,J=8.1 Hz, 2H, ArH), 6.78(d,J=8.1 Hz, 2H, ArH), 2.83(t,J=6.7 Hz, 4H, CH2), 2.04(q,J=6.7 Hz, 2H, CH2); IRν: 3 503, 3 370, 1 594, 1 523, 1 448, 1 377, 1 255, 1 222, 1 165, 1 114 cm-1; ESI-MSm/z: 337{[M-1]-}; Anal.calcd for C20H18O5: C 70.99, H 5.36; found C 70.76, H 5.27。
4d(用乙醇重结晶):1H NMRδ: 8.89(br, 2H, OH), 7.55(s, 2H, =CH), 6.83(s, 4H, ArH), 3.71(s, 12H, OCH3), 2.93(t,J=6.7 Hz, 4H, CH2), 1.74(q,J=6.7 Hz, 2H, CH2); IRν: 3 426, 2 937, 1 599, 1 512, 1 454, 1 423, 1 354, 1 257, 1 218, 1 151, 1 114 cm-1; ESI-MSm/z: 425{[M-1]-}; Anal.calcd for C24H26O7: C 67.59, H 6.15; found C 67.48, H 6.09。
2 结果与讨论
2.1 酮对反应时间的影响
由实验结果可以看出,当醛相同时,不同酮所需反应时间的顺序为:环戊酮<丙酮<环己酮。环己酮为稳定的六元环,α-H较难离去,丙酮次之,环戊酮最不稳定,故反应活性最好。 酸用量1.2 mmol[即醛(10 mmol)摩尔当量的十分之一左右]就能保证反应顺利进行,副产物少,易分离提纯。
2.2 缩合反应的条件选择
实验尝试了多种催化剂,结果发现虽然浓硫酸和对甲苯磺酸都能得到相应的产物,但副反应多,提纯困难,产物纯度不够;磷酸体系反应进度很慢,相同条件下催化活性不够,反应时间超过4 d也只有50%的产率;浓盐酸/乙醇体系能很好地合成目标产物,产率及纯度较高,反应时间适中。用过量的酮能使反应能进行得更彻底。浓盐酸滴加速度过快会使酸浓度局部过高,生成深褐色物质,从而影响产品纯度及产率;在冰水浴条件滴加浓盐酸,能使反应热量快速分散。
反应温度控制在25 ℃~30 ℃,产物纯度较高。反应温度过高,虽然能提高反应速度但同时也导致副产物增多,故实验选择在室温条件下避光反应。
合成2时,加水析晶比较困难,应先通过真空干燥除去溶剂或者自然挥发至干,再用水洗涤,去除催化剂及其他水溶性杂质,产率和纯度都能提高。对3和4,以无水乙醇作溶剂,可以直接析出固体,抽滤,滤饼依次用冷乙醇和二次水洗涤,真空干燥;滤液浓缩后加水析出固体,抽滤,滤饼甲醇或乙醇重结晶,两次所得固体纯度一致。
[1] Goel A, Kunnumakkara A B, Aggarwal B B. Curcumin as “Curecumin”:From kitchen to clinic[J].Biochem Pharmacol,2008,75:787- 809.
[2] Aggarwal B B, Harikumar K B. Potential therapeutic effects of curcumin,the anti-inflammatory agent,against neurodegenerative,cardiovascular,pulmonary,metabolic,autoimmune and neoplastic diseases[J].Int J Biochem Cell Bio,2008,41:40-59.
[3] Shang Y J, Jin X L, Shang X L,etal. Antioxidant capacity of curcumin-directed analogues:Structure-activity relationship and influence of microenvironment[J].Food Chemistry,2010,119:1435-1442.
[4] Mukhopadhyay A, Basu N, Ghatak N,etal. Anti-inflammatory and irritant activities of curcumin analogues in rats[J].Agents Actions,1982,12:508-515.
[5] Priyadarsini K I, Maity D K, Naik G H,etal. Role of phenolic O-H and methylene hydrogen on the free radical reactions and antioxidant activity of Curcumin[J].Free Radic Biol Med,2003,35:475- 484.
[6] Qiu X, Liu Z, Shao W Y,etal. Synthesis and evaluation of curcumin analogues as potential thioredoxin reducatase inhibitors[J].Bioorganic & Medical Chemistry,2008,16:8035- 8041.
[7] Ka Heng Lee, Farida Haryani Ab Aziz, Ahmad Syahida,etal. Synthesis and biological evaluation of curcumin-like diarylpentanoid analogues for anti-inflammatory, antioxidant and anti-tyrosinase activities[J].European Journal of Medicinal Chemistry,2009,44(8):3195-3200.
[8] S S Sardjiman, M S Reksohadiprodjo, L Hakim,etal. l,5-Diphenyl-1,4-pentadiene-3-ones and cyclic analogues as antioxidative agents.Synthesis and structure-activity relationship[J].European Journal of Medicinal Chemistry,1997,32:625- 630.
[9] 杨玲,路军,白银娟,等. 无溶剂InCl3·4H2O催化下微波促进芳香醛与环酮的缩合反应[J].有机化学,2003,23(7):659- 661.
[10] Soliman Khatib, Ohad nerya, Ramadan Musa,etal. Chalcones as potent tyrosinase inhibitors;the importance of a 2,4-substituted resorcinol moiety[J].Bioorganic & Medicinal Chemistry,2005,13:433- 441.
[11] Guang Liang, Shulin Yang, Huiping Zhou,etal. Synthesis,crystal structure and anti-inflammatory properties of curcumin analogues[J].European Journal of Medicinal Chemistry,2009,44:915- 919.

