三种氨基酸添加下酶法修饰酪蛋白水解物的ACE抑制活性*
汪敬科,赵新淮
(东北农业大学乳品科学教育部重点实验室,黑龙江哈尔滨,150030)
三种氨基酸添加下酶法修饰酪蛋白水解物的ACE抑制活性*
汪敬科,赵新淮
(东北农业大学乳品科学教育部重点实验室,黑龙江哈尔滨,150030)
采用碱性蛋白酶水解酪蛋白,制备水解度为12.4%、IC50为42.19 μg/mL的酪蛋白水解物。在添加外源氨基酸的情况下对水解物进行类蛋白反应修饰,并响应面法研究氨基酸添加量、酶添加量、反应温度及3种氨基酸的影响。结果表明:氨基酸添加量、反应温度、氨基酸种类对修饰反应影响显著,而酶添加量的影响不大;分别添加苯丙氨酸、亮氨酸、缬氨酸制备3个酪蛋白水解物修饰产物,其IC50降低至21.03~25.13 μg/mL,表明添加外源氨基酸可提高修饰产物的体外ACE抑制活性,但添加不同氨基酸的影响不显著。
酪蛋白水解物,类蛋白反应,氨基酸,ACE抑制活性,响应面
高血压被称为“无声杀手”,在早期没有明显的症状,直到发生临床危象——心肌梗塞、脑血管破裂等疾病。血管紧张素I转换酶(angiotensin-I-converting enzyme,ACE)在人体血压调控中起重要作用[1]。乳源ACE抑制剂以无副作用、安全性高而具有研究价值[2-4]。为获得高活性的 ACE抑制肽,已对各种影响因素进行广泛研究,其中以水解条件的优化和ACE抑制肽的分离、纯化为热点[5]。
类蛋白反应是指在一定条件下,通过酶的催化使浓缩后的蛋白水解物形成一种粘稠状物质。类蛋白反应通常需要两步酶过程,第一步反应是在适宜条件下,通过酶对蛋白质进行限制性水解,得到肽;第二步反应是将浓缩后的水解物作为底物,或加入氨基酸衍生物,或加入其它不同来源的蛋白质水解物,在适宜条件下,通过酶的催化生成触变胶体或粘稠状的液体[6]。已有研究表明,类蛋白反应修饰的酪蛋白水解物其ACE抑制活性得到显著提高[7-8]。因此,本研究利用碱性蛋白酶水解酪蛋白制备酪蛋白水解物,再在添加3种外源氨基酸下利用碱性蛋白酶催化类蛋白反应对水解物进行修饰,响应面法研究反应条件对修饰反应的影响,并考察修饰反应对产物的ACE抑制活性的影响。
1 材料与设备
1.1 主要材料
酪蛋白(蛋白质含量86.1%),北京奥博星生物技术有限公司;碱性蛋白酶,诺维信生物技术有限公司;兔肺丙酮粉,Sigma公司;FAPGG(FA-Phe-Gly-Gly,Sigma公司;L-亮氨酸甲酯盐酸盐、L-苯丙氨酸甲酯盐酸盐、L-缬氨酸甲酯盐酸盐,上海晶纯试剂有限公司;其他所有试剂均为分析纯,水为蒸馏水或超纯水。
1.2 主要设备
UV-2401PC型紫外可见分光光度计,日本岛津公司;AL204型分析天平,梅特勒-托利多仪器中国有限公司;Kjeltec TM2300型自动凯氏定氮仪,瑞士Foss公司;LGJ-1型真空冷冻干燥机,上海医用分析仪器厂;HZQ-F160型全温振荡培养箱,哈尔滨东联电子技术开发有限公司;DELTA 320型精密pH计,梅特勒-托利多中国有限公司;QT-1型微型漩涡混合器,上海琦特分析仪器有限公司;YH-4BS型远红外恒温干燥箱,天津市中环实验电炉有限公司;DK-98-1型电热恒温水浴锅,天津市泰斯特仪器有限公司。
2 试验方法
2.1 酪蛋白水解物的制备
配制质量浓度为10%的酪蛋白溶液,用2 mol/L的NaOH调节pH至8.5,加入碱性蛋白酶并于55℃下进行水解,酶添加量为1 kU/g蛋白质。分别于0、1、2、3、4、5、6、7、8 h 取出 15 mL 样品溶液,迅速置于沸水浴中灭酶15 min。样品溶液冷却至室温后5 000 r/min离心20 min,分离出上清液。测定上清液中蛋白质含量和游离氨基含量,计算其水解度,同时测定上清液的ACE抑制活性。通过以上分析,确定酪蛋白水解物的适宜制备条件后进行放大实验,得到的上清液在真空冷冻干燥后于-20℃保藏。
2.2 酪蛋白水解物的类蛋白反应修饰
采用中心组合实验,固定底物浓度为35%(w/w),通过测定反应体系的游离氨基含量变化(修饰产物的游离氨基含量减去反应底物的游离氨基含量),考察氨基酸添加量(添加的氨基酸摩尔数/酪蛋白水解物游离氨基摩尔数,mol/mol)、酶添加量(kU/g蛋白质)、反应温度对反应的影响,以选择适宜的修饰反应条件。采用三因素五水平响应面方法分析,其因素水平编码见表1。
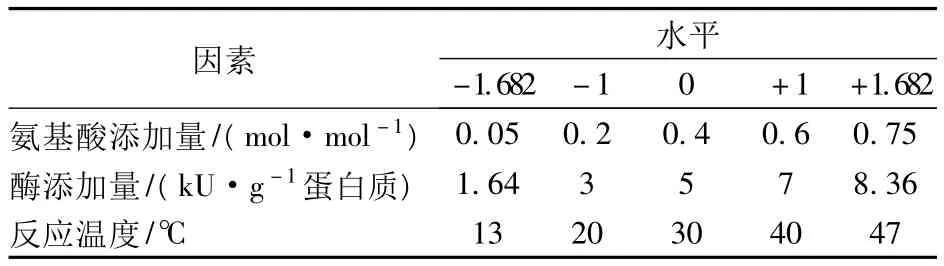
表1 响应面分析的因素水平编码表
2.3 相关分析
2.3.1 蛋白质含量、水解度及蛋白酶活力的测定
(1)蛋白质含量测定:凯氏定氮法[9]。
(2)游离氨基含量及酪蛋白水解度(DH)测定:邻苯二甲醛(OPA)法[10-11]。
游离氨基含量测定:将亮氨酸配制成不同浓度的标准溶液(0、6、12、18、24、30、36 μg/mL),取 3 mL 标准溶液与同体积的OPA试剂混合并开始计时,5 min后在分光光度计上340 nm波长下测定。以吸光值为横坐标、亮氨酸浓度为纵坐标绘制标准曲线。按照标准曲线制作步骤,测定样品的吸光值,并根据标准曲线回归方程计算其游离氨基含量。
水解度计算公式[12]如下:

其中,水解物游离氨基含量单位为μmol/mL;水解物氮含量单位为mg/mL;0.59 mmol/g为测定出的酪蛋白的游离氨基含量。
(3)蛋白酶活力测定:福林酚法[13]。
2.3.2 ACE抑制活性的测定
以FAPGG为底物,采用非连续分光光度法测定样品的 ACE 抑制活性[14-15]。
ACE酶液:称取50mg兔肺丙酮粉浸泡于5 mL预冷至4℃的硼酸缓冲溶液(pH8.3,100 mmol/L)中,悬液放入4℃恒温振荡摇床中提取12 h,20 000 r/min冷冻离心20 min,上清液于4℃低温保存。
FAPGG底物溶液:将FAPGG溶于100 mmol/L的硼酸缓冲溶液(pH 8.3,含300 mmol/L的NaCl),配制成1.6 mmol/L的溶液。
ACE抑制活性测定:500 μL FAPGG底物溶液与100 μL超纯水或抑制剂(ACE抑制肽或卡托普利)混匀,37℃预热2 min,加300 μL ACE 酶液并在37℃反应30 min,立即加100 μL EDTA(100 mmol/L)终止反应;加3 000 μL超纯水稀释,平行3次。0 min样品的测定,要先加入EDTA再加入ACE酶液,其他相同。采用分光光度计,在340 nm处分别测体系在0 min和30 min时的吸光值,计算差值ΔA(ΔA=A0min-A30min)。以单位时间内吸光值变化表示ACE酶活力,抑制剂对ACE酶的抑制程度计算:
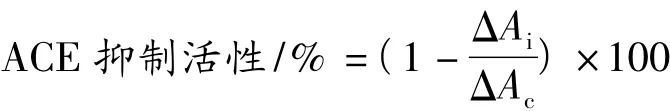
式中:ΔAc-加入超纯水时吸光值在30 min内的变化;ΔAi-加入抑制剂时吸光值在30 min内的变化。
IC50定义为:抑制50%ACE酶活力时抑制剂的浓度。配置不同浓度的ACE抑制剂(nmol/L或mg/mL),测定其ACE抑制活性。以抑制剂浓度的对数(log)为横坐标、ACE抑制活性(%)为纵坐标,进行回归分析;利用回归方程计算抑制剂的半抑制浓度(IC50)。
2.3.3 统计分析
采用SPSS 13.0软件对结果进行统计、分析,采用Excel 2003软件绘制图示。
3 结果与讨论
3.1 酪蛋白水解物的制备
对ACE抑制肽进行研究发现,其活性主要取决于C端氨基酸。C端为芳香族氨基酸(包括色氨酸、酪氨酸、苯丙氨酸)和脯氨酸时抑制活性较高;N端为疏水性的缬氨酸、亮氨酸、异亮氨酸的肽,与ACE的亲和能力较强,抑制活性较高,但脯氨酸除外。一些学者已成功地从牛乳蛋白中酶解得到 ACE抑制肽[16-17],所以本研究用碱性蛋白酶水解酪蛋白。酪蛋白水解物的水解度及相应ACE抑制活性的变化如图1。
酪蛋白水解物的ACE抑制活性随着水解度的提高而迅速增大,其后ACE抑制活性几乎不变或略有降低,此结果与Robert[18]等人的研究结果相似,表明小分子肽具有更高的ACE抑制活性。水解6 h,酪蛋白水解物的水解度为12.4%,ACE抑制活性为最高,其IC50为42.19 μg/mL。所以,选择此酪蛋白水解物为下一步类蛋白反应修饰的底物。
3.2 ACE抑制肽的修饰条件优化
3.2.1 添加亮氨酸时反应条件的影响
研究表明,类蛋白反应修饰时底物浓度过大时体系的黏度太大而不利于反应,浓度过低则导致发生水解反应[7-8,10]。因此,确定适宜的底物浓度为 35%(w/w),确定适宜的反应时间为6 h。
按照中心组合试验设计要求进行20组试验,研究添加亮氨酸时适宜的反应条件,通过回归方程所作的响应面曲面图如图2~图4所示。
亮氨酸添加量和酶添加量对反应体系中游离氨基的影响如图2,二者之间的交互作用对游离氨基含量变化影响较大(P<0.05)。当酶添加量一定时,所选亮氨酸添加量范围内反应体系中游离氨基减少量随亮氨酸添加量的增加而增加,酶添加量较低时这种现象更加明显。不过,酶添加量的影响较小。

图1 不同水解时间下酪蛋白水解产物水解度和ACE抑制活性。
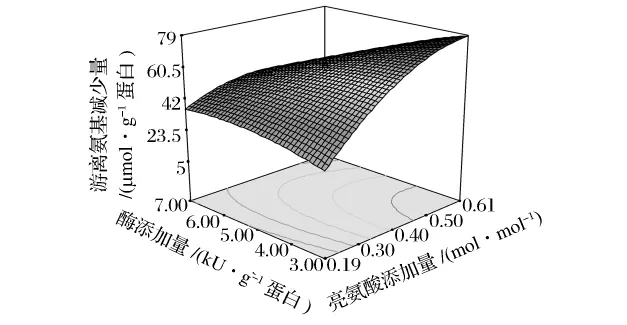
图2 酶添加量和亮氨酸添加量对类蛋白反应体系中游离氨基含量变化的响应面(X3=30)
亮氨酸添加量和反应温度对反应体系游离氨基减少量的影响如图3。二者之间的交互作用也较大(P<0.05),随着反应温度的降低、亮氨酸添加量的增加,反应体系中游离氨基减少量逐渐增加。

图3 反应温度和亮氨酸添加量对类蛋白反应体系中游离氨基含量变化的响应面(X2=5)
反应温度和酶添加量对反应体系游离氨基减少量的影响如图4。二者之间的交互作用较小(P>0.05)。在反应温度一定时,反应体系游离氨基含量变化随酶添加量的降低而增加;在酶添加量一定时,反应体系游离氨基含量变化随反应温度的降低而增加。
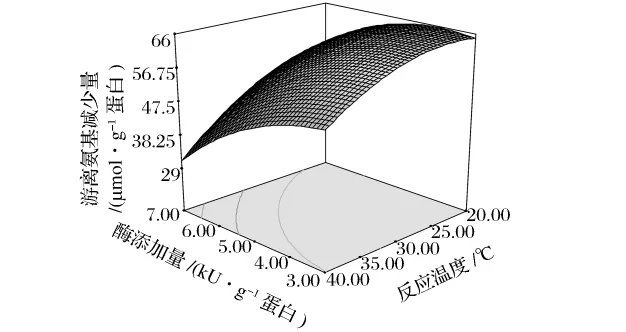
图4 酶添加量和反应温度对类蛋白反应体系中游离氨基含量变化的响应面(X1=0.4)
3.2.2 添加其他2种外源氨基酸时的适宜反应条件
在分别添加苯丙氨酸、缬氨酸后,同样研究反应条件对酪蛋白水解物类蛋白反应的影响,发现所得到研究结果是相似的,各反应条件均对修饰反应有一定的影响,只是游离氨基含量的变化程度不同。这里不再给出具体数据。
综合分析所有实验结果,得到在3种外源性氨基酸添加下酪蛋白水解物类蛋白反应的适宜条件为:氨基酸添加量为0.6 mol/mol,酶添加量为3 kU/g蛋白,反应温度为40℃。
3.3 修饰后酪蛋白水解物的ACE抑制活性
在底物浓度为35%(w/w)、酶添加量为3kU/g蛋白质、反应温度40℃、反应时间6 h、氨基酸添加量为0.6 mol/mol的条件下,制备分别添加了亮氨酸、苯丙氨酸和缬氨酸的修饰酪蛋白水解物,其ACE抑制活性测定结果列于表2。
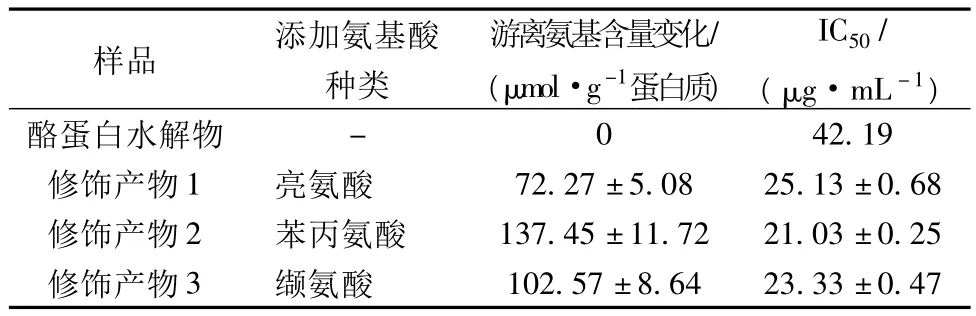
表2 酪蛋白水解物类蛋白反应修饰后的ACE抑制活性
结果表明,当碱性蛋白酶催化酪蛋白水解物进行类蛋白反应修饰后,所添加的氨基酸种类不同,反应体系中游离氨基减少量显著不同。更为重要的是,相比原先酪蛋白水解物的IC50(42.19 μg/mL),修饰产物的IC50数值变得更小、ACE抑制活性显著提高(增幅接近1倍)。不过,3个修饰产物之间的ACE抑制活性是基本相同的。这一结果说明,在外源性氨基酸添加下利用碱性蛋白酶催化酪蛋白水解物进行类蛋白反应修饰时,修饰产物的ACE抑制活性与氨基酸种类的关系不大。有关外源性氨基酸对酪蛋白修饰产物的ACE抑制活性影响,还需进一步研究。
4 结论
(1)利用碱性蛋白酶对酪蛋白进行水解,水解时间为6 h时制备出水解度为12.4%的酪蛋白水解物,其ACE抑制活性最高,IC50值为42.19 μg/mL。
(2)在添加了外源性氨基酸的情况下,利用碱性蛋白酶对酪蛋白水解物进行修饰,氨基酸添加量与反应温度对修饰反应影响较大,而酶添加量的影响很小,另外,氨基酸的种类也有影响。
(3)通过研究反应体系中游离氨基变化量的大小,在底物浓度固定为35%(w/w)、反应时间固定为6 h的条件下,确定出适宜的反应条件为:氨基酸添加量为0.6(mol/mol)、酶添加量为3kU/g蛋白质、反应温度为40℃。
(4)利用上述的反应条件,分别添加苯丙氨酸、亮氨酸、缬氨酸,制备出3个酪蛋白水解物的修饰产物。分析结果显示,修饰产物ACE抑制活性大幅度提高,IC50降低至 21.03 ~25.13 μg/mL,但 3 种修饰产物的ACE抑制活性之间并没有显著性差异。
[1] Pfeffer M A.Angiotensin-converting enzyme inhibition in congestive heart failure:Benefit and perspective[J].A-merican Heart Journal,1993,126(3):789 -793.
[2] Maria M,Yust J P,Julio G C,et al.Production of ace inhibitory peptides by digestion of chickpea legumin with alcalase[J].Food Chemistry,2003,81(3):363-369.
[3] Suh H J,Whang J H,Kim Y S,et al.Preparation of angiotensin I converting enzyme inhibitor from corn gluten[J].Process Biochemistry,2003,38(8):1239-1244.
[4] Ueno K,Mizuno S,Yamamoto N.Purification and characterization of an endopeptidase that has an important role in the carboxyl terminal processing of antihypertensive peptides in Lactobacillus helveticus CM4[J].Letters in Applied Microbiology,2004,39(4):313-318.
[5] Kuba M,Tana C,Tawata S,et al.Production of angiotensin I-converting enzyme inhibitory peptides from soybean protein with Monascus purpureus acid proteinase [J].Process Biochemistry,2005,40(6):2 191-2 196.
[6] Doucet D,Gauthier S F,Otter D E,et al.Enzyme-induced gelation of extensively hydrolyzed whey proteins by alcalase:Comparison with the plastein reaction and characterization of interactions[J].Journal of Agricultural and Food Chemistry,2003,51(20):6 036-6 042.
[7] 李亚云,赵新淮.酪蛋白水解物的酶法修饰与ACE抑制活性变化[J].食品与发酵工业,2009,35(5):35-39.
[8] Zhao X H,Li Y Y.An approach to improve ACE inhibitory activity of casein hydrolysates with Plastein reaction catalyzed by Alcalase[J].European Food Research and Technology,2009,229(5):795-805.
[9] GB/T 5009.5-2003,食品中蛋白质的测定[S].
[10] Church F C,Swaisgood H E,Porter D H,et al.Spectrophtotometric assay using ο-phthaldialdehyde for determination of proteolysis in milk and milk proteins[J].Journal of Dairy Science,1983,66(6):1 219-1 227.
[11] Spellman D,McEvoy E,O'Cuinn G,et al.Proteinase and exopeptidase hydrolysis of whey protein:Comparison of the TNBS,OPA and pH stat methods for quantification of degree of hydrolysis [J].International Dairy Journal,2003,13(6):447-453.
[12] 赵新淮,冯志彪.蛋白质水解物水解度的测定[J].食品科学,1994,15(11):65-67.
[13] SB/T 10317-1999,蛋白酶活力测定[S].
[14] Shalaby S M,Zakora M,Otte J,et al.Performance of two commonly used angiotensin-converting enzyme inhibition assays using FA-PGG and HHL as substrates[J].Journal of Dairy Research,2006,73(2):178-186.
[15] Murray B A,Walsh D J,FitzGerald R J.Modification of the furanacryloyl-L-phenylalanyl-glycylglycine assay for determination of angiotensin-I-converting enzyme inhibitory activity[J].Journal of Biochemical and Biophysical Methods,2004,59(2):127-137.
[16] Miguel M,Contreras M M,Recio I,et al.ACE-inhibitory and antihypertensive properties of a bovine casein hydrolysate[J].Food Chemistry,2009,112(1):211 -214.
[17] Ortiz-Chao P,Gomez-Ruiz J A,Rastall R A,et al.Production of novel ACE inhibitory peptides from β-lactoglobulin using Protease N Amano[J].International Dairy Journal,2009,19(2):69-76.
[18] Robert M C,Razaname A,Mutter M,et al.Identification of angiotensin-I-converting enzyme inhibitory peptides derived from sodium caseinate hydrolysates produced by Lactobacillus helveticus NCC 2765[J].Journal of Agricultural and Food Chemistry,2004,52(23):6 923-6 931.
The ACE-inhibitory Activity in Vitro of Casein Hydrolysates Subjected to Enzymatic Modification in the Presence of Three Extrinsic Amino Acids
Wang Jing-ke,Zhao Xin-huai
(Key Laboratory of Dairy Science,Ministry of Education,Northeast Agricultural University,Harbin 150030,China)
Casein hydrolysates that had a degree of hydrolysis of 12.4%and ACE-inhibition with an IC50value of 42.19 μg/mL were prepared from casein with a protease Alcalase,and then modified by plastein reaction with Alcalase in the presence of three extrinsic amino acids.The effects of the addition level of amino acids,the addition level of Alcalase,reaction temperature and the types of amino acids on the plastein reaction of casein hydrolysates were investigated with response surface methodology.The results indicated that the addition of amino acids,reaction temperature and the types of amino acid added had significant impact on the plastein reaction,while the addition of Alcalase gave little influence.Three modified casein hydrolysates were prepared with suitable conditions and in the presence of phenylalanine,leucine and valine,respectively.Their IC50values were in range of 21.03 to 25.13 μg/mL,indicating that the ACE-inhibitory activity in vitro of the modified casein hydrolysates was improved significantly by adding amino acids while the types of amino acids were not important to the activity.
casein hydrolysates,plastein reaction,amino acids,ACE inhibitory activity,response surface methodology
硕士研究生(赵淮新教授为通讯作者)。
*国家自然科学基金(项目编号30972132)和黑龙江省高等学校科技创新团队建设计划项目(项目编号2010td11)研究工作一部分
2010-12-06

