氧化对肌原纤维蛋白加工特性的影响*
胡忠良,严璐,邹玉峰,徐幸莲
1(南京农业大学教育部肉品加工与质量控制重点实验室,江苏南京,210095)
2(南京农业大学食品科技学院生物工程专业,江苏南京,210095)
氧化对肌原纤维蛋白加工特性的影响*
胡忠良1,严璐2,邹玉峰1,徐幸莲1
1(南京农业大学教育部肉品加工与质量控制重点实验室,江苏南京,210095)
2(南京农业大学食品科技学院生物工程专业,江苏南京,210095)
文中综述了氧化对肌原纤维蛋白加工特性影响的最新研究进展,包括肌肉蛋白质的具体氧化情况和氧化路径,以及氧化对肌原纤维蛋白热凝胶的质构、保水和乳化特性的作用,并从分子构象、分子间化学作用力(交联类型和交联程度)、肌纤维结构的变化推测矛盾作用产生的原因。
肌原纤维蛋白,氧化,凝胶,乳化,保水性
随着健康意识的增强,人们对食品食用品质和安全性的要求越来越高。肉类食品是人体所需优质蛋白质的主要来源,更是人们日常生活中不可缺少的食品。肉在加工、流通和贮藏过程中,不可避免地受到温度、光、射线、氧、水分和催化剂等外界环境的影响,导致脂肪和蛋白质等营养成分发生氧化[1]。研究表明,蛋白质氧化是导致肉类食品品质下降的重要原因,尤其是经过绞碎、滚揉或斩拌工序的产品,如肉糜类、碎肉类和重组类肉制品。从加工原理的角度,称这类容易发生蛋白质氧化的产品为凝胶&乳化类肉制品。
与油脂氧化不同,食物中的蛋白质氧化并不完全对身体健康有害。蛋白质适度氧化后,更容易被人体消化器官产生的蛋白酶作用,有利于人体对小肽和氨基酸等营养物质的消化吸收[2]。而近几年关于肌肉蛋白加工特性的研究也发现,并不是所有的蛋白质氧化都会降低蛋白质的加工特性,合适条件下的氧化可以改善或提高其加工特性,文中即对此进行了综述。
1 肌原纤维蛋白容易发生氧化
肉本身含有很多氧化介质,如不饱和脂肪酸、亚铁血红素铁、过渡金属离子等,在粉碎、滚揉或斩拌时,容易受分子氧和催化介质的作用,引起氧化。之前的研究多侧重脂肪氧化,因其会引起风味的劣变。随着研究的深入,人们发现蛋白质也容易被氧化,而且对产品品质的危害更严重,目前在凝胶&乳化肉制品中关于这方面的研究主要为:肉中容易氧化的蛋白质种类及氧化路径。
1.1 凝胶&乳化类肉制品中的蛋白质氧化
肌肉中蛋白质占18% ~20%,肌肉蛋白分为很多种,每一种蛋白质的氨基酸序列和高级结构差异较大,对凝胶或乳化的贡献也不同。研究氧化对蛋白质加工特性的影响就需要了解具体蛋白质的氧化情况,以便确定氧化的蛋白在肌纤维结构中的具体定位,以及氧化的具体类型,以阐明氧化对肉糜体系中肌肉蛋白凝胶、保水、乳化特性的影响机制。
Astruc等[3]采用荧光显微镜对牛肉(腹直肌)肌细胞中的蛋白氧化进行了原位检测。同时对肌原纤维蛋白和膜蛋白的氧化情况进行对比。结果表明:随着氧化剂浓度升高、贮藏时间延长,荧光含量显著增加,而且羰基分布非常不均匀——细胞外围的羰基含量高,细胞内部含量少。烹饪只引起细胞外围的荧光增加。胶原蛋白的染色结果表明,胶原蛋白没有荧光发出。据此推测,细胞外围的蛋白氧化,应该是膜蛋白的氧化,而不是结缔组织氧化。细胞内主要是肌原纤维蛋白发生了氧化,而且肌纤维结构破坏后(模拟绞碎、滚揉、斩拌等加工工序),肌原纤维蛋白的氧化程度远高于膜蛋白。
Kjærsgård 等人[4]采用分馏以及双向电泳的方法检测生肉在贮藏过程中的蛋白氧化情况。肌肉蛋白被分馏后,分别检测羰基,再进行电泳并结合免疫印迹,以SDS-PAGE或2D-GE分离。羰基检测的研究对象为全肉匀浆液、盐溶性组分(主要是肌原纤维蛋白)、水溶性组分(主要是肌浆蛋白),结果见图1和图2。在整个贮藏阶段,不管是盐溶性还是水溶性的蛋白组分,羰基含量都呈增加趋势。但是盐溶性蛋白组分的羰基含量远高于水溶性蛋白组分,说明贮藏过程中主要是盐溶性组分的蛋白发生了氧化。虽然肉中的蛋白质种类有很多,但是图2的结果表明只有较少数目的几种蛋白发生了氧化(盐溶性组分里主要有6种蛋白发生氧化)。而且在氧化过程中,不同种类蛋白质氧化程度的差异也非常大。氧化信号最强的是200 ku的条带,经分析为肌球蛋白重链;其次是37~57 ku的条带,经分析为原肌球蛋白和肌动蛋白。Morzel等[2]对氧化后的猪肉肌原纤维蛋白进行电泳后发现,肌球蛋白重链是猪肉肌原纤维蛋白中最容易氧化的蛋白,除此之外,图1(右)中泳道2和泳道4的97~200 ku之间的羰基印迹,推测可能是肌球蛋白重链的降解片段。因为之前已有研究[5]表明,鸡胸肉肌球蛋白重链氧化后会发生降解,降解的碎片分子质量大小即在97~200 ku范围。
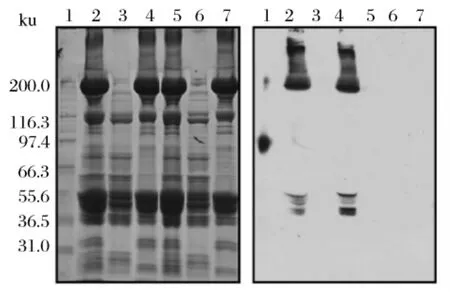
图1 肌肉蛋白质SDS-PAGE电泳结果和含有羰基的蛋白质条带的免疫印记结果
Stagsted等[6]采用免疫标记和蛋白组学技术研究了鸡肉中蛋白的氧化修饰情况,发现水溶性蛋白中,α-烯醇酶是主要的羰基活性蛋白,其他如肌动蛋白,热休克蛋白,肌酸激酶,也很容易被氧化修饰。但是,羰基含量远低于盐溶性蛋白中的肌球蛋白等组分。
生肉中不同蛋白的氧化程度并不相同,说明氧化存在蛋白特异性,而最容易被氧化的就是以肌球蛋白为主的肌原纤维蛋白。
1.2 肉糜中蛋白质的氧化路径
肉糜中很多介质都可以引起蛋白质氧化。之前的研究(上世纪80年代和90年代)一般认为,肉糜中的油脂尤其是不饱和脂肪酸非常容易发生氧化,油脂氧化是引起蛋白质氧化的主要途径。Smith[7]的研究认为氧化的油脂能够与蛋白质形成蛋白-油脂结合产物,引起氨基酸破坏、肽链降解、蛋白聚合、溶解度下降等。Saeed等[8]总结了油脂氧化对肌肉蛋白加工特性的影响,氧化的脂肪酸会增加肌肉蛋白分子的表面活性,使蛋白质发生变性解折叠(氢键被破坏),内部活性基团暴露在分子表面导致分子间疏水交联等进一步的反应,引起蛋白结构和功能的破坏。氧化油脂中的羰基基团,会参与共价交联,形成稳定的蛋白-脂肪聚集体。Schaich等[9]认为油脂-蛋白交联存在2个基本路径:
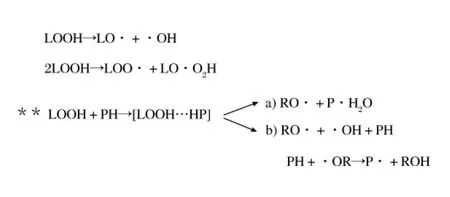
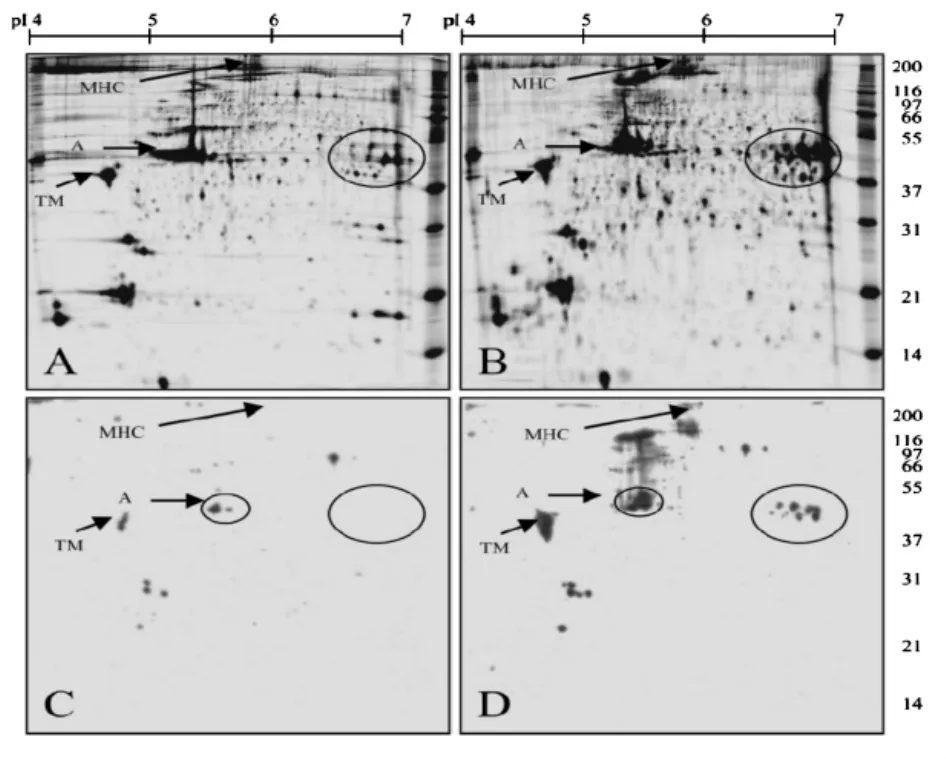
图2 盐溶性蛋白组分的双向电泳结果(A,B)和羰基免疫印记结果(C,D)
其中LH为油脂,PH为蛋白质,LOOH为油脂氢过氧化物,RO·为过氧自由基。油脂氧化产物(油脂自由基、氢过氧化物、挥发性的二级产物)或其降解产物(丙醛,氨基基团等)容易与蛋白质结合,形成蛋白质-氧化油脂复合体,随后发生自由基的转移。自由基主要通过2种方式转移(以油脂氢过氧化物为例):第1种,油脂氢过氧化物脱氢(生成LOO·和LO·),LOO·夺取蛋白质活性氨基酸的氢原子,发生自由基的转移(得到产物(a));第2种,油脂氢过氧化物在活性氨基酸附近发生歧化(生成LO·和·OH),LO·夺取蛋白质活性氨基酸的氢原子,发生自由基的转移[得到产物(b)]。此外,油脂氢过氧化物的氧原子与氨基酸的活性氮原子或硫原子也可以通过氢键作用形成蛋白氢过氧化物,引起蛋白自由基的链式反应,导致其他蛋白质等生物分子进一步氧化。
但是最近10年的研究发现,肉糜中蛋白质的氧化并非完全是由油脂氧化引起的。Park等[10-11]模拟了肉糜中主要存在的3种氧化体系:铁激活/羟自由基氧化体系(IOS:10 mmol/L FeCl3,0.1 mmol/L抗坏血酸,0.05~5.0 mmol/L H2O2);亚油酸氧化体系(LOS:0.05~5.0 mmo/L亚油酸,3 750 U/mL的脂肪氧合酶);高铁肌红蛋白氧化体系(MOS:0.05~0.5 mmol/L高铁肌红蛋白/H2O2)并进行了系统研究,希望阐明引起肉糜肌原纤维蛋白氧化的主要路径。研究发现,3种氧化体系中的Ca-ATPase和 KATPase酶活损失相似,而且都在低浓度氧化剂时损失就较大;MOS组的肌原纤维蛋白羰基含量高,IOS组的硫代巴比妥酸值(TBARS)高、热转变温度值变化剧烈、MHC条带损失多。随后该课题组利用反相液谱研究了3种氧化体系条件下猪肉肌原纤维蛋白的氨基酸氧化情况[12],IOS体系中,随 H2O2浓度增高,半胱氨酸、蛋氨酸、酪氨酸含量显著下降;LOS体系中,随着亚油酸浓度增加,只有半胱氨酸和甲硫氨酸显著下降;MOS体系中,MetMb/H2O2浓度增加,则丙氨酸、半胱氨酸、甘氨酸、组氨酸、亮氨酸、赖氨酸都减少,而氨基酸总量也减少。由此推测,肉糜加工时肌原纤维蛋白氧化主要是通过过渡金属离子和高铁肌红蛋白激活实现的。
蛋白质的凝胶、乳化等加工特性,是通过溶解状态的蛋白质分子间形成不同模式的交联实现的。不同的氧化路径对蛋白质分子间交联模式的影响可能存在很大差异,因此对加工特性也会产生不同的影响。Xiong等[13]研究了3种氧化体系对猪肉肌原纤维蛋白分子结构和化学键的影响。IOS和MOS氧化体系显著促进肌原纤维蛋白(尤其是肌球蛋白分子)的交联,降低其溶解度/被提取率。胰凝乳蛋白酶消化试验表明,肌球蛋白的杆部(rod)区域最容易被IOS和MOS氧化,其次是肌球蛋白头部(S-1)区域。氧化导致的分子间交联主要是二硫键的作用,其次是丙醛基,而二酪氨酸的作用不明显。此项研究验证了之前的假说,即凝胶&乳化类肉制品中过渡金属离子和高铁肌红蛋白是催化蛋白质氧化的主要路径。
2 氧化对肌原纤维蛋白凝胶/乳化特性的作用
2.1 氧化对凝胶特性和保水性的影响
大多数文献表明,氧化不利于肌原纤维蛋白形成良好质构及保水性的凝胶。Decker等[14]研究了氧化(IOS)对火鸡肉白肌肌原纤维蛋白的羰基含量、盐溶性(溶解度)、蛋白质交联,以及热凝胶形成后的凝胶质构和保水性的影响。结果显示,氧化过程中羰基含量持续增加,蛋白质溶解度/被提取率显著下降,凝胶强度、凝胶保水性也显著下降。变性电泳结果表明,氧化后盐溶性组分中的肌球蛋白和肌动蛋白大量损失,伴随着很多不溶解的蛋白聚合体的形成。
但是也有研究发现,氧化并不一定降低肌原纤维蛋白的加工特性。早在1972年,Snider等[15]研究发现温和氧化有利于蛋清蛋白的聚集,提高其凝胶特性。他们据此认为,氧化有利于蛋白的加工特性。Wan等[16]研究发现,肉糜加入抗氧化剂(0.02%没食子酸丙酯、0.2%抗坏血酸钠和0.2%三聚磷酸钠),可有效抑制冷藏期间的肌原纤维蛋白氧化,但是盐溶性蛋白含量下降速度加快——冷藏5~8 d时对照组的可溶性蛋白含量为36%左右,而加入抗氧化剂组可溶性蛋白含量仅为 30%(图3)。Srinivasan等[17]发现抗氧化剂(0.02%没食子酸丙酯或0.2%的α-生育酚)显著抑制牛肉糜的蛋白氧化和脂肪氧化,但是并没有影响产品的热凝胶特性;冷藏促进了肉糜的蛋白氧化,显著提高凝胶的黏弹性,而且蛋白羰基和油脂TBA越高,凝胶弹性越大。Xiong等[18]用IOS和MOS氧化体系分别处理猪前腿肉肌原纤维蛋白,随后检测了热凝胶的动态黏弹性和微结构,发现适度氧化的样品组的凝胶弹性更好(图4),微结构也更均匀细腻。
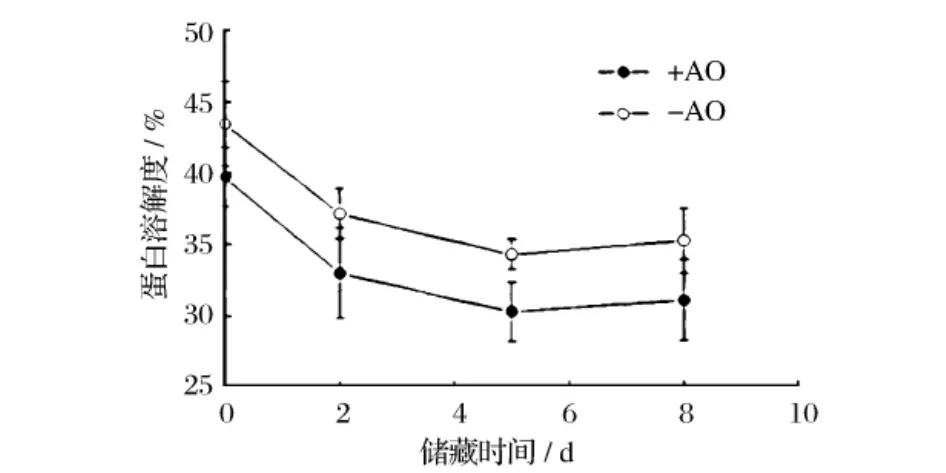
图3 储藏过程中(0℃),牛心肌肌原纤维蛋白溶解度的变化
与对质构特性的影响不同,适度氧化对保水性的影响目前并没有一致结论。肉糜的“保水”包括2部分,一部分是肉糜体系中可溶性的蛋白质分子周围包被的极性水分子,另一部分是不溶解的肌纤维/肌原纤维结构内包埋的不可自由移动水(即肌原纤维溶胀)。Kelleher等[19]将水溶性和脂溶性的抗氧化剂混合后一起加入到肉糜中,研究冷藏过程中蛋白质的氧化以及对肉糜热凝胶的质构、保水等的影响,发现随着氧化程度增加,肉糜保水性也持续增加,从最初的72.1%增加至74.8%。然而Bertram等[20]以低场NMR技术检测氧化的猪肉肌原纤维体系的保水性时却得到相反的结果,发现随着体系中的H2O2增多,NMR的T2时间点前移,意味着氧化降低其保水性。Xiong等[18]在模拟IOS氧化体系下得到的保水性变化与Bertram研究结果一致(表1),在羰基含量与凝胶硬度正相关的范围内,随着蛋白质羰基含量的增加,肌原纤维蛋白的保水性却始终没有增加的趋势,羰基含量稍高时保水性反而会显著下降。该课题组曾研究发现,温和氧化会导致猪肉肌原纤维蛋白提取率(0.4 mol/L NaCl条件下)发生40%的损失,而且氧化组的肌原纤维溶胀和A带的解离程度要明显低于未氧化组[21]。作者认为是氧化的肌球蛋白分子杆部(rod)区域发生二硫键交联,限制了肌原纤维的溶胀(横切面方向的膨胀)。不过需要指出的是,以上3个研究中,Kelleher等[19]是以肉糜体系(含有脂肪)为研究对象,而Bertram 等[20]和Xiong 等[18]是以纯化的蛋白体系为研究对象,而且三者的模拟氧化体系也不同。因此,需要更多的研究,以了解氧化对肉糜肌原纤维蛋白保水性的真正影响。

表1 氧化对肌原纤维蛋白凝胶破裂力和保水性的影响
2.2 乳化特性的影响
影响肉制品乳化特性的因素有很多,原料肉来源和脂肪的种类、pH值和离子环境、滚揉斩拌的终点温度、以及脂肪与肌原纤维蛋白的比率等均会影响肉糜的乳化活性和乳化稳定性。一般认为,氧化不利于肉糜的乳化能力和乳化稳定性。Smith[22]以肉糜加热后的出品率为指标,研究了氧化对含有脂肪的生肉糜的乳化能力和乳化稳定性的影响。该研究将手工去骨或机械去骨后的火鸡肉冻藏不同时间后,研究鸡肉蛋白氧化情况、溶解度和ATpase酶活等生化特性、以及加热后的质构和出品率。结果显示,随着氧化程度增加,出品率从对照组的92.8%逐步降至84.3%;而肉糜中加入抗氧化剂可以抑制氧化,并显著抑制出品率的下降趋势。Rodríguez-Carpena 等[23]研究了生肉饼在冷藏过程中的蛋白质氧化以及对保水保油的影响,发现肉糜中不加入抗氧化组分(鳄梨果提取液),蛋白质氧化显著增加,而保水、保油性显著下降。加入鳄梨果提取液,生肉糜的保水性为72.44%,保油性为9.93%,而对照组仅分别为70.8%和9.05%;氧化程度加剧,引起的水分和油脂损失更多。Ooizumi[24]研究发现,氧化会使肌原纤维蛋白的提取率下降,溶解的蛋白质减少。据此推测氧化条件下,参与乳化的或稳定乳化体系的蛋白质也会相应减少,导致乳化能力和乳化稳定性下降。此外,也有报道指出,氧化条件下的蛋白质分子表面的疏水基团容易发生交联,蛋白质聚合程度增加,这种聚合使暴露在分子表面的疏水性氨基酸侧链数量减少,体系的乳化活性值随之下降,导致肌原纤维蛋白的乳化能力显著降低。
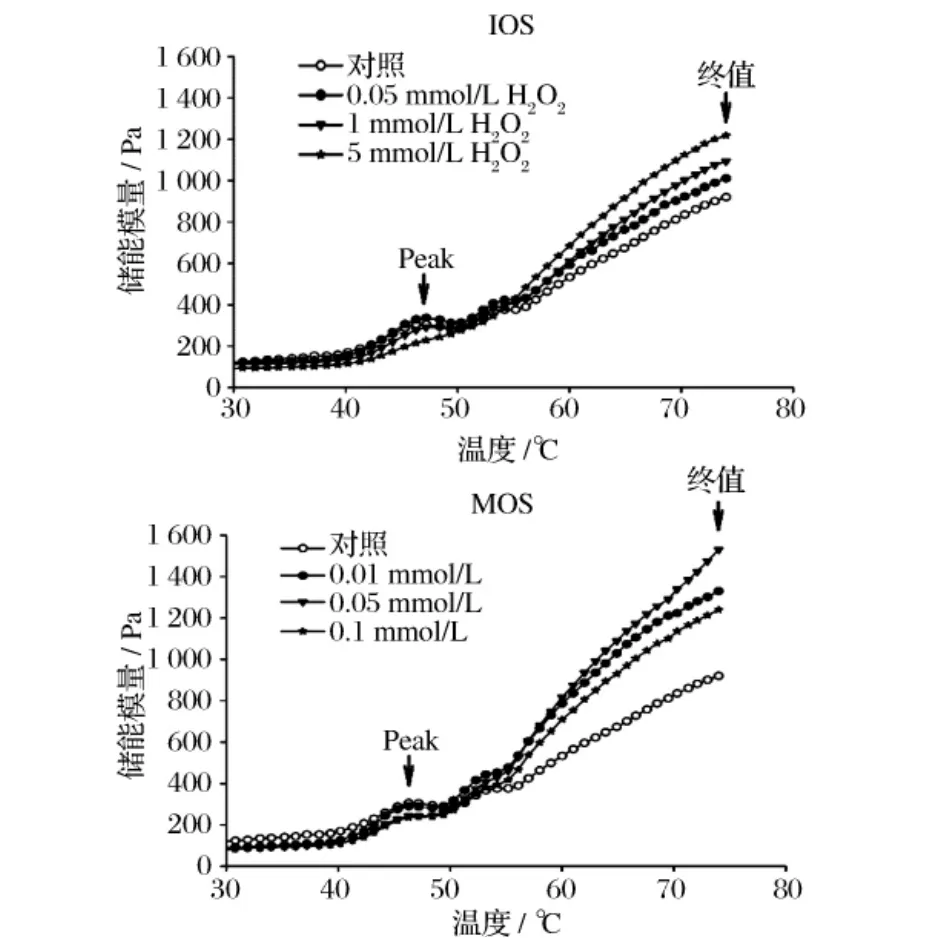
图4 对照组和氧化处理组肌原纤维蛋白热诱导凝胶形成过程中储能模量(G')的变化(n=4)。
但是,也有截然不同的研究结论。Srinivasan等[25]研究了IOS氧化对肉糜乳化能力的影响,发现随着体系中自由基含量的增加,羰基含量增多,巯基含量减少,蛋白质溶解度显著下降,但是乳化活性和乳化稳定性增强(图5);氧化但未经冻融处理组肉糜的EAI指数为24.1,室温下放置80 min后仍然稳定在24左右,而未氧化组的EAI指数为22.8,室温放置后持续降低,80 min时降为9左右。作者根据巯基含量减少推测氧化增强肉糜乳化能力的原因为:氧化的蛋白质分子通过二硫键交联形成大的聚合物,而这种大分子聚合物在油滴表面形成一层稳定的保护膜,起到稳定乳化的作用。而冻融的过程中,原本参与乳化的蛋白质分子的氨基酸侧链会发生化学修饰,导致这些蛋白质的变性和聚集,无法再参与乳化。虽然作者认为该假说可以解释氧化为何能够增强肉糜的乳化能力,但其他文献有关二硫键的研究并不支持该理论,目前对此仍然没有一致的结论。
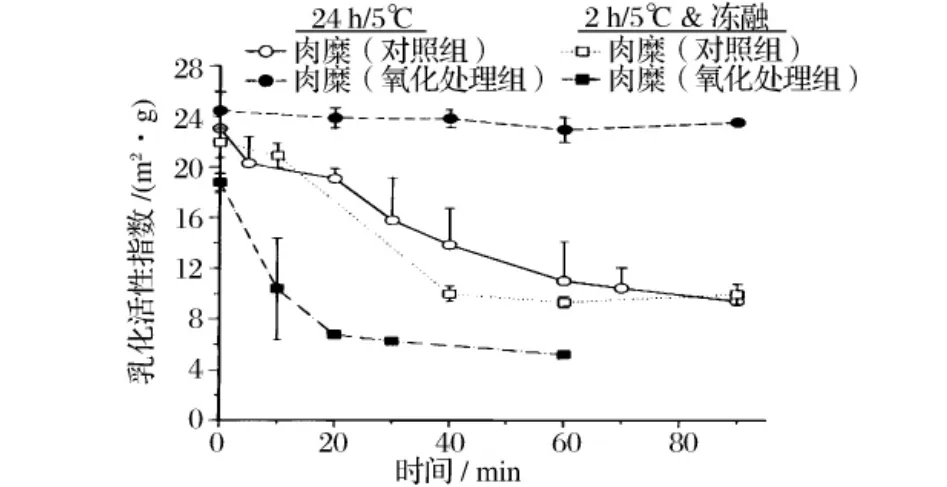
图5 非酶自由基氧化和冻结/解冻处理对水洗肉糜乳化活性指数和乳化稳定性的影响
3 氧化对肌原纤维加工特性产生矛盾作用的原因推测
氧化使溶解的肌原纤维蛋白分子构象发生变化。构象变化会伴随分子内疏水基团、巯基等功能基团暴露,并在加热时形成不同模式的聚集;Ooizumi等[11]认为,适度氧化的肌球蛋白分子加热时会首先发生尾-尾聚集形成低聚体,低聚体之间再以肌球蛋白头部-头部聚集形成凝胶网络结构,导致凝胶弹性增强[18]。因此,构象变化的差异可能是不同氧化程度对肌原纤维蛋白产生不同影响的原因。
蛋白质分子构象变化后,肌原纤维的天然结构被破坏,使其发生溶胀。不同的构象变化导致的肌纤维结构变化不同,因此其溶胀程度也有所差异。Liu等[21]认为,氧化修饰导致Z线弹性的改变,从而改变肌原纤维蛋白的溶胀和I带以及A带的收缩。肌原纤维溶胀是肉糜具有足够保水性和乳化特性的前提,因此,不同氧化程度导致的肌原纤维不同程度的溶胀,也可能是导致加工特性差异显著的原因。
分子间交联是肌原纤维蛋白实现其加工特性的前提。Xiong等[13]认为,肌原纤维蛋白分子间“交联类型”也许比“交联程度”更能影响蛋白质的加工特性。参与凝胶或乳化的主要是疏水作用、二硫键、氢键、离子键、二酪氨酸交联等,不同氧化程度/氧化路径可能会导致蛋白质分子间形成不同类型的交联。此外,氧化程度的差异还可能会导致蛋白质分子不同程度的变性解折叠,分子表面具有加工特性的活性基团的数量和组成比例就会有所差异,因此产生不同的凝胶或乳化等加工特性。但是目前国际上关于此的研究刚刚起步,相关信息还比较少。
尽管有很多推测,但目前的研究并没有阐明适度氧化为什么可以改善或提高肌原纤维蛋白的凝胶、保水、乳化等加工特性,也无法为凝胶&乳化类肉制品行业当前的研究热点—寻找行之有效的抗氧化措施—提供必须的理论指导。氧化对肌原纤维蛋白加工特性的具体影响,仍然需要进一步的研究。
[1] Johns A M,Birkshaw L H,Ledward D A.Catalysts of lipid oxidation in meat products[J].Meat Science,1989,25(3):209-220.
[2] Morzel M,Gatellier P,Sayd T,et al.Chemical oxidation decreases proteolytic susceptibility of skeletal muscle myofibrillar proteins[J].Meat Science,2006,73(3):536 -543.
[3] Astruc T ,Marinova P,Labas R,et al.Detection and localization of oxidized proteins in muscle cells by fluorescence microscopy[J].Journal of Agricultural and Food Chemistry,2007,55(23):9 554 -9 558.
[4] Kjærsgård I V H,Jessen F.Two-Dimensional gel electrophoresis detection of protein oxidation in fresh and tainted rainbow trout muscle[J].Journal of Agricultural and Food Chemistry,2004,52(23):7 101 -7 107.
[5] Liu G,Xiong Y L.Electrophoretic pattern,thermal denaturation,and in vitro digestibility of oxidized myosin[J].Journal of Agricultural and Food Chemistry,2000,48(3):624-630.
[6] Stagsted J,Bendixen E,Andersen H J.Identification of specific oxidatively modified proteins in chicken muscles using a combined immunologic and proteomic approach[J].Journal of Agricultural and Food Chemistry,2004,52(12):3 967-3 974.
[7] Smith,D M.Functional and biochemical changes in deboned turkey due to frozen storage and lipid oxidation[J].Journal of Food Science,1987,52(1):22 -27.
[8] Saeed S,Howell N K.Effect of lipid oxidation and frozen storage on muscle proteins of Atlantic mackerel(Scomber scombrus)[J].Journal of the Science of Food and Agriculture,2002,82(5):579 -589.
[9] Schaich K M,Karel M.Free radical reactions of peroxidizing lipids with amino acids and proteins:an ESR study[J].Lipids,1976,11(5):392 -400.
[10] Park D,Xiong Y L,Alderton A L,et al.Biochemical changes in myofibrillar protein isolates exposed to three oxidizing systems[J].Journal of Agricultural and Food Chemistry,2006,54(12):4 445 -4 451.
[11] OoizumiT,Xiong Y L.Identification of cross-linking site(s)of myosin heavy chains in oxidatively stressed chicken myofibrils[J].Journal of Food Science,2006,71(3):196-199.
[12] Park D,Xiong Y L.Oxidative modification of amino acids in porcine myofibrillar protein isolates exposed to three oxidizing systems[J].Food Chemistry,2007,103:607 -616.
[13] Xiong Y L,Park D,Ooizumi T.Variation in the crosslinking pattern of porcine myofibrillar protein exposed to three oxidative environments[J].Journal of Agricultural and Food Chemistry,2009,57(1):153 -159.
[14] Decker E A,Xiong Y L,Calvert J T,et al.Chemical,physical,and functional properties of oxidized turkey white muscle myofibrillar proteins[J].Journal of Agricultural and Food Chemistry,1993,41(2):186 -189.
[15] Snider D W,Cotterill O J.Hydrogen peroxide oxidation and coagulation of egg white[J].Journal of Food Science,1972,37(4):558 -561.
[16] Wan L,Xiong Y L,Decker E A.Inhibition of oxidation during washing improves the functionality of bovine cardiac myofibrillar protein[J].Journal of Agricultural and Food Chemistry,1993,41(12):2 267 -2 271.
[17] Srinivasan S,Xiong Y L.Gelation of beef heart surimi as affected by antioxidants[J].Journal of Food Science,1996,61(4):707 -711.
[18] Xiong Y L,Blanchard S P,Ooizumi T,et al.Hydroxyl radical and ferryl-generating systems promote gel network formation of myofibrillar protein[J].Journal of Food Science,2010,75(2):215 -221.
[19] Kelleher S D,Hultin H O,Wilhelm K A.Stability of mackerel surimi prepared under lipid-stabilizing processing conditions[J].Journal of Food Science,1994,59(2):269-271.
[20] Bertram H C,Kristensen M,Фstdal H,et al.Does oxidation affect the water functionality of myofibrillar proteins?[J].Journal of Agricultural and Food Chemistry,2007,55(6):2 342 -2 348.
[21] Liu Z,Xiong Y L,Chen J.Identification of restricting factors that inhibit swelling of oxidized myofibrils during brine irrigation[J].Journal of Agricultural and Food Chemistry,2009,57(22):10 999 -11 007.
[22] Smith D M.Factors influencing texture formation in comminuted meats[C].Proceedings-Annual Reciprocal Meat Conference of the American Meat Science Association,Laramie,Wyoming:1988,41:48 -52.
[23] Rodríguez-Carpena J G,Morcuende D,Estévez M.Avocado by-products as inhibitors of color deterioration and lipid and protein oxidation in raw porcine patties subjected to chilled storage[J].Meat Science,Article in Press,doi:10.1016/j.meatsci.2011.04.013.
[24] Ooizumi T,Xiong Y L.Biochemical susceptibility of myosin in chicken myofibrils subjected to hydroxyl radical oxidizing systems[J].Journal of Agricultural and Food Chemistry,2004,52(13):4 303 -4 307.
[25] Srinivasan S,Hultin H O.Chemical,physical,and functional properties of cod proteins modified by a nonenzymic free-radical-generating system[J].Journal of Agricultural and Food Chemistry,1997,45(2):310 -320.
Contradictory Role of Oxidation on Functional Properties of Myofibrillar Proteins
Hu Zhong-liang1,Yan Lu2,Zou Yu-feng1,Xu Xing-lian1
1(Key Laboratory of Meat Products Processing and Quality Control,Ministry of Education,Nanjing Agricultural University,Nanjing 210095,China)
2(College of Food Science and Technology,Nanjing Agricultural University,Nanjing 210095,China)
This paper reviewed the latest research progress on the effects of oxidation on the myofibrillar proteins functional properties,including the oxidation-sensitive and oxidant pathways of muscle proteins,the contradictory role of oxidation on texture,water-holding capacity and emulsifying properties of heat-induced myofibrillar protein-lipid emulsion gels.We also discussed mechanism of the contradictory role through the changes in molecular conformations,fibers/myofibrils structure and chemical interactions between molecules.
myofibrillar protein,oxidation,gel,emulsification,water-holding capacity
硕士研究生(徐幸莲教授为通信作者,E-mail:xlxu@njau.edu.cn)。
*国家自然科学基金资助项目(No.31171707)
2011-06-13,改回日期:2011-09-14

