噻嗪酮降解菌BF3的分离、鉴定及降解特性
李 超,潘荣清,唐超西,闫 新,李顺鹏 (南京农业大学生命科学学院,农业部农业环境微生物工程重点开放实验室,江苏 南京 210095)
噻嗪酮降解菌BF3的分离、鉴定及降解特性
李 超,潘荣清,唐超西,闫 新*,李顺鹏 (南京农业大学生命科学学院,农业部农业环境微生物工程重点开放实验室,江苏 南京 210095)
分离到1株能降解噻嗪酮的细菌BF3,通过生理生化试验和16S rRNA基因同源性序列分析,初步鉴定其属于副球菌属(Paracoccus sp.).该菌在接种量为 2%的条件下,7d内对 50mg/L噻嗪酮的降解率为 68.2%.其最适降解 pH值为 7.0,降解最适温度为 30℃.BF3对低浓度
(1,10,30,50mg/L)的噻嗪酮有较好的降解效果,但对高浓度(100,200mg/L)的噻嗪酮降解效果一般,降解速率与起始接种量呈正相关.需氧量试验表明,BF3在通气良好的状况下降解速率较高.
噻嗪酮;副球菌属;降解特性
噻嗪酮,又称稻虱灵、优乐得,化学名称为2-叔-丁亚氨基-3-异丙基-5-苯基-3,4,5,6-四氢-2H-1,3,5-噻二嗪-4-酮,对酸、碱、光、热稳定[1].噻嗪酮是一种抑制昆虫生长发育的选择性杀虫剂[2],触杀作用较强,有胃毒作用,其作用机制为抑制昆虫几丁质的合成和干扰新陈代谢,从而致使昆虫蜕皮畸形或翅畸形而缓慢死亡[3-5].长期以来,人们普遍认为噻嗪酮在杀死目标害虫的同时,因不伤害益虫而具有很好的防治功效,使其在综合虫害管理方案(IPM)中应用广泛[6-8].然而,近年来的研究证明,残留的噻嗪酮对一些有益昆虫或幼虫有负面影响,如 Smith[9]研究结果表明,残留的噻嗪酮导致了大量幼虫的死亡以及减少了瓢虫进行规模饲养时的产卵量;此外,其他研究也证明了噻嗪酮的残留影响若干种瓢虫和半翅类昆虫的产卵量和孵化[6,9-11].
在中国,噻嗪酮主要用于水稻、茶树、柑橘、蔬菜等农作物的病虫害防治[12],据中国 24种出口日本的蔬菜农残超标研究显示,扁豆和小松菜中噻嗪酮残留量严重超标[13],这不仅影响了农产品的质量,同时还对人们的健康造成影响.因此,如何消除潜在的噻嗪酮残留问题已迫在眉睫.微生物具有繁殖迅速、变异快和代谢途径多样等特点,释放到环境中的农药等异生物大部分被微生物分解,微生物修复被认为是污染物修复的有效手段[14-21].目前还没有关于噻嗪酮微生物降解的报道,本研究从长期施用噻嗪酮的稻田地中分离到1株能够降解噻嗪酮的细菌,对该菌的分类地位及降解特性进行了研究,以期为噻嗪酮的微生物降解提供理论依据,同时为噻嗪酮污染的生物修复打下基础.
1 材料与方法
1.1 培养基与试剂
基础盐培养基(MSM,g/L): NaCl 1.00, NH4NO31.00,K2HPO41.50,KH2PO40.50, MgSO4· 7H2O 0.10.pH值7.0.
LB培养基(g/L):酵母膏 5.00,蛋白胨 10.00, NaCl 5.00(固体加1.5%的琼脂).pH值7.0.
初始降解培养基(g/L):基础盐培养基(MSM),葡萄糖0.50,蛋白胨0.50.
1.2 菌株的分离筛选
取长期施用噻嗪酮的稻田地土壤 5.00g,置于100mL噻嗪酮浓度为50mg/L初始降解培养基中,于30℃、180r/min摇床富集7d,然后每7d以5%的接种量转接到相同的培养基中,转接 3次.然后取0.5mL富集液梯度稀释,取10-5~10-8稀释度的液体各0.1mL,涂布于加有50mg/L噻嗪酮的初始降解培养基固体平板上,30℃培养3~4d后,挑取单菌落接种于含 50mg/L噻嗪酮的初始降解培养基中,30℃、180r/min摇床培养7d,检测其降解效果[22].
1.3 菌株的鉴定
菌株形态及生理生化特性测定参照文献[23]进行.菌株16S rRNA基因的克隆及序列测定和比较参照文献[24-25],提BF3基因组DNA作为模板,进行 16S rRNA基因的扩增.正向引物: 5’-AGAGTTTGATCCTGGCTCAG-3’,反向引物:5’-TACGGCTACCTTGTTACGACTT-3’;25µL体系为:模板1µL, dNTP(25 mmol/L)2µL,引物(1 mmol/L)各 1µL,10×Taq缓冲液 2.5µL,Mg2+(25 mmol/L)1.5µL,Taq 酶 (5U/µL)0.3µL,超 纯 水15.7µL.聚合酶链式反应条件:95℃,5min;94℃, 0.5min; 52℃,1min; 72℃,1min;循环30次,72℃延伸10min.采用PCR产物回收试剂盒回收扩增片段,琼脂糖凝胶电泳检测扩增产物的大小后(1.5kb左右),将其TA克隆并测序,将测序结果通过(http://www.ncbi.nlm.nih.gov)及(http://rdp.cme. msu.edu)上的相关16S rRNA基因序列进行同源性比对分析.
1.4 噻嗪酮提取和检测
样品提取参考文献[26]进行:采用等量萃取法,加入等体积的二氯甲烷进行萃取,用高速旋涡振荡器混合 5min,静置后吸取下层有机相 1mL至1.5mL离心管中,氮气吹至干后,加入0.5mL乙腈溶解样品,待测.
液相色谱分析条件[27]:Waters C18反相柱;流动相:乙腈: 0.1% H3PO4水溶液(体积比为60:40),流速 0.6mL/min;检测波长:245nm;柱温:40℃;进样量20µL.
1.5 菌株培养
从平板上挑取一单菌落,接种于50mL LB液体培养基中,于 30℃,200r/min摇床培养 24~36h后,将菌液离心,用无菌水洗涤2次,再加入无菌水,测定至光密度A600nm≈2.00,用为种子液[28].
1.6 菌体生长量的测定
噻嗪酮在无机盐液体培养基中的溶解度很小,会形成白色沉淀,干扰菌体A600nm值的测定,因此本研究采用稀释涂布法来测量菌株的生长量.
2 结果与讨论
2.1 菌株的分离及其生理生化特性
分离、筛选获得了1株不能利用噻嗪酮为唯一碳源生长的菌株,命名为BF3,该菌株属于革兰氏阴性菌,短杆状.菌落边缘齐整,乳白偏黄色;菌落隆起,呈圆形,不透明,表面光滑.V.P反应阴性,甲基红实验阴性.
2.2 菌株16S rRNA 基因的序列分析
以菌株BF3的基因组DNA为模板,利用细菌 16S rRNA 基因通用引物进行 PCR 扩增,得到长度约为 1.5kb的扩增产物.测序后在GenBank上登录,序列号为FJ593184.根据相似性比对,菌株 BF3分别与 Paracoccus versutus和Paracoccus bengalensis相似性均为100%.目前,细菌分类学家的共识是认为当某2个细菌的16S rRNA的相似性大于 95%时,可将其归为同一属
[29].因此,根据上述相似性比较结果,再结合菌株的生理生化特性将其初步鉴定为副球菌属(Paracoccus sp. ).
2.3 降解培养基的优化

图1 碳源对BF3生长与其对噻嗪酮降解的影响Fig.1 Effect of carbon source on growth and degradation of BF3

图2 氮源对BF3生长与其降解噻嗪酮的影响Fig.2 Effect of nitrogen source on growth and degradation of BF3
分别以可溶性淀粉、牛肉膏、乳糖、蔗糖、葡萄糖、麦芽糖、柠檬酸钠代替初始降解培养基中的碳源,质量浓度为 0.50g/L.在噻嗪酮浓度为50mg/L的条件下接入 2%种子液,于 30℃、180r/min条件下培养24h后用吸光度法测定菌浓度,并用液相检测噻嗪酮的浓度,计算降解率,绘图(图1).再分别以蛋白胨、硫酸铵、硝酸铵、酵母膏、脲素代替初始降解培养基中的氮源,质量浓度为0.50g/L.方法同上(图2).不同碳、氮源对菌株BF3生长与降解的影响见图1和图2.由图1可见,在使用牛肉膏为碳源时,A600nm值最大,即菌浓度最高,同时降解率最高,所以选用牛肉膏作为发酵培养基中最佳碳源.由图2可知,菌株BF3以蛋白胨为氮源时菌浓度最高,且降解效果最好,因此试验选用蛋白胨作为培养基中的最佳氮源.最终的降解培养基(g/L):NH4NO31.00, K2HPO41.50, KH2PO40.50, MgSO4·7H2O 0.20, NaCl 0.50,牛肉膏0.50,蛋白胨0.50.pH值7.0.
2.4 菌株生长和噻嗪酮降解的关系
在噻嗪酮终浓度为 50mg/L降解培养基中,接入2%种子液,于30℃、180r/min摇床培养,每隔1d取样分析培养液中噻嗪酮浓度和菌体的生长量,绘制降解曲线.从图3中可见,菌株BF3能够有效地降解噻嗪酮,7d内对噻嗪酮的降解率达68.2%.菌体在最初的 1d内,虽然生长缓慢,但噻嗪酮已被迅速降解;在2~6d内,菌体迅速生长并达到稳定期,这一阶段降解速率也逐渐变慢;6d以后细胞进入衰亡期,同时降解率达到最大值,不再变化.推断可能是在降解后期产生了相关的代谢产物,反馈抑制了BF3对噻嗪酮的降解.
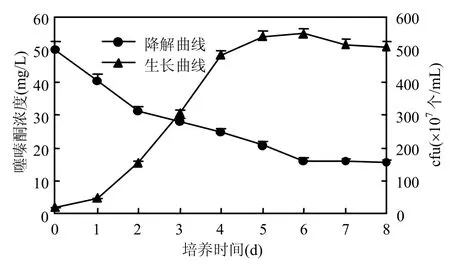
图3 BF3的生长与噻嗪酮降解率的关系曲线Fig.3 The relationship between the growth of BF3 and its ability to remove buprofezin
2.5 初始浓度对BF3降解噻嗪酮的影响
在降解培养基中加入噻嗪酮使其终浓度分别为 1,10,30,50,100,200mg/L.接入 2%种子液,于30℃、180r/min摇床培养,每隔1d取样一次,测定噻嗪酮的残留量.从图4的结果可见,BF3对低浓度(1,10,30,50mg/L)的噻嗪酮有较好的降解效果,对高浓度(100,200mg/L)的噻嗪酮降解效果一般.BF3可以将1mg/L和10mg/L的噻嗪酮在7天内完全降解,但随着噻嗪酮初始浓度的增加,降解率逐渐降低,这是由于在相同条件下,高浓度的噻嗪酮经降解产生了比低浓度噻嗪酮更多的相关代谢产物,更早的产生反馈抑制作用,因此降解率下降.

图4 噻嗪酮初始浓度对BF3降解噻嗪酮的影响Fig.4 Effect of initial buprofezin concentration on its degradation by strain BF3
2.6 温度对BF3降解噻嗪酮的影响
在噻嗪酮终浓度为 50mg/L降解培养基中,接入2%种子液,分别在15,20,25,30,37℃温度下,于180r/min摇床培养,每隔1d取样一次,测定噻嗪酮的残留量.由图5可知,温度对噻嗪酮降解影响较显著.BF3在30℃条件下、7d内能将噻嗪酮降解68.2%;在15,20,25,37℃条件下,7d内的降解率分别为19.5%、39.5%、50.0%、47.1%.该数据表明,不同的温度下BF3对农药的降解效果相差较大,但在30℃时,降解效果最好.
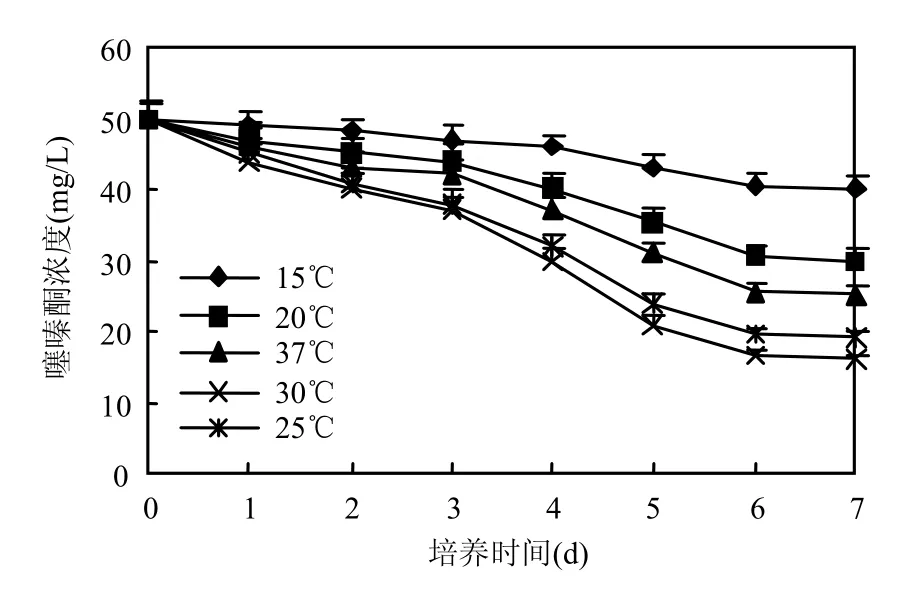
图5 温度对BF3噻嗪酮降解的影响Fig.5 Effect of temperature on buprofezin degradation by strain BF3
2.7 pH值对BF3降解噻嗪酮的影响
在噻嗪酮终浓度为 50mg/L降解培养基中,接入2%种子液,设定pH值为5.0,6.0,7.0,8.0,9.0, 10.0,于30℃、180r/min摇床培养,每隔1d取样一次,测定噻嗪酮的残留量.由图6可知,当pH值为7.0时,BF3对噻嗪酮的降解率最高;当pH>7.0时,其降解率随着 pH值的升高呈明显的下降趋势;当pH值为10.0时,噻嗪酮的降解率仅为10.2%.此外,在酸性的环境条件下,噻嗪酮的降解率也有所下降,当pH5.0时,噻嗪酮的降解率为38.0%.这可能是由于过酸过碱条件都不利于BF3的生长.

图6 pH值对BF3降解噻嗪酮的影响Fig.6 Effect of pH value on buprofezin degradation by strain BF3
2.8 接种量对BF3降解噻嗪酮的影响
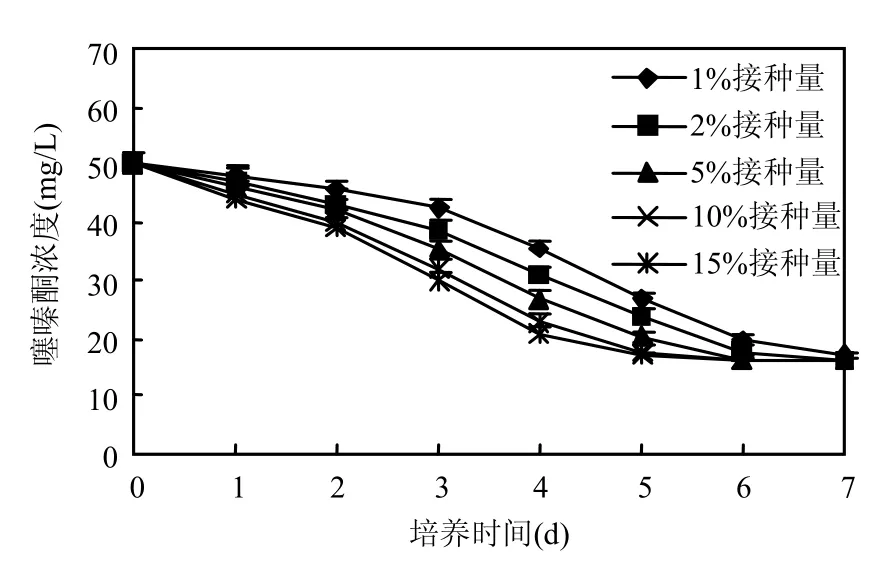
图7 接种量对BF3降解噻嗪酮的影响Fig.7 Effect of inoculation on buprofezin degradation by strain BF3
在噻嗪酮终浓度为 50mg/L降解培养基中,以1%,2%,5%,10%,15%的接种量接入2%种子液,于30℃、180r/min摇床培养,每隔1d取样一次,测定噻嗪酮的残留量.由图7可知,随着接种量的增大,噻嗪酮的降解速率逐渐加快,且和起始接种量呈正相关.这是因为接种量越大,菌体就会产生更多相关的降解酶,从而加快了降解速率,但与此同时,由于存在反馈抑制作用,当代谢产物达到一定数量时降解被抑制,最终降解率达到稳定值.
2.9 通气量对菌株BF3降解噻嗪酮的影响
在 250mL三角瓶中分别加入 30,70,120, 150mL降解培养基,pH值为7.0,加入噻嗪酮使其浓度为 50mg/L,再接入 2%种子液,在 30℃、180r/min条件下振荡培养,每隔1d取样一次并测定噻嗪酮的残留量.由图8可知,在培养7d后,装液量为30mL时噻嗪酮的降解率最高,为68.2%;装液量为150mL的降解率最低,为45.0%.装液量为70mL和120ml的差别不大,降解率均在60%左右.在通气量较好,即装液量较少时,BF3降解噻嗪酮的速率比在通气量较低时稍高,但差异不是很显著.推断可能是在通气量较低时,三角瓶内空间相对较小,对菌体的供氧不足,抑制了菌体的生长,而导致了降解速率的下降.

图8 通气量对BF3降解噻嗪酮的影响Fig.8 Effect of ventilation on buprofezin degradation by strain BF3
3 结论
3.1 分离到一株噻嗪酮降解菌,经生理生化实验及16S rRNA基因序列比对,确定该菌为副球菌(Paracoccus sp.),命名为BF3.
3.2 BF3不能利用噻嗪酮为唯一碳源,需加入外源碳源.其降解噻嗪酮的最适pH值为7.0,最适温度为 30℃,在接种量为 2%时对噻嗪酮的降解效果较好,降解噻嗪酮的速率和起始接种量呈正相关,降解速率随着通气量的提高而加快.BF3对低浓度(1,10,30,50mg/L)的噻嗪酮有较好的降解效果,但对高浓度(100,200mg/L)的噻嗪酮降解效果一般.
[1] 朱永和,王振荣,李布清.农药大典 [M]. 北京:中国三峡出版社, 2006:355-356.
[2] Tomlin C D S, The pesticides manual [Z]. 13th ed. British crop protection council. Alton, Hants, UK, 2003.
[3] Statewide integrated pest management program: Grape vine mealybug. [EB/OL]. UC IPM. Available: http://www.ipm.ucdavis. edu/PMG/r302301911.html, 2008-04-18
[4] Walton V M, Daane K M, Bentley W J, et al. Pheromone-based mating disruption of Planococcusfcus (Hemiptera: Pseudococcidae) in California vineyards [J]. J. Econ. Entomol., 2006,99:1280-1290.
[5] 朱良天编.农药 [M]. 北京:化学工业出版社, 2004:183.
[6] James D G. Effects of buprofezin on survival of immature stages of Harmonia axyridis, Stethorus punctum picipes (Cole-optera: Coccinellidae), Orius tristicolor (Hemiptera: Anthocoridae), and Geocoris spp. (Hemiptera: Geocoridae) [J]. J. Econ. Entomol., 2004, 97:900-904.
[7] Gerling D. Sinai Buprofezin effects on two parasitoid species of whitefy (Hemiptera: Anthocoridae) [J]. J. Econ. Entomol., 1994, 87:842-846.
[8] Nagate T. Timing of buprofezin for control of the brown planthopper, Nilaparvata lugens Stal (Homoptera: Delphacidae) [J]. Appl. Entomol. Zool., 1986,21:357-362.
[9] Smith D. Effects of the insect growth regulator, buprofezin, against citrus pests Coccus viridis (Green), Polyphagotarsonemus latus (Banks) and Aonidiella aurantii (Maskell) and the predatory coccinellid Chilocorus circumdatus Gyllenhal [J]. Plant Prot. Q., 1995,10:112-115.
[10] Grafton-Cardwell E E, Gu P. Conserving vedalia beetle, Rodolia cardinalis (Mulsant) (Coleoptera: Coccinellidae) in citrus: A continuing challenge as new insecticides gain registration [J]. J. Econ. Entomol., 2003,96:1388-1398.
[11] Magagula C N, Samways M J. Effects of insect growth regulators on Chilocorus nigritus (Fabricius) (Coleoptera: Coc-cinellidae), a non-target enemy of citrus red scale, Aonidiellaaurantii (Maskell) (Homoptera: Diaspididae), in southern Africa: Evidence from laboratory and feld trials [J]. Afr. Entomol., 2000,8:47-56.
[12] HG2463噻嗪酮原药 [S].
[13] 孙彩霞,徐俊锋,董国堃.中国 24种出口蔬菜农残超标研究 [J].中国农学通报, 2009,25(08):262-265.
[14] 王 堃,王志春,李 荣,等.乐果降解菌 L3的分离、鉴定及降解性能 [J]. 中国环境科学, 2008,28(11):994-998.
[15] Rani N L, Lalithakumari D. Degradation of methylparathion by Pseudomonas putida [J]. Can. J. Microbiol., 1994,40(11):1000-1006.
[16] 郑金伟,何 健, 王 哲,等.苯醚甲环唑降解菌 B2的分离、鉴定及其降解特性 [J]. 中国环境科学, 2009,29(1):42-46.
[17] Parekh N R, Suett D L, Roberts S J, et al. Carbofuran-degrading bacteria from previously treated field soils [J]. J. Appl. Bacteriol., 1994,76(3):559-567.
[18] Feng X, Ou L T, Ogram A. Plasmid-mediated mineralizaton of carbofuran by Sphingomonas sp. strain CF06 [J]. Appl. Environ. Microbiol., 1997,63(4):1332-1337.
[19] Wang X, Li B, Herman P L, et al. A three-component enzyme system catalyzes the demethylation of the herbicide dicamba in Pseudomonas maltophilia DI-6 [J]. Appl. Environ. Microbiol., 1997,63(4):1623-1626.
[20] Struthers J K, Jayachandram K, Moorman T B. Biodegradation of atrazine by Agrobacterium radiobacter J14a and use of this strain in bioremediation of contaminated soil [J]. Appl. Environ. Microbiol., 1998,64(9):3368-3375.
[21] 李蒙英,张 迹,陆 鹏,等.3,5-二硝基苯甲酸降解菌A3的分离及降解特性 [J]. 中国环境科学, 2007,27(1):106-110.
[22] HU Z, WU Y R, XU Y, et al. Screening of a Marine Phenol-degrading Yeast Candida sp. P5 and its Biodegradation Characteristics [J]. Chin. J. Appl. Environ. Biol., 2007,13(2): 243-247.
[23] 东秀珠,蔡妙英.常见细菌系统鉴定手册 [M]. 北京: 科学出版社, 2001:370-410.
[24] 奥斯伯F,布伦特R, 金斯顿R E.精编分子生物学实验指南 [M].北京:科学出版社, 1999:39-40.
[25] Julian R M, Takuichi S, Andrew J W, et al. Design and evaluation of useful bacterium-specific PCR primers that amplify genes coding for bacterial 16S rRNA [J]. Appl. Environ. Microbiol., 1998,64(2):795-799.
[26] 余培建.高效液相色谱法检测底泥中孔雀石绿及其代谢物 [J].化学分析计量, 2007,16(2):27-29.
[27] 汤富彬,楼正云,刘光明,等.高效液相色谱法测定茶叶中噻嗪酮的残留量 [J]. 分析测试技术和方法, 2006(3):66-67.
[28] 范秀容,李广武,沈 萍.微生物学实验 [M]. 北京:高等教育出版社, 1988:75-78.
[29] 杨苏声.细菌分类学 [M]. 北京:中国农业出版社, 1997:1-7.
Isolation, identification and characterization of a buprofezin-degrading bacterium BF3.
LI Chao, PAN Rong-qing, TANG Chao-xi, YAN Xin*, LI Shun-peng(Key Laboratory of Microbiological Engineering Agricultural Environment, Ministry of Agriculture, College of Life Science, Nanjing Agricultural University, Nanjing 210095, China). China Environmental Science, 2011,31(6):965~970
A buprofezin-degrading bacterium BF3 was isolated for the first time in this work. Through biochemicalphysiological identification and the analysis of its 16S rRNA gene sequence, BF3 was identified preliminarily as Paracoccus sp.. BF3 could degrade 68.2% of 50mg/L buprofezin in 7 days. The most adaptable pH and temperature for the degradation were 7.0 and 30℃, respectively. BF3 had a better degradation effect at low concentrations (1,10,30,50mg/L) of buprofezin and the degradation rate was related positively to initial inoculation amount. The oxygen consumption experiment showed that the buprofezin degradation rate of good ventilation state was higher than that at relatively poor ventilation state.
buprofezin;Paracoccus sp;degradation
X172
A
1000-6923(2011)06-0965-06
2010-10-02
江苏省科技支撑计划(BE2009670)
* 责任作者, 讲师, yanxin@njau.edu.cn
李 超(1986-),男,安徽无为人,南京农业大学生命科学学院硕士研究生,主要从事农药降解菌的分离及土壤的生物修复研究.

