大花萱草不同外植体初代培养的比较研究
柏文琴,闫桂琴,李瑞艳,于志辉
(山西师范大学生命科学学院,山西 临汾 041004)
大花萱草为百合科(Liliaceae)萱草属(HemerocallisL.)多年生宿根草本,又叫多倍体萱草(HemetocallisfulvaVar.florepleno),具短根状茎和肉质肥厚的纺锤状块根.叶基生,条形排成两列,长度、宽度依品种不同而有差别.花葶粗壮,螺旋状聚伞花序,着花数十朵,花冠漏斗状,单朵花仅开1天,但一花开完它花继放,花期长,花期在5-10月,依品种不同而不同.大花萱草具有较强的抗旱、抗寒、抗盐碱、抗病虫害、耐半荫等特性.大花萱草可丛植于草坪中或于花坛、路旁栽植,是理想的观花赏叶的地被植物.另外,大花萱草也是优良环保植物,对二氧化硫有较强的抗性[1].
大花萱草结实率低,一般不采用种子繁殖,而是采用分蘖等无性繁殖方式进行增殖.但由于其速度慢,一般一株大花萱草每年仅可繁殖3~4株,个别品种每年繁殖1~2株,因而难以适应市场商品化生产的需求.利用植物组织培养技术是解决大花萱草大量繁殖的最有效途径.此外,组织培养技术也为大花萱草的品种选育提供了技术基础.而初代培养是组织培养技术中的首要环节,前人对于大花萱草组织培养虽有研究[2-7],但在初代培养这一环节缺乏系统的研究,而且不同品种、不同外植体得出的结论差异很大.本试验选用大花萱草新品种“baltimore oriole”的7种不同外植体进行诱导的比较研究,以期筛选出较适宜的外植体材料与激素浓度及配比,为大花萱草快速繁殖提供依据.
1 材料与方法
1.1材料美国进口的大花萱草新品种“baltimore oriole”.
1.2 研究方法
1.2.1 外植体选择及处理 选取生长健康、无病虫害的大花萱草新品种“baltimore oriole”的叶片、根段、茎尖、花茎、花托、花瓣和子房7种外植体,用洗洁精清洗干净后,用流水冲洗,75%乙醇处理30 s,0.1% HgCl2处理10 min(根和茎尖处理时间相应延长),蒸馏水冲洗7~8次.灭菌处理后,叶片和花瓣,切成1 cm×1 cm大小;根和幼嫩花茎取0.5 cm长;花托切成0.5 cm×0.5 cm大小;茎尖切成0.5 cm×0.5 cm×0.5 cm大小;子房一切为二.将处理好的外植体分别接入表1培养基中培养.
1.2.2 初代培养的培养基 根据Heuser的报道[8],选用MS培养基作为基本培养基[9],同时参阅前人有关萱草及其同属、同科植物的愈伤组织的培养基配方[2-7],以及预试验的基础上,设计了5种激素组合进行试验(见表1),每种培养基中均含有3%蔗糖,琼脂0.6%,pH调至5.8~6.0.

表1 愈伤组织诱导培养基
1.2.3 继代培养基 将茎尖诱导的丛生芽、花托、花茎和子房诱导的愈伤组织切成小块接种到各自初代培养的最佳培养基中进行培养,以考察初代培养物继续生长状况.
1.2.4 培养条件 25 ℃恒温培养,每天光照12 h,光照强度为2 000~2 500 lx.
2 结果与分析
2.1 不同外植体初代培养结果及分析
2.1.1 叶片、花瓣和根段初代诱导结果 叶片和花瓣在5种培养基上的生长情况相似,仅有面积的扩大,而无愈伤组织产生,30 d后,均干枯死亡.根段经过一段时间培养同样干枯死亡.说明叶片、花瓣和根段不适宜作为大花萱草初代培养的外植体.
2.1.2 茎尖初代诱导结果 茎尖经过30 d的培养,在5种培养基中均出现两种情况:一种是茎尖直接长出独苗,苗子浓绿,粗壮(见图1);另一种是一个茎尖长出2个甚至多个丛生芽,颜色略黄,较弱(见图2).两种情况都很少产生愈伤组织.不同的激素组合对茎尖产生的丛生芽数有很大的影响(见表2).
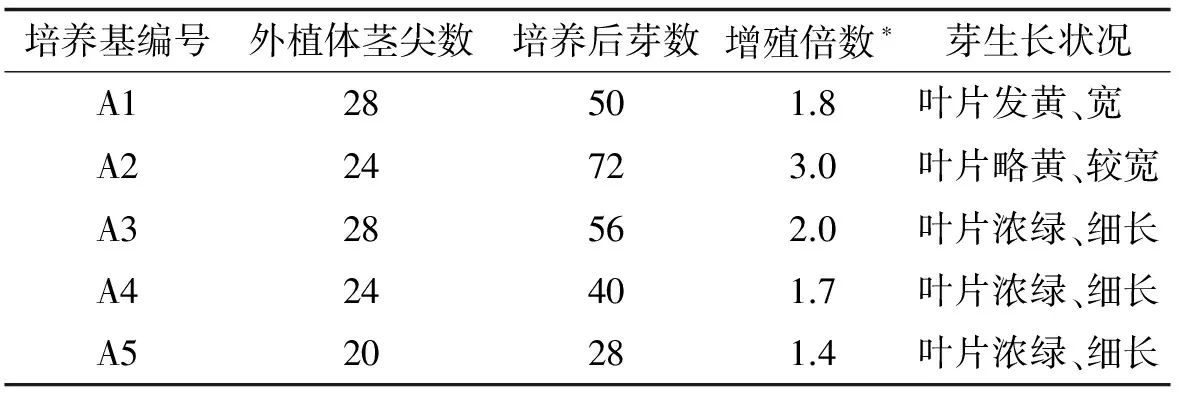
表2 茎尖在不同培养基中芽增殖结果
*增殖倍数=培养后芽数/外植体茎尖数
其中在A2培养基中芽增值倍数最高,为3.0,而在A5培养基中芽增殖倍数最低,仅1.4.说明茎尖是较适宜的初代培养外植体,合适的细胞分裂素和生长素浓度(6-BA浓度为2 mg/L,NAA浓度为0.2 mg/L)及比例(10/1)有利于诱导茎尖产生丛生芽.
2.1.3 花茎的愈伤组织诱导 花茎培养2周左右,与培养基接触部位开始膨大,4周左右长出大量愈伤组织(见图3),并有少量芽点,5周左右愈伤组织分化出大量芽(见图4).花茎在5种培养基中均能诱导形成质地紧密、淡黄绿色的愈伤组织.但不同的激素组合对愈伤组织的诱导率有很大的影响.在A1、A2、A3、A4和A5中愈伤组织的诱导率分别为29.4%、66.7%、23.5%、17.8%和86.7%,在A5培养基中诱导率最高,而在A4培养基中愈伤组织的诱导率最低.说明花茎是初代培养较适宜的外植体,合适的细胞分裂素和生长素浓度(6-BA浓度为0.5 mg/L,NAA浓度为0.1 mg/L)及比例(5/1)有利于诱导花茎产生愈伤组织.

图1 茎尖萌发独苗

图2 茎尖长出丛生芽
2.1.4 子房和花托的愈伤组织诱导 子房和花托在5种培养基中1周左右开始膨大,但是很难形成愈伤组织,子房只在A3和A4培养基中有愈伤产生(见图5),诱导率分别为40%和20%.花托只在A3培养基中有愈伤产生,诱导率为29.4%,愈伤组织水浸状、且质地疏松(见图6),其余培养基中只有膨大而无愈伤组织,随着培养时间的延长,膨大的子房和花托逐渐干枯死亡.因此,虽然子房和花托外植体可以诱导产生愈伤组织,但是从诱导率和愈伤组织形态分析可知,子房和花托不适宜作为大花萱草初代培养的外植体.

图3 花茎上诱导产生大量愈伤

图4 愈伤组织上分化出芽
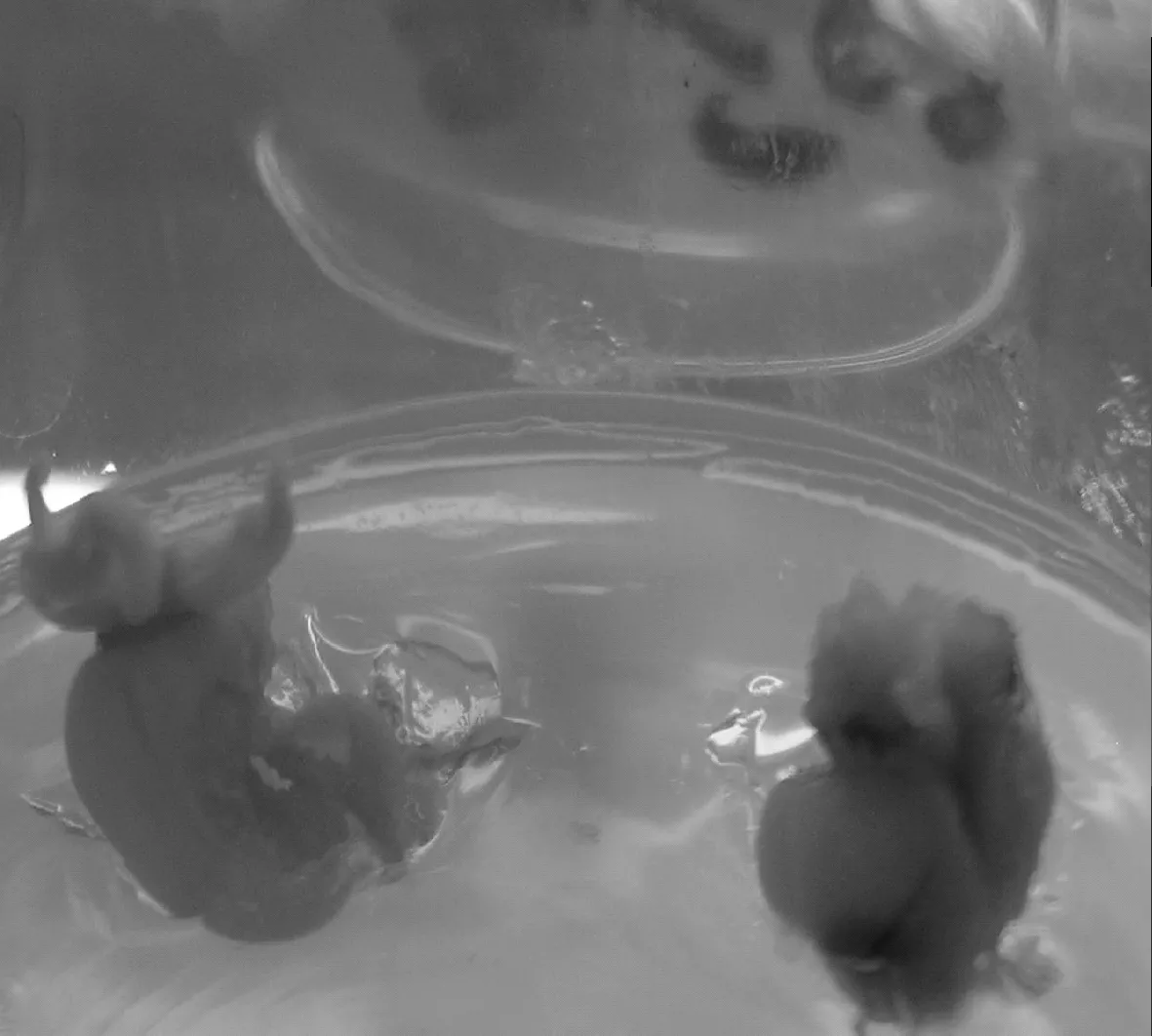
图5 子房诱导产生愈伤组织

图6 花托诱导产生愈伤组织
2.2愈伤组织及芽的继代培养将花茎、子房和花托诱导产生的愈伤组织切成合适大小接种到继代培养基中,子房和花托产生的愈伤组织在培养过程中逐渐死亡,而花茎诱导的愈伤组织接种到继代培养基后,愈伤组织不断增加,上面的芽点逐渐长成一株株小苗,且不断分化产生新的不定芽,每块愈伤组织上约有4~5个芽(见图7).茎尖诱导的芽在继代培养基中不产生愈伤组织,只继续产生丛生芽(见图8),但是芽的增殖倍数不高,每个周期约3倍左右.从继代培养结果可以进一步证实茎尖和花茎是大花萱草初代培养的较适宜的外植体.

图7 愈伤组织诱导出芽

图8 芽诱导产生丛生芽
3 讨论
植物愈伤组织的诱导主要受外植体本身、培养基和培养环境三大因素的调控.不同植物的器官和组织,其形态发生能力大不相同,即使同种植物不同外植体,所需要的营养和外源激素的浓度及比例也不相同,原因可能是由于它们的生理状态和所处的生育时期不同,其内源激素浓度和比例不同[10].因此在初代培养中选择合适的外植体和适宜的激素浓度及比例是非常重要的.
茎尖是植物顶端的原生分生组织和它衍生的分生组织,具有非常旺盛的细胞分裂能力和很强的生命力.大花萱草新品种“baltimore oriole”的茎尖,在含2 mg/L 6-BA 和0.2 mg/L NAA的MS中,会形成丛生芽,增殖倍数达3.将丛生芽切割成几份新的外植体,接入相同培养基中进行增殖培养.这种繁殖方式产生的芽遗传性状稳定,是大花萱草快速繁殖的一种有效途径[11].缺点是茎尖的剥离困难,而且损坏花苗,且由于与土壤接触,叶片层层包裹,不易彻底灭菌,因而初代培养中污染率很高.因此,当繁殖优良性状的品种且有一定数量的种质资源时,可选择茎尖为外植体.
植物叶片、子房、花药、胚珠、叶柄等成熟组织经过恢复分生能力,诱导出愈伤组织,再从愈伤组织诱导不定芽.这种分化类型可能会发生变异,用于良种繁殖时应注意[8].本实验选用叶片、根段、花茎、花托、花瓣和子房这几种成熟组织进行愈伤组织的诱导,结果表明不同成熟外植体诱导愈伤组织的能力不同,叶片、根段和花瓣,在5种培养基中难以诱导出愈伤组织,随着培养时间延长,逐渐干枯死亡.花托和子房虽有一定数量的愈伤组织,但是诱导率很低,且在随后的继代培养中逐渐干枯死亡.花茎在0.5 mg/L 6-BA 和0.1 mg/L NAA的MS中,愈伤组织的诱导率最高,达到86.7%,而且继代培养中愈伤组织全部能分化产生不定芽,每块愈伤组织上平均有4~5个芽.因此,可以选用花茎作为大花萱草“baltimore oriole”繁殖的外植体,但是存在缺点:一是取材时间受限制,只能选择每年的花期,而且要求花茎处于幼嫩阶段;二是经过愈伤组织阶段,有变异的可能性.
因此,大花萱草“baltimore oriole”初代培养时,可根据实际情况,选择花茎或茎尖作为外植体.不同外植体所需激素浓度和配比不同,花茎作为外植体较适宜的激素浓度是0.5 mg/L 6-BA 和0.1 mg/L NAA,茎尖作为外植体较适宜的激素浓度是2 mg/L 6-BA 和0.2 mg/L NAA.
[1] 储博彦,赵玉芬,牛三义,等.大花萱草品种介绍及栽培管理技术[J].河北林业科技,2006,10(5):60-61.
[2] 王晓娟,金樑,陈家宽.大花萱草不同外植体诱导愈伤组织的比较研究[J].生命科学研究,2005,9(3): 242-246.
[3] 解有利,陈兰芬,石进朝.大花萱草组织培养研究[J].北京农业职业学院学报,2007,21(5):25-27.
[4] 周南镚,黄一青,范林浩,等.大花萱草的组织培养与植株再生[J].安徽农学通报,2006,12(6):157.
[5] 赵玉芬,储博彦,尹新彦,等.大花萱草工厂化快繁技术研究[J].园艺学报,2011,(2):152-155.
[6] 李艳梅,王桂兰,陈超,等.大花萱草新品种“红运”快繁体系的建立[J].河南农业科学,2006,(8):120-122.
[7] 刘志洋,李海涛,朱祥春,等.大花萱草组织培养研究[J].东北农业大学学报,2008,39(1): 43-45.
[8] Heuser C W,Apps D A. In vitro plantlet formation from flower petal explants ofHemerocalliscv. “Chipper Cherry”[J].Can J Bot,1976,54:616-618.
[9] Murashige T,Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue culture[J].Physiol Plant,1962,15:473-497.
[10] 周维燕.植物细胞工程原理与技术[M].北京:中国农业大学出版社,2001: 76-77.
[11] 熊丽,吴丽芳.观赏花卉的组织培养与大规模生产[M].北京:化学工业出版社,2002:12-31.

