一株具有羽毛降解活性的益生菌的筛选和应用
龚一轩,张桂敏,马立新
(湖北大学生命科学学院,湖北 武汉 430062)
羽毛是鸟类和禽类表皮细胞角质化的衍生物,其中蛋白质含量高达90%[1].动物的大量消费产生许多羽毛废弃物,传统处理方法主要为填埋、焚烧,造成了羽毛蛋白资源的浪费.羽毛中蛋白主要是角蛋白,因含大量二硫键,交联成复杂的三维网状结构,具有良好的稳定性和难溶性,在一般自然环境中很难将其降解[2].目前羽毛的降解并再利用的途径有物理降解法、化学降解法、酶降解法和微生物降解法[3].尽管物理、化学方法研究较早,但存在破坏氨基酸结构、产物单一以及产物稳定性差等缺点[4].用化学法更是会在生产中产生大量的盐使产品适口感较差[5].目前羽毛降解用酶因为表达量低[6-7]、生产成本过高、降解效率低等原因尚未工业化应用,利用微生物对废弃羽毛进行降解便成为一种较为合适的选择.利用微生物来降解废弃羽毛已有很多报道[8-10],但是这些微生物降解羽毛产生的小肽也大多被微生物自身所利用,如果降解菌株不是有用的菌体,那么这些羽毛蛋白还是被白白浪费掉.也有从羽毛腐烂物中分离到地衣芽孢杆菌降解羽毛的报道[11],但是,环境中分离的地衣芽孢杆菌也需要做一系列的安全性评价,才能作为安全微生物用于生产.
益生菌可调整菌群失调达到防病的目的,可促使机体产生抗菌活性物质、杀灭致病菌,而且益生菌产生的抗活性物质,具有独特的生物夺氧作用机制,能抑制致病菌的生长繁殖[12].但目前尚少见利用益生菌降解废弃羽毛并获得益生菌产品的报道.本实验从市售的益生菌中筛选出能高效降解羽毛的地衣芽孢杆菌,从羽毛的前处理、接种量、培养基的成分、发酵时间及产物成分多角度优化羽毛降解工艺,得到一种利用益生菌高效降解羽毛获得菌肽新型饲料添加剂的工艺流程.
1 材料与方法
1.1供试材料市售益生菌;羽毛,由菜场收购;LB液体培养基:0.5%酵母粉(质量分数,全文同),1%蛋白胨,1%NaCl,水;羽毛筛选培养基:2%羽毛,1%NaCl,水;优化羽毛发酵培养基:2%羽毛,0.3%硝酸钾,0.1%磷酸氢二钾,0.06%磷酸二氢钾,0.04%六水氯化镁,0.5% NaCl,0.1%山梨醇,水[10].
1.2 实验方法
1.2.1 菌种的筛选 选购4种市售的单一益生菌,分别为:苏柯汉牌的短小芽孢杆菌、苏柯汉牌的乳酸菌、动物饲料添加剂牌的枯草芽孢杆菌及科诺公司生产的地衣芽孢杆菌,并将其编号为HUBM1、HUBM2、HUBM3、HUBM4.将上述4种产品溶于无菌水,并分别在固体LB平板上分区划线活化并获得单菌落.次日,挑单菌落接种至250 mL锥形瓶中,瓶内含50 mL羽毛筛选培养基,在37 ℃,200 r/min的条件下摇瓶发酵,观察对比这些菌株发酵降解羽毛的效果,挑选出降解羽毛效率最高的菌株.
1.2.2 菌株的鉴定 抽提该菌染色体DNA,并以该DNA为模板,利用正向引物:27F (5′-AGAGTTTGATCCTGGCT)和反向引物1492R(5′-ACGGCTACCTTGTTACGACTT-3′),进行PCR反应,反应条件为:94 ℃,5 min;94 ℃,30 s,58 ℃,30 s,72 ℃,1 min 30 s;72 ℃,7 min.将PCR产物胶内回收送出测序,测序结果通过BLAST同源比对[13]鉴定菌种.
1.2.3 羽毛最适预处理方法研究 分别用4种方法处理同一批羽毛,A为羽毛经粉碎处理;B为羽毛用121 ℃高温处理30 min;C为羽毛在0.02%NaOH溶液中沸水浴15 min;D为羽毛同时经过0.02%NaOH沸水浴15 min及121 ℃高温处理30 min.用这4种经过不同预处理的羽毛分别配制成羽毛筛选培养基.接入HUBM2,并在37 ℃,200 r/min的条件下摇床发酵,观察羽毛降解效果.
1.2.4 摇瓶发酵培养基的优化 在250 mL的锥形瓶中分别配制100 mL的羽毛筛选培养基(A)、LB培养基+2%羽毛(B)和优化羽毛发酵培养基(C),接种菌株HUBM2,在37 ℃,200 r/min的条件下培养,观察各培养基羽毛的状态,测定菌体的变化量、羽毛降解率及可溶性蛋白和小肽含量.
1.2.5 最佳接种量的优化 接种一环HUBM2于100 mL LB培养基中,37 ℃,200 r/min的条件下摇瓶发酵12 h,做为种子液.配制4瓶100 mL羽毛筛选培养基于250 mL锥形瓶中,将上述种子液分别按5%、10%、15%、20%的菌液接种.其中5%和10%比例的采用菌液接种,直接接种种子液于羽毛发酵培养基;15%和20%比例的采用菌体接种,是将菌液收集至50 mL灭菌离心管,5 000 r/min离心8 min后弃上清将菌体沉淀接种至羽毛筛选培养基.将接种好的培养基置于37 ℃,200 r/min的条件下培养,观察培养基形态变化.
1.2.6 最大降解率的测定 用电子天平称量滤纸质量m1.将最佳效果的摇瓶培养的羽毛发酵液稀释3倍,用玻璃棒引流至装了之前称量的滤纸的漏斗中.在此过程中不断往漏斗中加水稀释,并用玻璃棒搅拌,确保菌体和残余羽毛能够完全分离.待全部发酵液过滤完后,将滤纸连同滤渣一同放入60 ℃烘箱内烘干至质量不再减少,称得总质量m2.培养基中添加羽毛的总含量为m3.羽毛降解率按公式:降解率P=1-(m2-m1)÷m3×100%计算.
1.2.7 益生菌活菌数的测定 分别取1 mL接种后的培养基和发酵结束后的发酵液,编号A、B.采用平板稀释菌落计数法,将A、B液分别用无菌水进行10倍的梯度稀释至10-5~10-7.将每个稀释度分别取100 μL涂布两块LB平板,放入37 ℃培养过夜.次日统计每块平板的菌体数,取菌体数在30~200个之间的平板为有效样品,求平均菌体数.最后根据梯度稀释的倍数推算出100 μL菌液的菌体数含量,进而计算出发酵液中总的活菌体数.
1.2.8 可溶性蛋白或小肽含量测定 用Bradford法[14]测量发酵上清可溶性蛋白或小肽的含量,用蒸馏水配制0.5 mg/mL的小牛血清蛋白做为标准蛋白.取发酵初末两个状态的发酵液1 mL,离心取上清,编号a、b.在96孔板中A行依次分别加入0、1、2、4、8、12、16、20 μL的标准蛋白,用蒸馏水补齐至20 μL,在B、C行重复2次,共3组.在96孔板中D行依次分别加入2、4、8、16、20 μL a、b样品,用蒸馏水补齐至20 μL,在E,F行重复两次,共3组.在上述每个孔补加200 μL G250工作液,37 ℃反应2 min后,将96孔板放入酶标仪在595 nm波长下读数.利用A、B、C 3行的数据制作标准曲线,计算出a、b两个样品的可溶性蛋白及小肽含量.
2 结果与分析
2.1羽毛降解益生菌的筛选与鉴定4种市售的益生菌经过7 d的培养后观察,降解羽毛效果最好的菌株是HUBM2.抽提HUBM2菌株的染色体DNA,PCR扩增其16SrDNA编码序列,测序结果通过BLAST进行同源比对分析,结果显示该益生菌与多个Bacilluslicheniformis菌株的16SrDNA编码序列一致性为100%,其中已报道的是BacilluslicheniformisATCC14580[15],因为地衣芽孢杆菌是FDA认定的安全微生物,加之分离自已经产业化的益生菌,因此,鉴定菌株HUBM2是地衣芽孢杆菌.
2.2羽毛预处理方法对羽毛降解的影响按方法1.2.3中所述,4瓶发酵物摇床培养7 d后观察结果,如图1所示.由图1可以看出B方法利用高温处理的羽毛降解效果略好于A方法经粉碎处理的效果,而通过C方法稀碱煮的羽毛的降解效果要远好于B和A方法,而用两种方法综合处理的D方法的羽毛降解效果和用C方法稀碱煮的羽毛的降解效果相差无几.而羽毛一经粉碎后,体积特别大,操作不方便.因此,稀碱煮处理羽毛能够有效地破坏羽毛中的二硫键及其空间结构,使羽毛变得更加容易被降解,而且可操作性强.

图1 4种不同羽毛预处理方法发酵5 d后的形态
2.3不同培养基对羽毛降解效果的影响按方法1.2.4中所述,分别接种HUBM2到3种不同的培养基,发酵培养5 d后观察结果,测定羽毛降解率、可溶性小肽和氨基酸含量、菌体生长量,结果如表1所示.由表1可以看出,益生菌HUBM2在优化培养基能够最好地将羽毛降解.由于羽毛培养基中没有可溶性的碳氮源,而刚接种的菌体处在迟缓期,所以发酵前期生长极其缓慢,因此A培养基中的生物量在5天时增长量很少且羽毛降解的也很少.LB培养基,菌体生长得很快然而羽毛的降解却几乎没有,原因可能是由于菌体优先利用了LB培养基中的碳氮源.
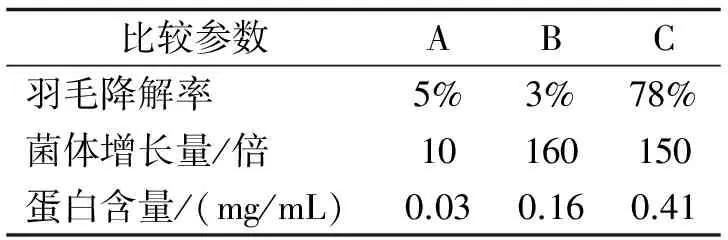
表1 不同培养基对羽毛降解效果的影响
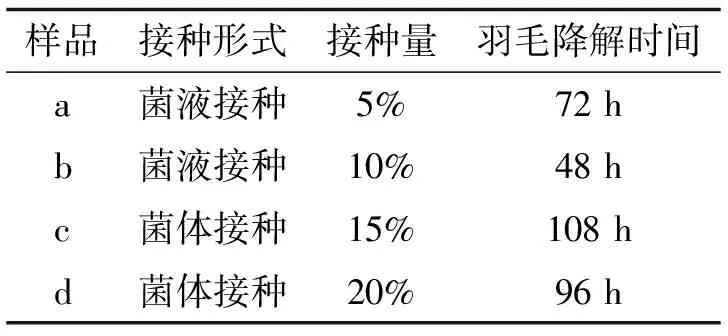
表2 不同接种量和种子对发酵结果的影响
2.4接种量对羽毛降解的影响按方法1.2.5中所述,不同接种量的4瓶发酵物摇床培养2~5 d,每天观察羽毛降解状态,如表2所示.由表2可以看出接种10%菌液的羽毛降解效果最好,而接种种子液的发酵样品降解羽毛的效果要明显好于接种菌体时降解羽毛的效果.这可能一是因为菌液中还有残存的LB培养基,二是菌体处于对数期,因此使转接后的迟缓期缩短.
2.5最佳发酵条件下的发酵相关结果利用摸索好的条件:使用0.02%NaOH溶液沸水浴处理15 min
表3发酵前后活菌体数及可溶性蛋白含量的变化
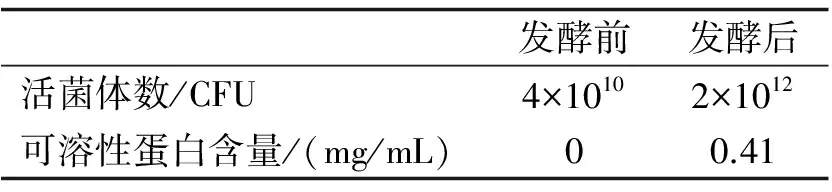
发酵前发酵后活菌体数/CFU4×10102×1012可溶性蛋白含量/(mg/mL)00.41
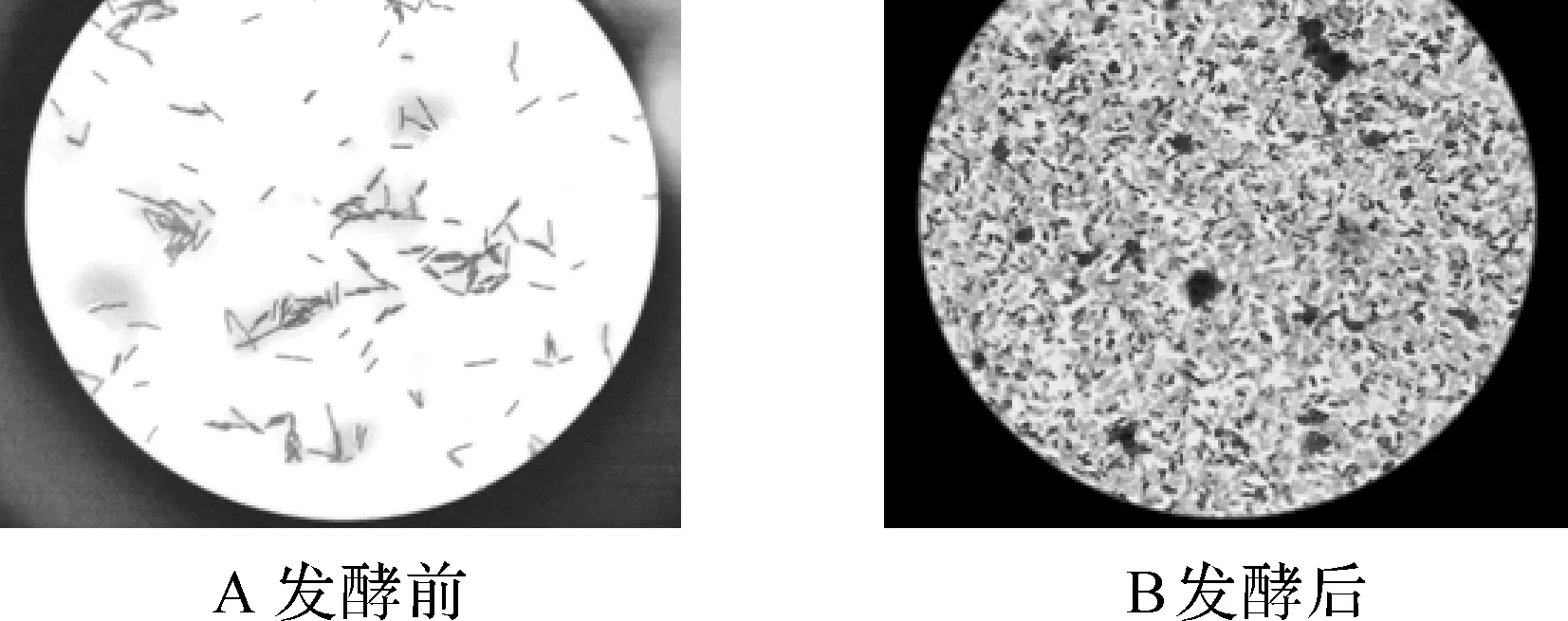
图2 发酵始末菌体形态变化
的羽毛,以优化羽毛发酵培养基为发酵底物,按10%的接种量接种益生菌HUBM2菌液,在37 ℃,200 r/min的条件下发酵48 h.测定样品发酵液菌体数变化及发酵液上清可溶性蛋白质及小肽含量变化.结果如表3.由表3可知益生菌利用羽毛做为唯一碳氮源,活菌体数从接种时的4×1010CFU增加到2×1012CFU,增长了50倍左右.可以看出,可溶性蛋白和小肽含量从完全没有而达到0.41 mg/mL.因此益生菌降解羽毛,利用羽毛降解蛋白自身增殖的同时,也有少量可溶性蛋白和小肽未被利用.
2.6发酵始末菌体形态变化如图2A发酵初期菌体都为营养细胞,且数量较少;发酵中期菌体数明显增加,出现营养细胞和芽孢共存的情况,且可以看见较大的羽毛碎片;发酵末期(图2B)菌体几乎全为芽孢形态,且数量明显增多,未见明显的羽毛碎片.由于芽孢的抗逆性极强,能耐高温,当发酵液中的菌体大多以芽孢形式存在时,为发酵液的后处理和制备新型菌肽饲料添加剂提供了长期保藏的基础.
3 讨论
本研究利用市售益生菌对羽毛进行生物降解,该菌较之其他益生菌有较强的降解羽毛的能力,它有效地解决了废弃羽毛的处理问题并得到含有大量益生菌及可溶性的蛋白质和短肽的发酵液,该发酵液经过喷雾干燥后可制备含有益生菌和蛋白肽的新型饲料添加剂.在发酵条件的优化中,发现羽毛经过稀碱处理和提高降解的效率,一般来说,酸碱处理会引起环境污染,但是本研究采用的是0.02%的稀碱溶液,废液采用稀酸中和后,可以用普通的活性污泥法处理即可排放.按10%的接种量接种种子液,经过约48 h的发酵可将羽毛基本降解,羽毛降解率约80%,发酵液呈灰褐色,发酵液中生物量达到较高水平,可溶性蛋白也达到峰值,芽孢杆菌绝大多数变为芽孢.将发酵液通过纱网滤去固形羽毛残余物后,加入填充剂,喷雾干燥后得到含有大量益生菌、少量的可溶性蛋白或短肽的新型饲料添加剂.
[1] 陈循军,尹国强,崔英德.羽毛角蛋白综合开发利用新进展[J].化工进展,2008,27(9):1390-1393.
[2] Anbu P,Hilda A.Purification of keratinase from poultry from isolateCopulariopsisbrevicaulisand statistical optimization of enzyme activity[J].Enzyme and Microbial Technology,2005,36: 639- 647.
[3] 王巍杰,程红燕,杨永强.羽毛角蛋白降解的研究进展[J].饲料工业,2010,31(5):39-42.
[4] 臧梦龙.羽毛粉的应用与开发[J].宁夏农林科技,1999(1):44.
[5] 陈振明,张朝晖,周晓云.生物加工改进羽毛角蛋白营养价值的研究进展[J].菲迪技术论坛,2006,9(3):9-11.
[6] Porres J M,Benito M J,Lei X G. Functional expression of keratinase (kerA) gene fromBacilluslicheniforminPichiapastoris[J].Biotech Lett,2002,24(8): 631-636.
[7] 韩晓宇,刘亚洁,李江.角蛋白酶基因工程研究[J].东华理工学院学报,2007,30(3):287-290.
[8] Taha I Z,Amira M E,Ahmed R E. Biodegradation of chicken feathers waste directed byBacillussubtilisrecombinant cells: scaling up in a laboratory scale fermentor[J].Bioresource technology,2011,102(3): 2387-2393.
[9] 钟巧芳,许波,黄遵锡.一株羽毛角蛋白降解菌的产酶条件研究[J].饲料工业,2007,28(14):20-23.
[10] Jeong Jinhha,Jeon Youngdong,Lee Omi,et al. Characterization of a multifunctional feather-degradingBacillussubtilisisolated from forest soil[J].Biodegradation,2010,21(6): 1029-1040.
[11] Xiang Lin,Lee Chungginn,Casle E S,et al. Purification and characterization of a keratinase from a feather-degradingBacilluslicheniformisstrain[J]. Applied and Environmental Microbiology,1992,58(10): 3271-3275.
[12] 王秀,孟勇.正确认识和使用益生素[J].饲料技术,2011,(2):47.
[13] Altschul S F,Madden T L,Schaffer A A,et al. Gapped BLAST and PSI-BLAST: a new generation of protein database search programs[J].Nucleic Acids Res,1997,25: 3389-3402.
[14] 王镜岩,朱圣庚,徐长法.生物化学(上册)[M].3版.北京:高等教育出版社,2002:9.
[15] Kakudo S,Kikuchi N,Kitadokoro K,et al. Purification,characterization,cloning,and expression of a glutamic acid-specific protease fromBacilluslicheniformisATCC 14580[J].J Biol Chem,1992,267(33): 23782-23788.

