绞股蓝皂苷与牛血清白蛋白相互作用的荧光光谱研究
何丽君,霍彩霞,杨彩玲,魏玉荣
(兰州城市学院 化学与环境科学学院,甘肃 兰州730070)
绞股蓝皂苷与牛血清白蛋白相互作用的荧光光谱研究
何丽君,霍彩霞,杨彩玲,魏玉荣
(兰州城市学院 化学与环境科学学院,甘肃 兰州730070)
用荧光光谱技术研究了绞股蓝皂苷与牛血清白蛋白(BSA)在pH=7.40的Tris-HCl缓冲溶液中的相互作用;通过计算确定了绞股蓝皂苷与BSA的结合位点数和结合常数,利用热力学分析探讨了绞股蓝皂苷与BSA之间的结合方式;同时采用同步荧光技术考察了绞股蓝皂苷对BSA构象的影响.结果表明,绞股蓝皂苷对牛血清白蛋白的荧光猝灭过程为静态猝灭;二者主要靠疏水作用和静电引力结合.
绞股蓝皂苷;牛血清白蛋白;相互作用;荧光光谱
血清白蛋白是生物体内含量最丰富的运输蛋白质,是生物体内具有重要生理功能的大分子,并且血液中血清白蛋白浓度长期以来一直是检验健康和疾病的指标.研究药物等小分子物质与血清蛋白相互作用的机理和作用过程,有助于认识药物的运转和代谢过程,在毒理学、药代动力学上有重要意义[1].
绞股蓝皂苷(GPs)是绞股蓝的主要有效成分,含有与人参皂苷结构相同的四环三萜达玛烷,有显著降血脂、降血糖、平衡血压、抗癌、抗疲劳、抗缺氧、抗衰老、促进细胞新陈代谢,强壮补益等作用,且无毒副作用[2].
作者利用荧光光谱技术,研究了模拟生理条件(pH=7.40)下GPs与牛血清白蛋白(BSA)的相互作用,从获得的光谱数据分析了它们的作用机理,键合常数、热力学参数及GPs对蛋白质微环境的影响.
1 实验部分
1.1 试剂与仪器
RF-5301PC型荧光分光光度计(日本,岛津公司)、pHS-TP型酸度计,HH-S型恒温水浴锅.
牛血清白蛋白(北京奥博星生物技术责任有限公司),绞股蓝皂苷(中国药品生物制品检定所),pH=7.40的Tris-HCl缓冲溶液.Tris、HCl、氯化钠等均为分析纯,实验用水为超纯水.
以Tris-HCl缓冲溶液分别配制2.0×10-5mol·L-1的BSA标准溶液和3.9×10-4mol·L-1的绞股蓝皂苷标准溶液,两种标准溶液都在4℃冰箱中保存,实验所用溶液由此标准溶液配制而得.
1.2 实验方法
1.2.1 荧光光谱测定
移取一定量的BSA溶液于1cm石英比色皿中,用微量进样器分别注入不同体积的GPs溶液.以280 nm为激发波长,在荧光分光光度计上记录290~450nm波长范围内的荧光光谱.
1.2.2 荧光滴定实验
移取1.997 6×10-6mol·L-1的BSA溶液3mL于1cm石英比色皿中,用微量进样器分别注入不同体积的GPs溶液,累加体积<150μL,反应时间为8min.以280nm为激发波长,在荧光分光光度计上分别记录不同温度下,290~450nm波长范围内的荧光光谱.
1.2.3 同步荧光测定
改变发射波长λem与激发波长λex之间的波长差Δλ,λem=λex+Δλ,分别在Δλ=15nm和Δλ=60nm下测定BSA与GPs不同浓度下的发射峰强度及峰位.
2 结果与讨论
2.1 绞股蓝皂苷与BSA相互作用的荧光光谱
模拟人体生理条件,在pH=7.40条件下,固定BSA浓度,改变GPs浓度,得到GPs与BSA相互作用的荧光光谱图.由图1可知,随GPs浓度的增加,BSA的荧光强度逐渐降低,这表示在加入GPs后,GPs与BSA发生了相互作用,生成了不发荧光的基态配合物,从而猝灭了BSA内色氨酸残基的荧光(大多数情况下可认为蛋白质的荧光主要来自色氨酸的贡献).同时,体系中BSA的最大发射峰从338nm轻微蓝移到333nm,表明二者的相互作用使BSA发色团的微环境发生了变化.
2.2 荧光猝灭机理及猝灭常数的测定
引起BSA荧光猝灭的原因可能有动态猝灭和静态猝灭,动态猝灭过程遵循Stern-Volmer方程[3].
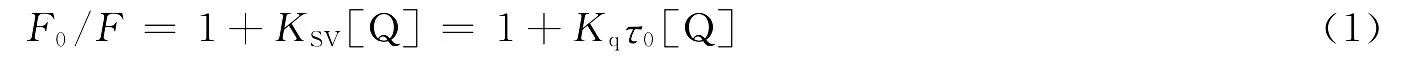
式中:F0和F分别为不存在和存在猝灭剂时荧光物质的荧光强度;Kq为双分子猝灭过程速率常数,τ0为猝灭剂不存在时物质的荧光寿命(对大多数生物分子τ0大约为10-8s)[4].KSV为动态猝灭常数,[Q]为猝灭剂的浓度,显然有KSV=Kqτ0,以Fo/F-1对[Q]作图,可求得猝灭常数KSV及猝灭速率常数Kq.284K时,猝灭速率常数为2.994×1012L·mol-1·s-1;310K时,猝灭速率常数为1.913×1012L·mol-1·s-1.
一般认为,各类猝灭剂对生物大分子的最大动态猝灭速率常数为2×1010L·mol-1·s-1[4].从结果可知,GPs对BSA荧光猝灭速率常数在1010以上,可以初步判断加入GPs导致BSA荧光猝灭过程是以静态猝灭为主.
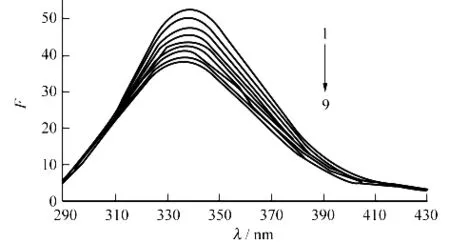
图1 绞股蓝皂苷与BSA体系的荧光光谱图Fig.1 The fluorescence spectra of the gypenoside-BSA system

图2 绞股蓝皂苷对BSA荧光猝灭的Stern-Volmer图Fig.2 The Stern-Volmer curves of BSA quenched by gypenoside
动态猝灭和静态猝灭还可以依据猝灭常数随温度不同的变化来区别.对于动态猝灭,温度升高,将增加有效碰撞的粒子数目,加剧电子的转移,使荧光物质的猝灭常数随温度升高而增大;若是静态猝灭,温度升高将降低复合物的稳定性,使猝灭常数减小.图2是284K和310K下GPs与BSA作用的Stern-Volmer拟合曲线,可以看到,随温度升高,Stern-Volmer方程的斜率减小,进一步表明该过程是以静态猝灭为主.
2.3 表观结合常数及结合位点数n
小分子与大分子结合时其表观结合常数Kb及结合位点数n由下式求出[5-6]:

F0和F分别为不存在和存在猝灭剂时荧光物质的荧光强度,Kb为BSA与GPs之间的表观结合常数,[Q]为猝灭剂的平衡浓度,n为结合位点数.由式(2)作出体系的关系图.通过斜率和外推截距可以求出BSA与药物之间的表观结合常数和结合位点数,结果见表1.
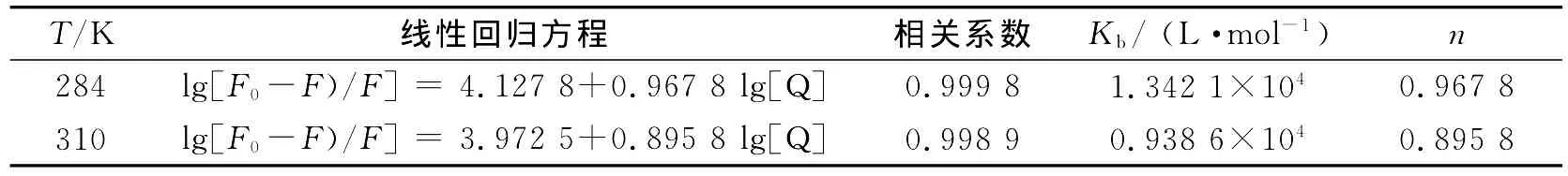
表1 GPs与BSA反应形成络合物的表观结合常数与结合位点数Table 1 Binding constant Kband number of binding sites of the complexes formed in the reaction of gypenoside with BSA
由表1可看出,结合位点数n接近1,说明GPs与BSA可形成1个结合位点.表观结合常数为104数量级,表明GPs与BSA之间有较强的结合,可以被蛋白质运输和储存.
2.4 结合反应的热力学性质及作用力
药物等有机小分子和蛋白质等生物大分子之间的作用力属于分子间的弱相互作用力,主要包括氢键、范德华力、静电引力和疏水作用力等.根据反应前后热力学焓变ΔrHθm和熵变ΔrSθm的相对大小,可以判断药物与蛋白质之间的主要作用力类型[7].
在温度变化不大时,反应的焓变和熵变可以看作一常数,通过热力学公式:
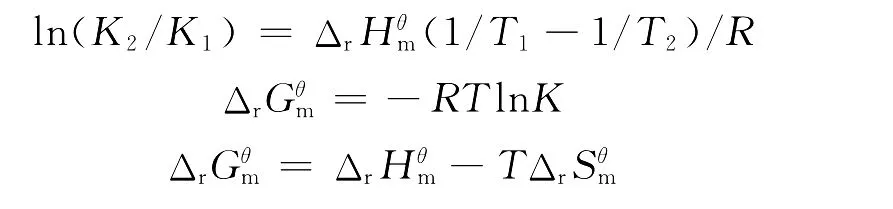
式中K为猝灭常数KSV,R为气体常数,计算出不同温度下GPs与BSA作用的自由能变和熵变数据见表2.
2.5 同步荧光光谱
利用同步荧光光谱可以分析蛋白质的构象[8].由Δλ=15nm所得到的同步荧光只显示蛋白质酪氨酸残基的光谱特性,而Δλ=60nm的同步荧光只表现色氨酸残基的荧光.从图3中可看出,随药物浓度的增大,酪氨酸残基荧光强度几乎不变,GPs主要猝灭了BSA的色氨酸残基的荧光(Δλ=60nm),且其最大荧光发射峰出现很轻微的蓝移,说明药物的加入使蛋白的构象发生一些变化.通过对蛋白质内源荧光的研究得知,蛋白质分子在极性溶剂中发射的荧光光谱的波长比它在非极性溶剂中的长,即溶剂极性降低,荧光光谱发生蓝移,根据这一规律可知色氨酸残基所处环境的疏水性有所降低[9].

图3 绞股蓝皂苷与BSA体系的同步荧光光谱图Fig.3 Synchronous fluorescence spectra of the gypenoside-BSA system
3 结论
利用荧光光谱技术研究了生理条件下GPs与BSA的相互作用.发现GPs对BSA具有荧光猝灭作用,该猝灭过程属于静态猝灭.其结合位点数为1,结合常数的数量级在104左右,说明GPs与BSA之间有较强的结合.通过计算得到的热力学数据,推断出GPs与BSA之间主要靠疏水作用力和静电引力结合.并通过同步荧光发现GPs对BSA的构象有一定影响.
[1]MCMENAMY R H.Albumin structure、function and uses[M].Oxford:Dergamon Press,1977.
[2]李群峰.绞股蓝的化学成分及药理作用研究进展[J].光明中医,2009,24(12):2396-2397.
[3]陈国珍.荧光分析法[M].北京:科学出版社,1990.
[4]许金钩,王尊本.荧光分析法[M].北京:科学出版社,2006:67.
[5]张 勇,张贵珠,王月梅,等.光谱法研究丝裂霉素,血清白蛋白以及金属离子间的相互作用[J].分析科学学报,2000,16(6):445-449.
[6]魏晓芳,刘会洲.Triton X-100与牛血清白蛋白的相互作用[J].分析化学,2000,28(6):699-701.
[7]ROSS P D,SUBRAMANIAN S.Thermodynamics of protein association reactions:forces contributing to stability[J].Biochemistry,1981,20(11):3096-3102.
[8]杨曼曼,杨 频,张立伟.荧光法研究咖啡酸类药物与白蛋白的作用[J].科学通报,1994,39(1):31-35.
[9]孙崇荣,李玉民.蛋白质化学导论[M].上海:复旦大学出版社,1991.
Fluorescence spectrometric study of the interaction between gypenoside and bovine serum albumin
HE Li-jun,HUO Cai-xia,YANG Cai-ling,WEI Yu-rong
(CollegeofChemistryandEnvironmentalScience,LanzhouCityUniversity,Lanzhou730070,Gansu,China)
The interaction between gypenoside and bovine serum albumin (BSA)in tris-HCl buffer solution(pH =7.40)was studied by means of fluorescence spectroscopy.Number of binding sites and binding constant for gypenoside and BSA were determined based on calculation;and their binding modes were explored based on thermodynamic analysis.In the meantime,the effect of gypenoside on the configuration of BSA was examined by means of synchronous fluorescence spectroscopy.It was found that gypenoside quenched the fluorescence of BSAviaa static quenching process,and hydrophobic and electrostatic interactions played a major role in the binding of gypenoside and BSA.
gypenoside;bovine serum albumin;interaction;fluorescence spectroscopy
O 657.39
A
1008-1011(2012)01-0067-04
2011-06-23.
甘肃省教育厅硕导项目(091113-07).
何丽君(1973-),女,副教授,硕士,研究方向为药物分析.

