几种非环单萜衍生物的制备及表征
王 辉,高文运
(1.宝鸡文理学院 化学化工系,陕西 宝鸡721013; 2.西北大学 生命科学学院,陕西 西安710069)
几种非环单萜衍生物的制备及表征
王 辉1,高文运2*
(1.宝鸡文理学院 化学化工系,陕西 宝鸡721013; 2.西北大学 生命科学学院,陕西 西安710069)
分别以香叶醇、橙花醇及芳樟醇为原料,经SeO2和t-BuOOH氧化、NaBH4还原得到8-羟基香叶醇、8-羟基橙花醇及8-羟基芳樟醇;利用乙酰化反应和苯甲酰化反应分别制备了这三个二醇化合物的乙酰化和苯甲酰化衍生物;并利用气相色谱-电子电离质谱仪(GC-EIMS)和液相色谱-电喷雾质谱仪(LC-ESIMS)分析了合成产物的光谱性质.结果显示,以GC-EIMS表征合成产物时,除苯甲酰化衍生物呈现较弱的分子离子峰外,其他几个产物均无分子离子峰信号.
8-羟基香叶醇;8-羟基橙花醇;8-羟基芳樟醇;衍生物
单萜类化合物是由2个异戊烯单位构成,含10个碳原子的化合物类群,广泛分布于高等植物的腺体、油室和树脂道等分泌组织中,是植物挥发油的主要成分.按骨架结构可以分为链状和环状两大类型,其中以单环和双环两种结构所包含的化合物最多.在环状单萜中,含有很多具有生物活性的化合物,如龙脑(俗称冰片)不但有发汗、兴奋、解痉挛和防止蛀虫等作用,还具有显著的抗缺氧功能[1].非环单萜中的一些重要的含氧衍生物,如8-羟基香叶醇、8-羟基橙花醇和8-羟基芳樟醇等,多具有较强的生物活性和浓郁的香气,是医药、化妆品和食品工业的重要原料.另外,非环单萜的焦磷酸酯在萜类化合物的生物合成过程中起着重要的作用,如8-羟基香叶醇焦磷酸酯是药用价值广泛的单萜吲哚类生物碱(如利血平、喜树碱等)生物合成的关键中间体,也是具有诸多生物活性的重要单萜化合物(如环烯醚萜苷)生物合成中的重要前体[2-3].目前,国内对非环单萜含氧衍生物的研究主要集中在香叶醇及橙花醇的合成及检测方法上[4],对8-羟基香叶醇及其结构类似物8-羟基橙花醇和8-羟基芳樟醇的研究则几乎未见报道.
作者分别以香叶醇(1)、橙花醇(2)和芳樟醇(3)为原料,利用烯丙位氧化的方法合成了8-羟基香叶醇((2E,6E)-3,7-二甲基-2,6-辛二烯-1,8-二醇 (4))、8-羟基橙花醇((2Z,6E)-3,7-二甲基-2,6-辛二烯-1,8-二醇(5))、8-羟基芳樟醇(E-3,7-二甲基-1,6-辛二烯-3,8-二醇(6))[5-6],然后利用乙酰化及苯甲酰化反应分别制备了上述三个化合物的乙酰化及苯甲酰化衍生物(化合物7~12)(图1)[7],并对合成产物的结构进行了表征,同时使用GC-EIMS及LC-ESIMS探讨了所合成化合物的色谱和质谱性质.
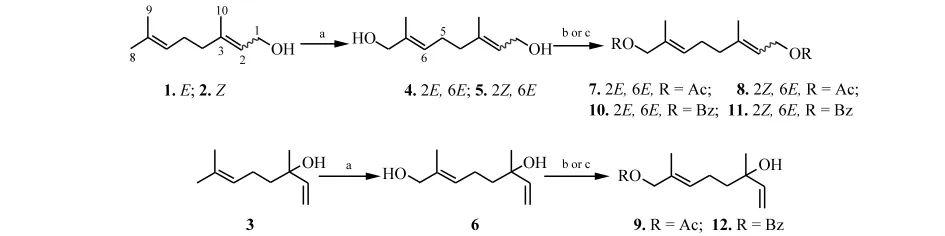
图1 化合物4~12的合成路线Fig.1 The synthetic route of compounds 4~12
1 实验部分
1.1 仪器及试剂
Shimadzu GC2010型气质联用色谱仪,日本岛津公司;rtx-5ms色谱柱,Restek公司;2695型高效液相色谱仪,Waters公司;2696紫外检测器,Waters公司;HC-C18色谱柱,Agilent公司;INOVA型核磁共振仪(400MHz),美国Varian公司;LTQ XL电喷雾质谱,Thermo Scientific公司.
香叶醇、橙花醇、芳樟醇、过氧化叔丁醇、CeCl3·7H2O均购自Alfa Aesar公司;SeO2及NaBH4,Fluka公司;硅胶(200目),青岛海洋化工厂;硅胶G板(20cm×20cm),青岛胜海化工厂;其他试剂均为分析纯.
1.2 8-羟基香叶醇(4)、8-羟基橙花醇(5)、8-羟基芳樟醇(6)的制备
化合物4的制备:在100mL的圆底烧瓶中加入 SeO2(0.14g,1.26mmol),CH2Cl2(40mL,0.63 mol),硅胶(1.53g,0.03mol)和t-BuOOH(60%,2.35mL,14.02mmol),充分搅拌下在10min内慢慢滴加香叶醇(1.01g,6.56mmol),室温下继续搅拌27h.混合物过滤,滤液用10%KOH,水和饱和食盐水依次洗涤,然后用无水MgSO4干燥.过滤除去干燥剂后减压浓缩得一无色油状混合物(醇和醛).将得到的混合物溶于15mL甲醇,加入CeCl3·7H2O(2.23g,5.98mmol),充分搅拌下于5min内慢慢加入 NaBH4(0.24g,6.34mmol).室温反应2h后,混合物中加入15mL冰水以终止反应.减压蒸除甲醇,所得水溶液用乙酸乙酯萃取(3×10mL),无水MgSO4干燥,浓缩溶剂后得油状物.该油状物以硅胶柱层析法纯化,V石油醚∶V乙酸乙酯为3∶1,2∶1及1∶1的洗脱剂梯度洗脱.纯化后得0.72g(4.23mmol)无色油状液体4,产率65%.1H NMR(400MHz,CDCl3)δ:5.40(m,2H,H-2,H-6);4.16(d,J=7.0Hz,2H,H-1);3.99(s,2H,H-8);2.17(m,2H,H-5);2.08(m,2H,H-4);1.74(s,3H,Me-3);1.68(s,3H,Me-7).EI-MS:43(100%),55(27%),68(65%),84(28%),93(23%),109(10%),121(14%),152(2%).ESIMS:193[M+Na]+.
化合物5以橙花醇为原料,化合物6以芳樟醇为原料,制备方法同上.
化合物5:纯化后得0.75g(4.41mmol)无色油状液体,产率68%.1H NMR (400MHz,CDCl3)δ:5.35(m,2H,H-2,H-6);4.00(d,J=7.3Hz,2H,H-1);3.91(s,2H,H-8);2.07(m,4H,H-4,H-5);1.67(s,3H,Me-3);1.57(s,3H,Me-7).EI-MS:43(100%),55(32%),68(58%),79(32%),84(46%),137(11%),152(2%).ESI-MS:193[M+Na]+.
化合物6:纯化后得0.72g(4.23mmol)无色油状液体,产率65%.1H NMR (400MHz,CDCl3)δ:5.88(t,J=10.7Hz,1H,H-2);5.39(m,1H,H-6);5.21(dd,J=17.3Hz,1.2Hz,1H,H-1b);5.05(dd,J=10.8Hz,1.2Hz,1H,H-1a);3.98(s,2H,H-8);2.06(m,4H,H-4,H-5);1.66(s,3H,Me-3);1.29 (s,3H,Me-7).EI-MS:43(100%),55(34%),67(62%),71(64%),79(17%),93(14%),110(8%),119(11%),137(8%),152(3%).ESI-MS:193[M+Na]+.
1.3 化合物4~6的乙酰化衍生物(7~9)的制备
化合物7的制备:在10mL的圆底烧瓶中加入化合物4(74.80mg,0.44mmol),吡啶(0.1mL,1.24 mmol),冰浴冷却数分钟后,搅拌下缓慢滴加乙酸酐(0.18mL,1.89mmol).滴加完毕后,冰浴上继续搅拌1h.加入0.4mL冰水以终止反应,用石油醚萃取3次,合并有机层并分别用3mol/L的HCl,饱和Na2CO3和饱和NaCl水溶液洗涤,用氮气吹干有机溶剂得油状物.该油状物以硅胶柱层析法纯化,V石油醚∶V乙酸乙酯为8∶1及7∶1的洗脱剂梯度洗脱.纯化后得96.80mg(0.38mmol)无色油状液体7,产率88%.1H NMR(400MHz,CDCl3)δ:5.46(t,J=6.9Hz,1H,H-6);5.37(t,J=7.1Hz,1H,H-2);4.61(d,J=7.2Hz,2H,H-1);4.47(s,2H,H-8);2.19(m,4H,H-4,H-5);2.10(s,3H,Me-CO);2.08(s,3H,Me-CO);1.73 (s,3H,Me-3);1.68 (s,3H,Me-7).EI-MS:43(100%),53(4%),67(12%),84(23%),119(18%),134(25%),152(3%).ESI-MS:277[M+Na]+.
化合物8以化合物5为原料,化合物9以化合物6为原料,合成方法同上.
化合物8:纯化后得101mg(0.40mmol),无色油状液体,产率90%.1H NMR(400MHz,CDCl3)δ:5.46(s,1H,H-6);5.40(t,J=7.3Hz,1H,H-2);4.57(d,J=7.3Hz,2H,H-1);4.47(s,2H,H-8);2.18(m,4H,H-4,H-5);2.10(s,3H,Me-CO);2.08(s,3H,Me-CO);1.80(s,3H,Me-3);1.68(s,3H,Me-7).EI-MS:43(100%),55(6%),67(12%),84(19%),119(23%),134(21%),152(3%).ESI-MS:277[M+Na]+.
化合物9:纯化后得82mg(0.39mmol),无色油状液体,产率88%.1H NMR (400MHz,CDCl3)δ:5.94(dd,J=11.1Hz,10.3Hz,1H,H-2);5.48(t,J=7.2Hz,1H,H-6);5.25(d,J=18.2Hz,1H,H-1b);5.11(d,J=11.6Hz,1H,H-1a);4.47(s,2H,H-8);2.14(m,4H,H-4,H-5);2.10(s,3H,Me-CO);1.68(s,3H,Me-7);1.32(s,3H,Me-3).EI-MS:43(100%),55(21%),67(44%),71(37%),82(19%),96(12%),110(10%),119(17%),137(8%).ESI-MS:235[M+Na]+.
1.4 化合物4~6的苯甲酰化衍生物(10~12)的制备
化合物10的制备:在10mL的圆底烧瓶中加入化合物4(113.9mg,0.67mmol),吡啶(1mL,1.24 mmol),冰浴冷却数分钟后,搅拌下缓慢滴加苯甲酰氯(0.26mL,2.24mmol),滴加完毕后,冰浴上继续搅拌1h.加入0.6mL冰水终止反应,乙酸乙酯萃取3次,合并有机层并分别用3mol/L的HCl,饱和Na2CO3和饱和NaCl水溶液洗涤,用氮气吹干有机溶剂得油状物.该油状物以硅胶柱层析法纯化,V石油醚∶V乙酸乙酯为8∶1及7∶1的洗脱剂梯度洗脱.得228mg(0.60mmol)无色油状液体10,产率90%.1H NMR(400 MHz,CDCl3)δ:8.16(d,J=7.4Hz,2H,Ph-1′,5′);8.06(d,J=5.6Hz,2H,Ph-1″,5″);7.69(t,J=7.4Hz,2H,Ph-3′,3″);7.55(m,2H,Ph-2′,4′);7.46(m,2H,Ph-2″,4″);5.55(t,J=6.9 Hz,1H,H-6);5.50(t,J=6.8Hz,1H,H-2);4.84(d,J=7.0Hz,2H,H-1);4.71(s,2H,H-8);2.19(m,4H,H-4,H-5);1.79(s,3H,Me-3);1.75(s,3H,Me-7).EI-MS:41(56%),51(17%),55(20%),67(37%),69(44%),77(52%),105(100%),378[M]+(8%).ESI-MS:401[M+Na]+.
化合物11以化合物5为原料,化合物12以化合物6为原料,合成方法同上.
化合物11:纯化后得225mg(0.60mmol),无色油状液体,产率89%.1H NMR(400MHz,CDCl3)δ:8.18(m,2H,Ph-1′,5′);8.06(m,2H,Ph-1″,5″);7.70(t,J=7.4Hz,2H,Ph-3′,3″);7.55(m,2H,Ph-2′,4′);7.43(m,2H,Ph-2″,4″);5.58(t,J=6.6Hz,1H,H-6);5.53(t,J=5.5Hz,2H,H-2);4.84(d,J=7.2Hz,2H,H-1);4.71(s,2H,H-8);2.26(m,4H,H-4,H-5);1.82(s,3H,Me-3);1.75 (s,3H,Me-7).EI-MS:41(27%),51(14%),67(11%),77(46%),91(14%),105(100%),119(24%),134(17%),378[M]+(7%).ESI-MS:401[M+Na]+.
化合物12:纯化后得167mg(0.61mmol),无色油状液体,产率91%.1H NMR(400MHz,CDCl3)δ:8.05(d,J=7.46Hz,2H,Ph-1′,5′);7.60(t,J=7.4Hz,1H,Ph-3′);7.44(t,J=7.7Hz,2H,Ph-2′,4′);5.93(t,J=10.7Hz,1H,H-2);5.56(t,J=7.1Hz,1H,H-6);5.23(d,J=17.3Hz,1H,H-1b);5.08(d,J=10.8Hz,1H,H-1a);4.70(s,2H,H-8);2.12(m,4H,H-4,H-5);2.05(s,2H,Me-7);1.30 (s,3H,Me-3).EI-MS:41(17%),43(31%),51(10%),55(17%),67(34%),71(22%),77(41%),82(15%),105(100%),119(21%),274[M]+(5%).ESI-MS:297[M+Na]+.
1.5 GC-EIMS测定化合物4~12
气相色谱条件:DB-5毛细管色谱柱(30m ×0.25mm,0.25μm);载气为高纯氦气(99.999%),氦气流速为1.0mL/min;分流进样;进样口温度320℃;柱箱温度60℃;压力控制为100kPa;总流量35.2mL/min;柱流量1.61mL/min;线速度46.3cm/s;吹扫流量3.0mL/min;分流比19.0.
化合物4~9的程序温度:初始为60℃,保持2.0min后,以5.0℃/min升至300℃,保持10.0min.化合物10~12的程序温度:初始为60℃,30min钟升至250℃.
EI质谱条件:电子能量为70eV,离子源温度为180℃,接口温度为300℃.
1.6 LC-ESIMS测定化合物4~12
化合物4~6的 HPLC检测条件:色谱柱:Agilent HC-C18柱(4.6mm×250mm,5μm);检测波长为:210nm;流速为0.75mL/min;流动相 A 为甲醇,流动相B为水,0min,50%A;20min,90%A;30min,50%A;35min,50%A.
化合物7~12的 HPLC检测条件:色谱柱:Agilent HC-C18柱(4.6mm×250mm,5μm);检测波长为:230nm;流速为:0.75mL/min;流动相:流动相 A为甲醇,流动相B为水,0min,80%A;10min,100%A;15min,80%A;20min,80%A.
ESI质谱条件(正离子模式):离子源电压500kV;鞘气流速8.02arb;毛细管温度350~375℃;tube lens电压50~200V.
2 结果与讨论
利用烯丙位的氧化反应,以香叶醇、橙花醇、芳樟醇为原料分别合成了它们的8-羟基衍生物.在烯丙位进行氧化是获得烯丙醇类化合物的重要手段之一.在这类反应中,氧化剂和催化剂的选择是反应能否取得成功的关键.以过渡金属氧化物(如Cr、Fe、Cu、Ru、Co等的氧化物)或其配合物为催化剂或氧化剂进行烯丙位的氧化是常用的方法之一,这些过渡金属氧化物中除Cu和Cr外,其他的都存在很大的局限性,应用范围不广泛.以含硒化合物为氧化剂是烯丙位氧化的又一个常用的方法,如SeO2就是一个最常用的氧化剂.但是这个试剂也存在一些显著的缺点:如使用大量的SeO2为氧化剂,不仅使反应产生大量含硒的副产物,导致反应的后处理困难,也造成很大的环境污染.作者根据文献方法[5],在烯丙位氧化时选择了使用催化量的SeO2为催化剂,以过氧叔丁醇为氧化剂完成烯丙位的氧化反应,过氧叔丁醇除氧化烯丙位得到烯丙醇外,还可将反应中形成的Se2+氧化为SeO2使其再生,这样就避免了大量含硒的副产物的生成给后处理带来的问题,同时也减少了环境污染.
在合成二醇的乙酰化及苯甲酰化衍生物时,作者分别选择乙酸酐和苯甲酰氯为酰化试剂在吡啶溶剂中反应,得到的乙酰化及苯甲酰化产物的产率都在80%以上.其中8-羟基香叶醇及8-羟基橙花醇中的羟基都被完全酰化,而8-羟基芳樟醇的乙酰化和苯甲酰化反应中都只得到了8位羟基被酰化的产物,这是因为其3位羟基为一叔羟基,空间位阻较大,不易发生酰化反应所致.另外,单酰化的芳樟醇衍生物与双酰化的香叶醇/橙花醇衍生物在GC及HPLC中的保留时间有更大的区别,这更有利于复杂样品中这三个化合物的准确识别,因此作者没有用已知的方法,如在反应中加入4-(N,N-二甲胺基)吡啶[8]或使反应在高压条件下进行[9]以制备3位及8位均被酰化的芳樟醇衍生物.
利用化合物4~12较强的挥发性,作者对这些化合物做了GC-MS测定,测定得化合物4~12在GC上的保留时间见表1.
从表1可以看出,在GC中,化合物4和5保留时间相近,这是因为它们是一对顺反式异构体;由于结构差异,化合物6的保留时间比化合物4和5的短.化合物9的保留时间比化合物7和8的要短,这是因为化合物9只有8位羟基被乙酰化,而7、8的1位和8位都被乙酰化,因此9的挥发性比7和8的较强;在化合物10~12的GC图上同样可以看出,12的保留时间较10、11的短,这同样是因为12只在8位被苯甲酰化,而10、11在1位和8位都被苯甲酰化.

表1 化合物4~12的色谱特性Table 1 The chromatographic characteristics of compounds 4~12
化合物4~6的EI-MS图中看不到分子离子峰,都只能看到较弱的脱水碎片离子峰m/z152[MH2O]+,基峰均为m/z43;化合物7~9的EI-MS图中基峰同样是m/z43,也看不到分子离子峰,这说明乙酰化并不能有效地稳定化合物4~6中的羟基,以便能在EI-MS中观察到衍生物的分子离子峰;与前两组化合物的质谱不同,化合物10~12的质谱中均出现了分子离子峰,10和11的分子离子峰[M]+在m/z378(<10%),12的为[M]+m/z274(<7%),这说明苯甲酰化是比乙酰化更有效的稳定化合物4~6中羟基的方法.同时,该组化合物的基峰均为m/z105,为苯甲酰基的特征碎片离子峰.
化合物7~12的HPLC条件相同.从表1可以看出,化合物9的保留时间比7和8的短,这是因为7、8为双酰化的衍生物,而9为单酰化的衍生物,化合物9的极性比化合物7和8的大,因此反相色谱柱上9的保留时间比化合物7和8的短;同理,12在色谱柱上的保留时间比10和11的短.化合物4~6的HPLC条件与7~12的不同,这是由于化合物4~6的极性与7~12相差较大.
化合物4~12的ESI-MS图中均出现明显的分子离子峰[M+Na]+(数据见表1),这说明用ESI-MS来表征这些化合物时可以清楚地观察到这些化合物的分子离子峰信号,而在EI-MS方法中不能有效地得到它们的分子离子峰.
[1]KAINULAINEN P,NISSINEN A.Essential oil composition in leaves of carrot varieties and preference of specialist and generalist stucking insect herbivores[J].Agr Forest Entomol,2002,4(3):211-217.
[2]OUDIN A,COURTOIS M,RIDEAU M,et al.The iridoid pathway in catharanthus roseus alkaloid biosynthesis[J].Phytochem Rev,2007,6:259-276.
[3]GALVEZ M,MARTIN-CORDERO C,AYUSO M J.Pharmacological activities of iridoids biosynthesized by route II[J].Stud Nat Prod Chem,2005,32:365-394.
[4]SUN Li Hong,SUN Li Ming.Research progress of geraniol[J].Northwest Pharm J,2009,24:428-430.
[5]KENT R,NATHAN S,VINCENT M,et al.Allylic oxidation of olefins by catalytic and stoichiometric selenium dioxide with tert-butyl hydroperoxide[J].J Am Chem Soc,1977,99(16):5526-5528.
[6]KAD G L,IASAMRIT K,SANDEEEP N,et al.A short and convenient synthesis of 3,7-dimethyl-1-hydroxy-2(E),6(E)-dodecadien-11-one and 2,6-dimethyl-2(E),6(E)-octadiene-1,8-diol diisovalerate[J].Indian J Chem,1996,35(B):832-834.
[7]HUANG Jian Ping,DAI Ie,ZHANG Hao,et al.The synthesis of(2E,6E)-3,7-dimethyl-8-hydroxy-2,6-octadiene-1acetate[J].J Shenyang Pharm Univ,2007,24(6):339-341.
[8]ISHIHARA K,KURIHARA H,YAMAMOTO H.An extremely simple,convenient,and selective method for acetylating primary alcohols in the presence of secondary alcohols[J].J Org Chem,1993,58:3791-3793.
[9]DAUBEN W G,BUNCE R A,GERDES J M,et al.Organic reactions at high pressure.A mild method for the placement of protecting groups on hindered and sensitive alcohols[J].Tetrahedron Lett,1983,24:5709-5712.
Preparation and characterization of several acyclic monoterpene derivatives
WANG Hui1,GAO Wen-yun2*
(1.DepartmentofChemistryandChemicalEngineering,BaojiUniversityofArtsandScience,Baoji721013,Shaanxi,China; 2.CollegeofLifeScience,NorthwestUniversity,Xi'an710069,Shaanxi,China)
Geraniol,nerol and linalool were respectively oxidized with SeO2/t-butyl hydroperoxide and then reduced with NaBH4to yield 8-hydroxygeraniol,8-hydroxynerol and 8-hydroxylinalool.The acetylated and benzoylated derivatives of the three diols were prepared by acetylation and benzoylation,respectively.As-synthesized products were characterized by means of gas chromatography-electron ionization mass spectrometry(GC-EIMS)and liquid chromatography-electrospray ionization mass spectrometry(LC-ESIMS).Results indicate that only benzoylated derivatives show weak molecular ion peak signals in GC-EIMS analysis,and the other products do not exhibit molecular ion peak signals therein.However,all as-synthesized products show obvious signals of molecular ions in LC-SIMS analysis.
8-hydroxygeraniol;8-hydroxynerol;8-hydroxylinalool;derivatives
O 621.3;O 621.4
A
1008-1011(2012)01-0080-05
2011-09-09.
国家自然科学基金资助项目(20772095);宝鸡文理学院重点项目(ZK10129).
王 辉(1982-),女,助教,硕士,研究方向为药物化学.*
.

