外源性PCr对小鼠全脑缺血性损伤的保护作用
范维伟,孙慧君,蔡超俊,袁 玮,韩国柱
(大连医科大学 药学院,辽宁 大连 116044)
磷酸肌酸(phosphocreatine,PCr)是人体内自有的活性物质,具有维持细胞高能磷酸水平、稳定磷脂膜、保护机体免受自由基过氧化损害等作用。目前,PCr已能人工合成并作为一种高效低毒的心肌保护药, 为英国马丁代尔大药典[1]收载。虽然临床已有将外源性磷酸肌酸作为脑损伤保护的药物应用,但尚未获得相关部门正式批准,基础研究报道亦较少见。本文采用动物永久性脑缺血及脑缺血再灌注损伤模型观察外源性PCr对缺血性脑损伤的保护作用,以期为临床应用提供相关实验及理论依据。
1 材料和方法
1.1 实验动物
雄性昆明种小鼠(体重20~24 g),大连医科大学动物实验中心提供,许可证号:SCXK(辽)2008-0002。
1.2 药品及试剂
磷酸肌酸钠注射用粉针剂:哈尔滨博莱制药有限公司惠赠 070823;尼莫地平粉剂:天津中央制药厂 (20100611);蛋白、MDA、SOD测定试剂盒:南京建成生物工程研究所,20090421;CD14(多克隆)抗体及通用型二抗、DAB显色试剂盒:武汉博士德生物工程有限公司,20100801;Western Blot试剂及IP细胞裂解液:碧云天生物技术研究所;Super ECL Plus超敏发光液:普利莱基因技术有限公司;余均为市售分析纯。
1.3 主要仪器
CF16RX高速冷冻离心机:HITACHI,日本;水平电泳仪:大连捷迈科贸有限公司;Biospectrum AC Chemi HR 410凝胶成像系统:Biospeetrum,美国;754型分光光度计:尤尼可上海仪器有限公司。
1.4 外源性PCr对小鼠全脑永久性缺血损伤的影响
1.4.1 动物分组、给药及模型制备:小鼠60只,随机分为对照组、PCr高剂量组(4.5 g·kg-1)、PCr 低剂量组(1.5 g·kg-1),每组20只。腹腔注射给药,容量0.1 mL·10 g-1体重,对照组给予等容量NS。于给药20 min后用大组织剪沿小鼠双耳连线下部快速断头,制备全脑永久性缺血模型。
1.4.2 标本处理及指标测定:每组取10只于断头即刻记录张口喘息持续时间。另10只于动物断头20 s取大脑,一侧半球制备10%脑组织匀浆,严格按照试剂盒说明书测定蛋白浓度(考马斯亮蓝法)、SOD活力(黄嘌呤氧化酶法)及MDA含量(TBA法)。另侧脑半球经10%福尔马林固定,常规制备石蜡片HE染色。
1.5 外源性PCr对小鼠全脑缺血再灌注(global brain ischemia /reperfusion GBI/R)损伤的影响
1.5.1 实验分组、给药及模型制备:小鼠50只,随机分为假手术组、模型组、PCr高剂量组(2.0 g·kg-1)、低剂量组(1.0 g·kg-1)组及尼莫地平(Nim)组,每组10只。NS及PGr分别以0.1 mL·10 g-1体重于首次缺血即刻1次尾静脉注射,Nim组术前2 d 始灌胃给药,2次/d,每次100 mg·kg-1体重,手术当天术前30 min末次给药。
按文献[2]方法,小鼠麻醉,双侧颈总动脉(CCA)完全阻断血流10 min,复灌10 min,重复3次,制备全脑缺血再灌注损伤模型。假手术组仅暴露CCA,不进行缺血再灌操作。不同处理组小鼠分别于末次再灌2 h后断头取脑。
1.5.2 标本处理及指标测定:每组取10只小鼠左侧大脑测定脑组织含水量(干湿重法)
脑含水量(%)=(湿重-干重)/湿重×100
Western Blot法测定CD14蛋白表达:每组取6只小鼠右侧大脑组织经裂解液充分裂解后,4℃离心取上清,BCA试剂盒测定蛋白浓度。12%SDS-PAGE分离胶,5%SDS-PAGE浓缩胶。样品经处理后上样,电泳、PVDF膜转膜(恒流0.8 mA/cm,室温,48 min),5%脱脂奶粉封闭。Rabbit anti-Rat CD14(1∶250)以及β-Actin抗体(1∶1000)孵育过夜(4℃),二抗(1∶5000) 37℃水浴孵育2 h。ECL暗室显色,凝胶成像系统拍照后Gel-ProAnalyzer 4.0软件分析。
1.6 统计学方法
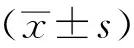
2 结 果
2.1 外源性PCr对小鼠全脑永久性缺血损伤的影响
高剂量PCr可延长小鼠永久性全脑缺血后张口喘息持续时间、增加脑组织中SOD活力,与对照组比较P<0.05。高、低剂量组小鼠脑组织中MDA含量均明显低于对照组(P<0.05),见表1。

Tab 1 The effects of exogenous PCr on gasping time and level of SOD、MDA in brain tissues after permanence ischemia
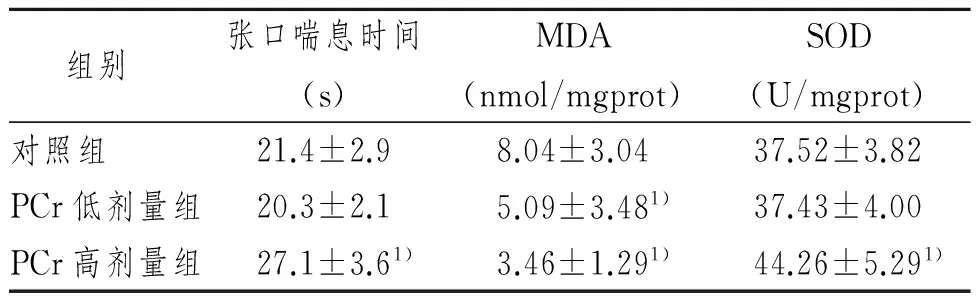
组别张口喘息时间(s)MDA(nmol/mgprot)SOD(U/mgprot)对照组21.4±2.98.04±3.0437.52±3.82PCr低剂量组20.3±2.15.09±3.481)37.43±4.00PCr高剂量组27.1±3.61)3.46±1.291)44.26±5.291)
1)与对照组比较,P<0.05
2.2 外源性PCr对小鼠GBI/R损伤的影响
2.2.1 外源性PCr对脑含水量的影响:与假手术组比较,GBI/R模型组脑含水量升高明显 (P<0.05);给予外源性PCr及Nim处理后脑含水量低于模型组,差异具有显著性意义(P<0.05),见表2。
2.2.2 外源性PCr对脑组织中CD14蛋白表达的影响:Western Blot法检测显示小鼠GBI/R后脑组织CD14蛋白表达明显升高。不同剂量PCr处理可明显降低CD14升高的程度。见表2,图1。
表2外源性PCr对小鼠GBI/RF损伤后脑含水量及CD14表达的影响
Tab 2 The effects of exogenous PCr on Brain water content and expression of CD14 in brain tissue after GBI/R in mice
CD14=OD(CD14)/OD(β-Actin);1)与假手术组比较,P<0.01; 2)与模型组比较,P<0.05
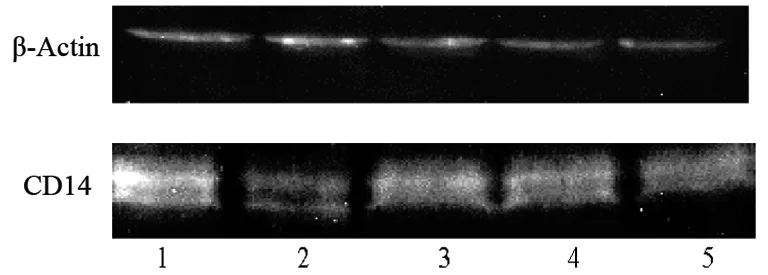
图1外源性PCr对小鼠脑组织中CD14蛋白表达的影响
Fig 1 The effects of exogenous PCr on expression of CD14 in brain tissue after GBI/R in mice
1.模型组;2.假手术组;3.PCr低剂量组;4.PCr高剂量组;5.Nim组
2.2.3 对脑组织病理变化的影响:经组织切片HE染色镜下观察,结果显示假手术组神经细胞大小、形态结构完整,核大而圆无固缩,间质均匀致密;模型组可见大量神经细胞变性,胞核固缩、深染, 细胞周围间隙结构松散,出现大量空泡, PCr及Nim给药组与模型组相比病变程度均明显减轻。见图2。
3 讨 论
急性脑缺血是临床上常见的脑血管疾病之一,能量代谢障碍是导致细胞损伤的触发因素,有效提供能量是缺血早期治疗,减轻组织损伤的关键。本研究所用小鼠脑缺血性损伤模型具有良好的重现性,损伤指标明确。
磷酸肌酸(phosphocreatine,PCr)是体内高能磷酸化合物的储存形式,其分子中含高能量的氨基磷酸键,在细胞中水解可产生超过12000 kal/mol能量,是细胞的重要能源物质[3]。在组织大量消耗ATP,导致ADP增多时,PCr可将其磷酸键转移给ADP生成ATP以补充能量的供应,在生理及应激条件下通过此反应维持机体能量代谢的动态平衡[4-5]同时具有稳定磷脂膜、保护细胞免受自由基过氧化损害等作用[6]。近期有研究认为,PCr的作用方式可能有以下两方面:(1)通过PCr分子起作用,其含有的高能磷酸键参与能量代谢,使ATP生成增加;(2)通过其体内代谢产物肌酸(creatine,Cr)发挥作用,在这种情况下,PCr作为Cr的一个前体药物或载体而发挥作用[7]。
脑缺血时可产生大量氧自由基攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化作用,引起细胞损伤。此过程生成的MDA等脂质过氧化物的分解产物亦可造成细胞损伤。SOD清除超氧阴离子自由基,保护细胞免受损伤。将MDA与SOD配合测定,以反映机体氧化损伤和抗氧化能力是本类研究常用方法。
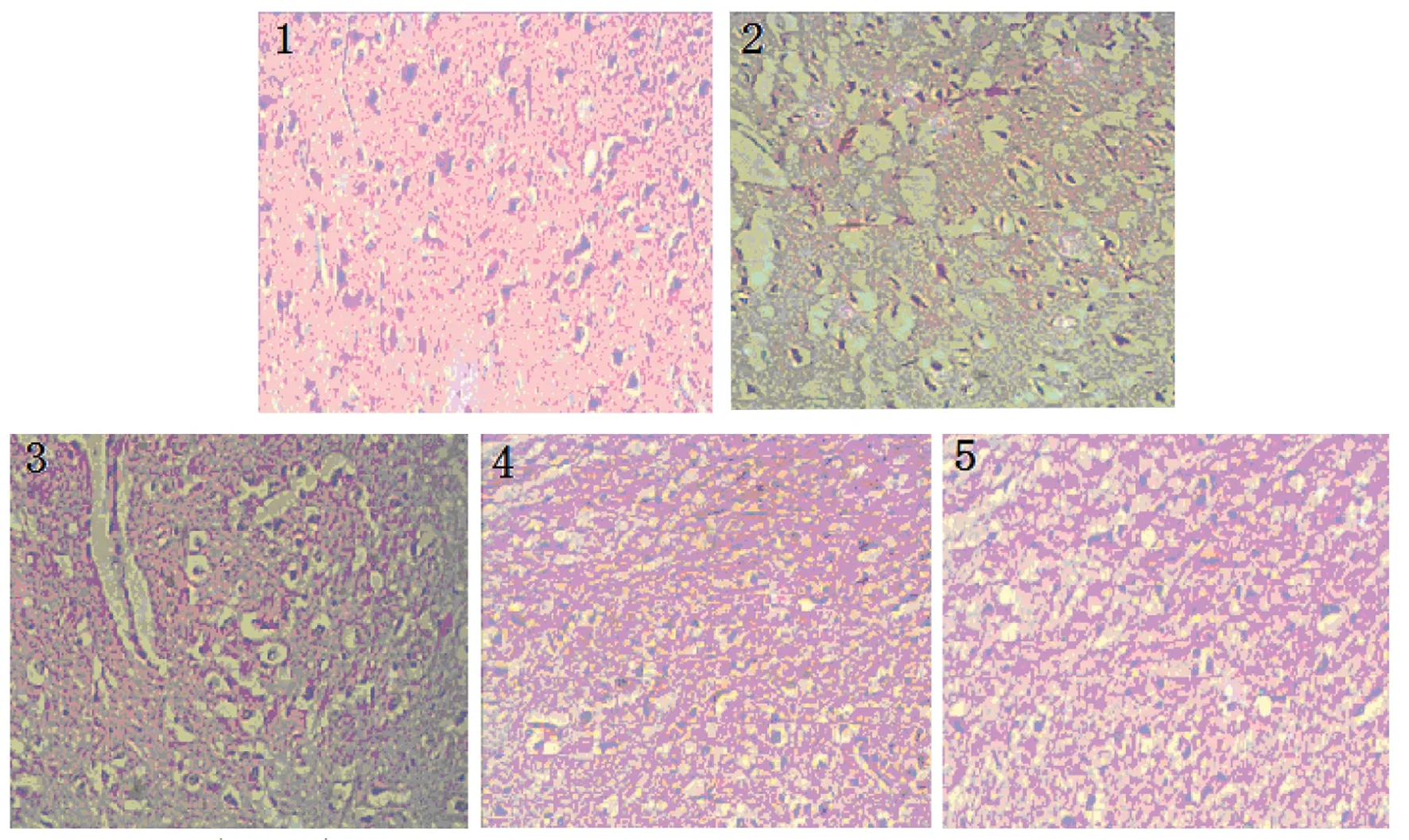
图2外源性PCr对小鼠GBI/R脑组织病理形态学的影响(HE染色)
Fig 2 The effects of exogenous PCr on pathomorphology changes in brain tissue after GBI/R in mice (H&E Staining)
1. 模型组; 2. 假手术组; 3.PCr低剂量组; 4.PCr高剂量组; 5.Nim组
诸多研究已证实,急性脑缺血时因中枢神经功能障碍导致植物神经功能紊乱,加之机体发生应激反应导致肠黏膜屏障功能受损,细菌移位、大量内毒素释放并诱导细胞表面受体(CD14)表达增多,参与并加重组织损伤,甚至触发多器官功能障碍综合征的发生。
本研究结果显示外源性PCr可明显延长全脑永久性缺血后张口呼吸时间;减轻脑水肿及损伤后脑组织形态学改变。显示外源性PCr可有效缓解脑缺血性损伤,维持脑功能。而降低组织MDA含量、提高SOD活力;抑制损伤后CD14表达则提示PCr抗脑缺血性损伤作用可能通过增加供能、稳定细胞内腺苷酸池,稳定磷脂膜等机制,进而提高组织抗氧化性损伤能力及降低继发性内毒素攻击、保护细胞有关。
本研究在一定程度上证实了在脑缺血早期给予外源性PCr可有效减轻脑组织缺血及缺血再灌注损伤,维持脑功能,并有可能减轻脑损伤继发的其他组织器官损伤。为临床用药提供了实验和理论依据。
[1] The Royal Pharmaceutical Society. Martindale:The Extra Pharmacopoeia[M]. 31st ed. London: Pharmaceutical Press,1996.1695.
[2] Du GH, Qiu Y, Zhang JT. Salvianolic acid B protects the memory functions against transient cerebral ischemia in mice[J]. JNA PR, 2000, 2(2) :145-152.
[3] 秦厉杰.外源性磷酸肌酸治疗急性脑梗死的疗效观察[J].中国实用神经疾病杂志,2007,10(3): 31-32.
[4] Jiang YF,Pan YS,Huang QF,et al.The effect of herbs on cerebral energy metabolism in cerebral ischemia-reperfusion mice[J].Chin Med J,2001,114(8):881-883.
[5] 张颖,蒋玉凤,刘智勤,等.丹酚酸B对小鼠脑缺血不同时间脑能量代谢及脑水肿的作用[J].药学学报,2007,42(12):1250-1253.
[6] 王汝卫.磷酸肌酸的药理与临床应用[J].首都医药,1999,6(5):32.
[7] 邹玲莉,李秋莎,韩国柱,等.外源性磷酸肌酸在大鼠体内的药代动力学和代谢处置[J].药学学报, 2011,46(1):75-80.

