抗贫血药物Peginesatide
抗贫血药物Peginesatide
peginesatide;抗贫血药物;透析;慢性肾病
Affymax和武田(Takeda)制药有限公司合作开发的促红细胞生成素(ESAs)类药物peginesatide(商品名:Omontys)于2012年3月27日被美国FDA批准用于接受透析的慢性肾病(CKD)患者的抗贫血治疗。该药不适用于未接受透析的CKD患者、接受抗癌治疗的非CKD引起的贫血患者以及需立即输血的贫血患者。Peginesatide为分子中含2个相同的21-氨基酸边链的聚乙二醇化二聚肽,通常制成乙酸盐形式。药理研究表明:本品可通过与人促红细胞生成素受体结合并刺激人体内红细胞前体来促进红细胞生成。
本品化学结构式:
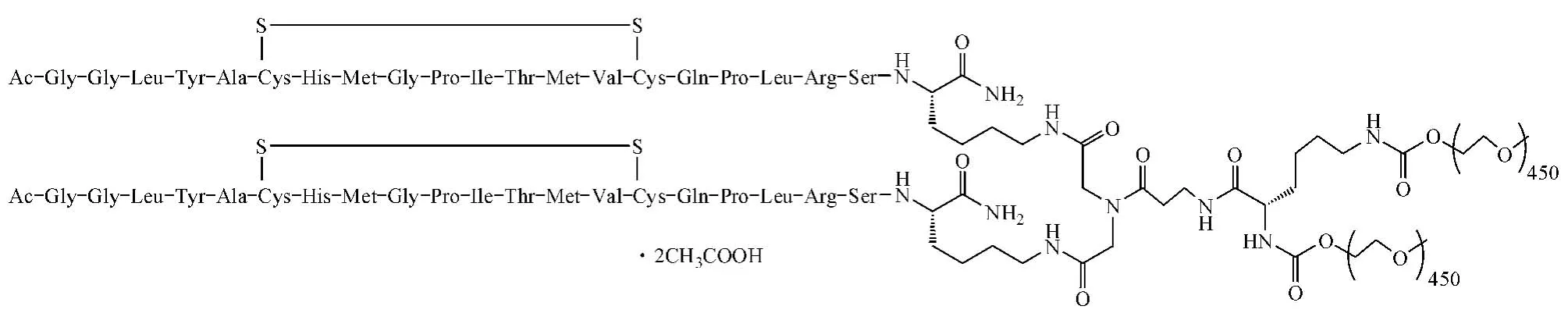
CAS:913976-27-9
药动学给透析患者单剂量静脉和皮下注射peginesatide(0.03~0.1 mg·kg-1),结果显示:Cmax和AUC均呈剂量依赖性增加;皮下注射时血药浓度达峰时间约为48 h;生物利用度约为46%。采用放射性标记的方法进行的临床前研究表明:本品静脉和皮下给药时均主要以原药形式经尿液排泄。
在健康受试者中进行的药动学研究表明:本品静脉和皮下给药时的平均半衰期(t1/2)分别为(25.0±7.6)和(53.0±17.7)h。而给透析患者静脉给药时的平均t1/2达(47.9±16.5)h;平均系统清除率为(0.5±0.2)mL·h-1·kg-1,平均分布容积为(34.9±13.8)mg·kg-1。每4周静脉或皮下注射本品未见药物蓄积现象。本品在接受透析的CKD患者体内的药动学性质不因患者年龄、性别或种族的不同而发生变化。
临床研究两项多中心、随机、阳性对照、开标记临床试验考察了入组前经阿法依泊汀或倍他依泊汀等ESAs类药物治疗的接受透析的CKD患者将peginesatide作为维持治疗药物的有效性和安全性。其主要指标均为给药第29~36周时血色素水平较给药前的变化值。第1项研究中,给受试患者静脉注射依泊汀,然后按2∶1的比例随机分为本品治疗组(n=524)和依泊汀对照组(n=269),两组患者给药前血色素水平平均值为113 g·L-1,平均用药时间分别为1.14和1.25年。第2项研究中分组前依泊汀的给药方式为静脉或皮下注射,本品治疗组(n= 542)和依泊汀对照组(n=273)患者的给药前血色素水平平均值为112 g·L-1,平均用药时间分别为1.17和1.16年。两项研究中,本品和依泊汀的平均给药剂量分别为每月0.07 mg·kg-1和每周113 U·kg-1。结果显示:第1项研究中,29~36周时,本品治疗组和依泊汀对照组患者血红素水平分别下降2.4和0.9 g·L-1(95%置信区间为-3.0~-0.1 g·L-1);第2项研究中,两组患者该值分别下降0.7和1.7 g·L-1(95%置信区间为-2.6~-0.5 g·L-1)。
上述两项研究对使用本品导致的死亡、心肌梗死、中风或充血性心衰、心绞痛、心律失常等严重不良反应进行了统计,结果显示:本品治疗组出现上述事件之一的患者比例低于依泊汀对照组[22.8%vs24.4%,风险比为0.95(95%置信区间为0.77~1.17)]。两组患者中出现的最常见不良反应包括腹泻(18.4%vs15.9%)、恶心(17.4%vs19.6%)、呕吐(15.3%vs13.3%)、贫血(18.4%vs19.4%)、咳嗽(15.9%vs16.6%)和头痛(15.4%vs15.9%)等。
此外,免疫原性试验结果显示:2 357名受试患者中有29名(1.2%)体内被检测到本品的特异性结合抗体;且与静脉给药组相比,皮下给药组的检出率更高(1.9%vs 0.7%)。采用细胞功能体外分析方法在0.9%的患者中检出本品中和抗体,抗体阳性患者中约有1/2的人其抗体的存在与血色素水平下降、为维持血色素水平而增加本品剂量以及输血有关。所有临床试验中均未出现纯红细胞再生障碍(PRCA)病例。
R 973.3

