不同介质对硝基苯选择还原制备苯基羟胺的影响
刘世娟,蒋景阳
(1.吉林师范大学 化学学院,吉林 四平 136000;2.大连理工大学 化工与环境生命学部精细化工国家重点实验室,辽宁 大连 116012)
近几十年,CO2和H2O已被作为绿色溶剂代替传统的有机反应溶剂,如CO2代替一些易挥发、有毒的有机溶剂用于有机化合物的合成和萃取中,尤其是在药物中[1,2]。而由CO2溶于水可形成的CO2-H2O体系,其 pH值可以达到3[3,4]:反应结束,没有CO2,体系酸性基本消失。这样在反应结束后,不用加碱中和反应体系,也没有盐的生成,CO2和H2O可以重复使用,降低了对环境的污染。
最近,我们在CO2-H2O体系中首次研究了锌粉选择还原芳香硝基化合物制备芳香羟胺[5,6]。这个体系完全消除NH4Cl,在优化的条件下苯基羟胺的产率达88%。带有其它官能团的芳香硝基化合物也能被选择还原为相应芳香羟胺。本文着重研究在室温常压下CO2-H2O体系中加入不同有机溶剂和无机盐电解质等条件对锌粉选择还原硝基苯(NB)制备苯基羟胺(PHA)的影响。
1 实验部分
向三口玻璃烧瓶中加入10mmol硝基苯、一定量Zn粉、20mL去离子水(或适量无机盐的20mL水溶液),将反应器放入预热的带有磁力搅拌器的水浴锅中。如反应中需CO2-H2O体系酸性,需接上进气管和出气管。CO2进气管插入液面下,CO2出气管接上鼓泡器,在室温常压下通入CO2进行反应。反应结束后,减压过滤除去锌粉,用CH2Cl2洗涤滤饼,水层用NaCl饱和,用CH2Cl2萃取。有机相合并用无水Na2SO4干燥,经高效液相色谱分析,确定原料与产物的含量。
2 结果与讨论
2.1 不同溶剂对硝基苯选择还原反应的影响
在CO2-H2O体系中,此反应是一个由水相、有机相、固体和气体组成的多相反应。硝基苯和苯基羟胺在水中的溶解度很小,为了增加它们在反应液中的溶解性,在体系中探索了加入有机溶剂对此反应的影响,结果见表1。
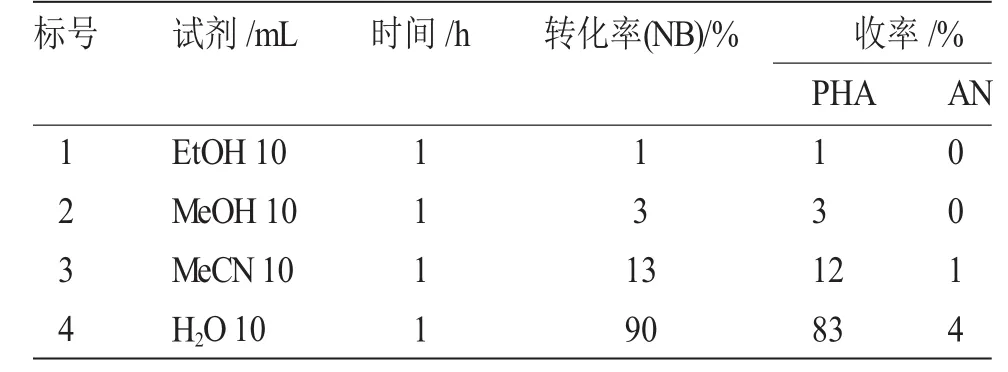
表1 反应介质对硝基苯选择还原反应的影响Tab.1 The effect of reaction medium on the selective reduction of NB
由表1可以看出,反应介质对硝基苯选择还原制备苯基羟胺有明显的影响,在CO2-H2O体系中加入有机溶剂,反应变慢。这可能是因为此反应的快慢与反应溶剂的介电常数有关,实验中过程中所使用的溶剂介电常数见表2。
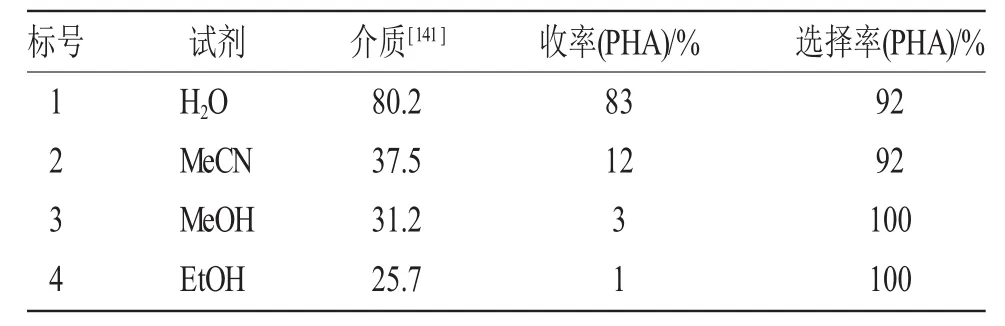
表2 反应中各种溶剂的介电常数Tab.2 Dielectric constants of different solvents during the reaction
由表2可见,随着溶剂的介电常数降低,苯基羟胺的产率降低,但苯基羟胺的选择性提高。水的介电常数最大,所得苯基羟胺产率也最高(entry1),乙醇中得到的苯基羟胺产率最低(entry 4)。在CO2-H2O体系加入有机溶剂,实验过程中可以看到液体是互溶的,这可能有助于生成的苯基羟胺从锌表面脱附进入溶液中,阻止其进一步还原成苯胺,提高其选择性(92%~100%)。反应速率慢与反应介质的酸性有很大的关系,实验中也粗略测定了溶液的pH值,发现在CO2-H2O体系中加入上述有机溶剂后,溶液的酸性变弱,因此,导致反应速率变慢。这与文献[5]报道的高温时由于CO2在H2O中的溶解度变小,体系的酸性变弱,反应速率变慢相一致。在CO2-H2O体系中反应效果最好,又因为CO2和H2O是绿色溶剂,所以本文没有再探索其它反应介质对选择还原硝基苯制备苯基羟胺反应的影响。
2.2 不同电解质对硝基苯选择还原反应的影响
在NH4Cl水溶液中,Zn粉选择还原硝基苯制备苯基羟胺反应过程中需严格控制Zn粉的加入速度,需分批加入Zn粉,否则不易得到高选择性和高产率的苯基羟胺。而在CO2-H2O体系中,实验过程中锌粉都是一次性在反应前加入的,苯基羟胺的产率可达88%,其选择性可达90%以上;实验中也发现CO2-H2O体系中的反应时间比NH4Cl水溶液中的反应时间长,原因可能与反应介质有关,所以探索了在CO2-H2O体系中加入不同无机盐电解质对此反应的影响并与NH4Cl水溶液中的反应结果相比较。
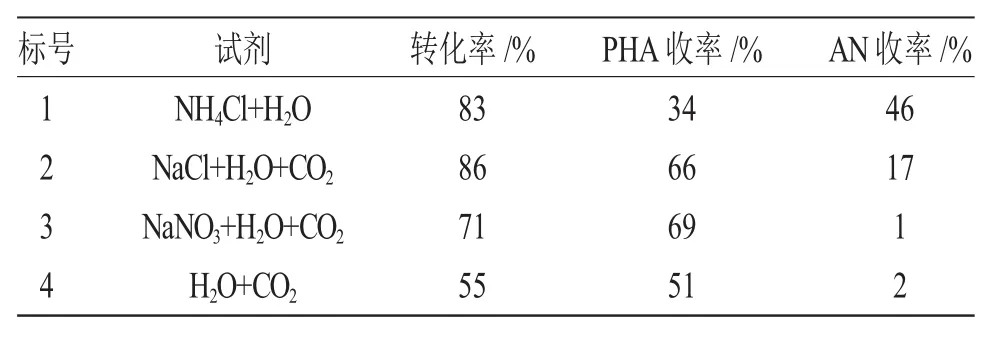
表3 不同电解质对硝基苯选择还原反应的影响Tab.3 Effect of different electrolyte on the selective reduction of NB
由表3可见,在CO2-H2O体系中加入中性的无机盐电解质,确实加快硝基苯选择还原反应的反应速率(2#,3#);在含 Cl的溶液中反应速率更快(2#),但在含Cl溶液中,苯基羟胺的选择性低,可能是由于生成的苯基羟胺未来得及脱附ZnO表面就被进一步还原生成苯胺。此还原反应在含Cl溶液中反应速率快,可能与反应的剧烈程度和Cl-对金属的腐蚀都有关系[7]。在CO2-H2O体系中加入NaNO3等无机盐电解质反应速率比CO2-H2O体系中的反应速率快(3#,4#),说明体系中电解质的存在增加了溶液中的离子强度,加快了电子的转移速度,所以反应速率加快;在CO2-H2O体系中加入NaNO3的反应结果最好(3#),苯基羟胺的选择性可达97%。
通过上面的实验可以看到:溶液的酸性、离子强度确实影响硝基苯选择还原制备苯基羟胺反应。而在CO2-H2O体系中反应速率慢与这些因素都有关系。CO2-H2O体系中的反应更温和,易于控制,有利于得到高产率的苯基羟胺。为了提高反应速率可以适当加入中性的无机盐,如NaNO3,反应过程中仍保持较高的苯基羟胺选择性。
3 结论
本文探索了在环境友好的CO2-H2O体系中,各种反应介质对硝基苯选择还原制备苯基羟胺反应的影响。在CO2-H2O体系中加入有机溶剂,降低了溶液的导电性,减慢了反应速率;加入无机盐电解质增强了溶液的导电性,加速了反应速率。在所考察的无机盐电解质中NaNO3的反应效果最好,不仅加快了反应速率、保持高的苯基羟胺选择性,而且不影响CO2和H2O的重复使用。
[1]雍技,潘见,张文成.超临界CO2萃取黄酮类物质的研究进展[J].安徽化工,2005,135:22-24.
[2]任杰,天征宇,腾新荣.超临界CO2在聚合反应中的应用[J].合成树脂及塑料,2004,21:79-82.
[3]Toews K L,Shroll R M,Wai C M,et al.Ph-Defining equilibrium between water and supercritical CO2.Influence on SFE of organics and metal chelates[J].Anal.Chem.,1995,67(22):4040-4043.
[4]Roosen C,Ansorge-Schumacher M,MangT,et al.Gainingp H-controlinwater/carbondioxi debiphasicsy stems[J].Green Chem.,2007,(9):455-458.
[5]Liu S,Wang Y,Jiang,J,Jin Z.The selective reduction of nitroarenes to N-arylhydroxyl-amines using Zn in a CO2-H2O system[J].Green Chem.,2009,11:1397-1400.
[6]Liu S J,WangY H,HaoY P,JiangJ Y.Promotingeffect of ethanol on the synthesis of N-(2-methylphenyl)hydroxylamine from o-nitrotoluene in Zn-CO2-H2O system[J].Chin.Chem.Lett.,2011,22:221-224.
[7]Agrawal A.and Tratnyek P.G..Reduction of nitro aromatic compounds byzero-valent iron metal[J].Environ.Sci.Technol.,1996,30:153-160.
——化工原料、农副产品

