拟南芥山奈酚糖苷对UV-B辐射的响应
牟晓飞,王 垠,李 敏,于 涛,杨玉焕
(东北林业大学盐碱地生物资源环境研究中心,东北油田盐碱植被恢复与重建教育部重点实验室,哈尔滨 150040)
人类排放含氟氯烃和其他臭氧对抗物等行为会导致大气平流层的臭氧衰减,从而使到达生物圈的UV-B辐射增加,并对陆地生物的生命活动产生影响,而合成紫外吸收物质被认为是植物在生理生化层面抵御UV-B辐射伤害的有效防御机制[1-3]。黄酮类化合物(Flavonoids)作为一类重要的植物次生代谢产物,在植物防御UV-B辐射方面扮演着重要角色[4]。根据中央三碳链的氧化程度、成环与否等,将黄酮类化合物详细分为13个大类即黄酮、黄酮醇、二氢黄酮、二氢黄酮醇、花色素、黄烷醇、异黄酮、二氢异黄酮、查耳酮、橙酮、苯并色原酮、双黄酮和高异黄酮等[5]。天然黄酮类化合物多为上述基本结构的衍生物,在植物体内大部分与糖结合成糖苷,少部分以游离形式存在[4]。
山奈酚和槲皮素是最常见的黄酮苷元,二者的衍生物在双子叶植物中主要是以糖苷形式定位于表皮细胞的液泡中,发挥吸收紫外辐射的作用[6-7]。很多研究表明山奈酚糖苷在响应UV-B辐射方面有积极作用。Fischbach等发现欧洲云杉(Picea abies)针叶液泡中的山奈酚-3-葡萄糖苷在针叶发育过程中逐渐被双酰化葡萄糖苷取代,在表皮细胞壁处形成紫外屏蔽物质,这种酰化作用可使其吸收峰移至UV-B波段,有利于防御UV-B辐射[8]。Kolb等在葡萄的一个种植品种(Vitis vinifera cv Silvaner)叶片中检测到两种山奈酚糖苷的总量受UV-B影响而增加[7]。Morales等发现垂直桦(Betula pendula)受UV-B辐射影响后叶片中山奈酚-3-鼠李糖苷的积累有升高趋势[9]。研究发现伴随UV-B辐射增强植物体内槲皮素糖苷/山奈酚糖苷的比率升高,由此推断在防御UV-B辐射方面槲皮素糖苷比山奈酚糖苷更为有效,但在UV-B辐射下山奈酚糖苷含量也增加的[10-12]。
研究表明,山奈酚糖苷对植物防御UV-B辐射有重要作用。Li等发现拟南芥突变体tt4(黄酮合成途径中关键酶查耳酮合成酶功能缺失)与野生型相比缺少山奈酚衍生物,认为山奈酚衍生物的缺失可能是导致其UV-B辐射敏感性的原因[13]。Lois和Buchanan所使用的拟南芥突变体uvs(对UV-B辐射高度敏感,而对其他胁迫的响应与野生型相同)仅缺乏一种山奈酚鼠李糖苷而其他酚类代谢产物正常[14]。其后研究较多地关注槲皮素糖苷/山奈酚糖苷的比率对UV-B辐射的响应[15-16],而未见报道分析山奈酚糖苷各组分对UV-B辐射的响应差异及意义。
拟南芥中主要积累三种山奈酚糖苷,即山奈酚-3-O-鼠李葡萄糖基-7-O-鼠李糖苷(Kaempferol-3-O-rhamnosyl glucoside-7-O-rhamnoside)、山奈酚-3-O-葡萄糖基-7-O-鼠李糖苷(Kaempferol-3-O-glucoside-7-O-rhamnoside)和山奈酚-3-O-鼠李糖基-7-O-鼠李糖苷(Kaempferol-3-O-rhamnoside-7-O-rhamnoside)[17]。本文研究拟南芥山奈酚糖苷的组分及含量(组合模式)对UV-B辐射的响应,并同时检测山奈酚糖苷合成途径关键酶编码基因表达的变化,为进一步认识山奈酚糖苷在植物应对UV-B辐射过程中的作用积累材料。
1 材料与方法
1.1 材料及培养
哥伦比亚野生型(Columbia-0 ecotype)拟南芥种子购自拟南芥生物资源中心(Arabidopsis Biological Resource Center,US)。种子消毒冲洗后播种于1/2 MS培养基中,置于4℃黑暗环境中3 d打破休眠后移入自动控制温室中培养,温度20~25 ℃,光照 150 μmol·m-2·s-1,每天光照 16 h(6:00~22:00),空气相对湿度50%~70%。选取长出2片子叶的幼苗和长至4片真叶的成苗用于试验。
1.2 UV-B辐射处理与样品采集
参照Hectors等的UV-B辐射处理方法[18],在植物培养室内使用日光灯管提供正常光照,使用Philips公司的UV-B灯管(TL20W/01RS,最大波长311 nm,波宽20 nm)进行UV-B辐射处理,UV-B灯管用0.13 mm厚度的醋酸纤维素膜滤除少量UV-C,每隔2 d更换1次,以保证辐照强度一致。
UV-B辐射处理的拟南芥幼苗(生长1周,2片子叶)和成苗(生长2周,4片真叶),每天在光周期(6:00~22:00)的11:00~17:00施以UV-B辐射,辐射强度40 μw·cm-2。连续处理7 d后,于第8天的11:00(UV-B处理前)、17:00(UV-B处理后)、22:00(光周期结束)、第9天的6:00(暗周期结束)计4个时间点采集叶片用于山奈酚糖苷和叶绿素含量测定,每个样品至少3个重复。于17:00(UV-B处理后)采集叶片用于关键酶基因表达检测。
1.3 叶绿素含量测定
采用Arnon方法测定叶绿素含量[19],计算叶绿素a/b。
1.4 山奈酚糖苷含量测定
参照Li等方法提取拟南芥样品中的山奈酚糖苷[13]。通过对比保留时间、紫外吸收光谱(200~400 nm)和相对峰面积初步判定拟南芥中含有三种山奈酚糖苷即山奈酚-3-O-鼠李葡萄糖基-7-O-鼠李糖苷(K1)、山奈酚-3-O-葡萄糖基-7-O-鼠李糖苷(K2)、山奈酚-3-O-鼠李糖基-7-O-鼠李糖苷(K3)。使用Agilent 1100 LC/MSD液相和离子阱质谱联用的增强分辨扫描和中性粒子丢失扫描模式,通过分析母离子质量和相应片段峰谱完成三种山奈酚衍生物的准确鉴定。利用Waters高效液相色谱(1525梯度洗脱泵、717自动进样器、2487紫外检测器)以山奈酚(Kaempferol,KA)为内标测定山奈酚糖苷含量。使用Discovery C18色谱柱(250 mm×4.6 mm,5 μm;Supelco公司)以及流动相A(含0.01%冰乙酸的超纯水)和流动相B(乙腈,色谱纯)梯度洗脱,(0→5 min,0%B→7%B;6 min→20 min,7%B;21 min→45 min,7%B→22%B;46 min→55 min,22%B→100%B),流速 1.5 mL·min-1,检测波长330 nm,进样量20 μL。拟南芥幼苗和成苗的山奈酚糖苷样品在330 nm检测波长下的高效液相色谱图如图1所示。
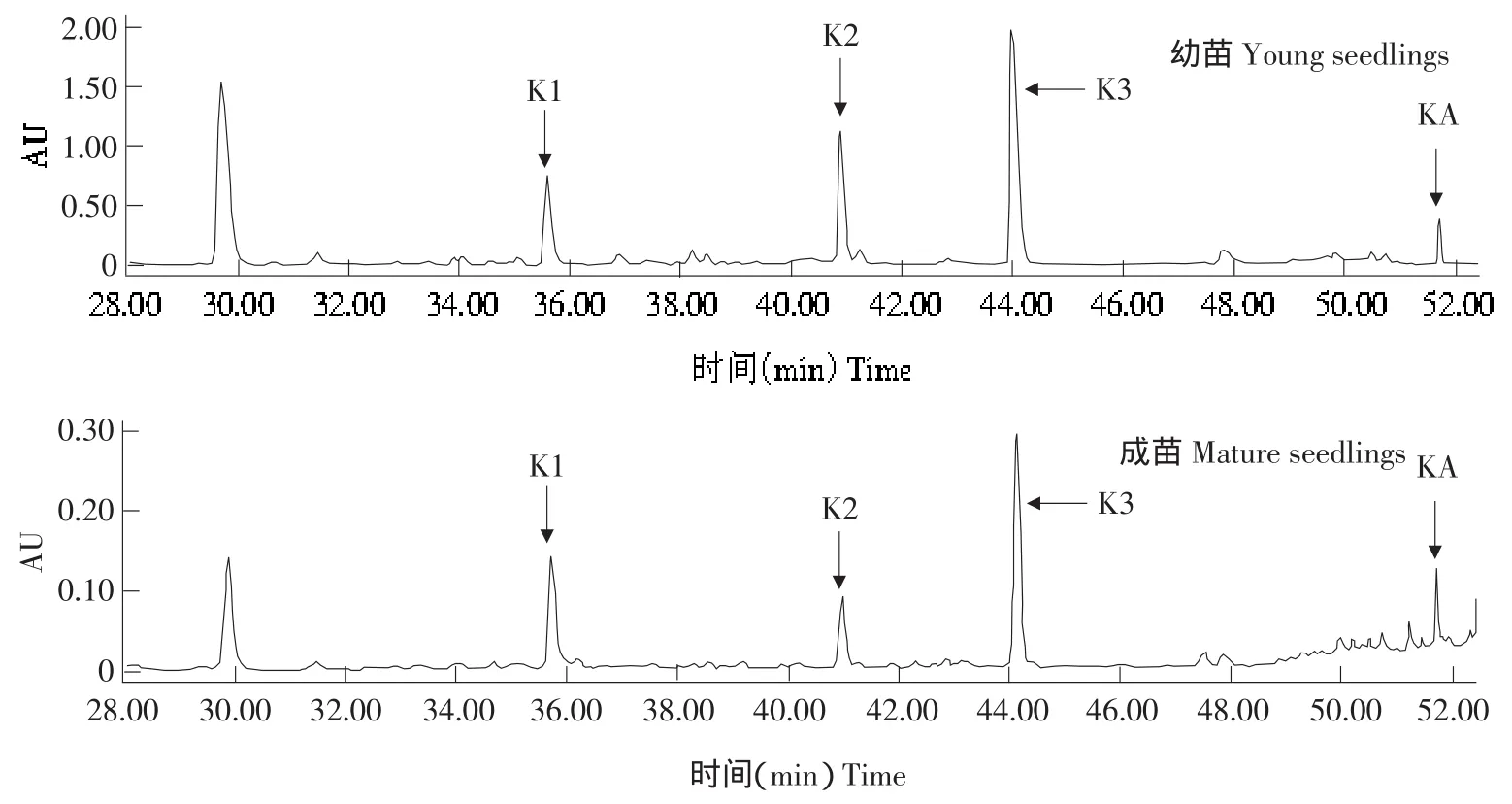
图1 拟南芥叶片中山奈酚糖苷的高效液相色谱图Fig.1 HPLC chromatogram of kaempferol glycosides in Arabidopsis
1.5 基因表达的检测
采用Real-time PCR技术检测山奈酚糖苷合成途径中关键酶编码基因fls1和chs表达水平(以actin2基因为内参)。用Trizol试剂(Invitrogen公司)提取样品总RNA。按照TAIR数据库提供的基因序列设计特异引物(见表1),引物均由上海生工有限公司合成。按照宝生物(大连)有限公司生产的Transcriptor First Strand cDNA synthesis kit试剂盒说明书合成全长cDNA第一链,加去离子水稀释10倍作为模板,在DNA Engine Opticon2TM实时定量PCR仪上扩增。25 μL的PCR反应体系中含有2 μL的cDNA模版,12.5 μL的SYBR Premix Ex TaqTM(2×),正向、反向引物各0.5 μL,超纯水9.5 μL。PCR反应条件为94℃60 s、94℃20 s、55℃20 s、72℃20 s,45个循环,读板温度79℃。反应结束后,采用Dissociation Curves Software(MJ Research Inc.)软 件分析溶解曲线,琼脂糖凝胶电泳检测PCR产物长度以确定产物特异性。以actin2(At3g18780)为内参,使用软件Q-Gene计算fls1和chs基因相对表达量,软件算法基于Muller等公式[20]。

表1 试验所用引物Table 1 Forward and reverse primers used in Real-time PCR
1.6 数据处理
应用Excel和SPSS软件进行数据分析,并采用单因素方差分析(One-Way ANOVA)检验对照与处理之间差异显著性。
2 结果与分析
2.1 叶绿素a/b对UV-B辐射的响应
叶绿体是植物光合作用的场所,也是自然界中光能吸收、传递和转换中重要的细胞结构。UV-B辐射能够破坏植物叶绿体结构及其前体,或使叶绿素合成受阻从而降低叶绿素含量[21]。许多研究发现,叶绿素a/b变化与UV-B辐射关系密切,并以叶绿素a/b作为衡量植物受损害情况的指标[21-24]。经过7 d的UV-B处理后,无论是拟南芥幼苗还是成苗,叶绿素a/b与对照植株相比均无明显差异,只有幼苗叶绿素a/b在UV-B处理结束时显著低于对照植株,但经光恢复、暗恢复阶段后也回复至对照水平(见图2)。这表明试验采用的UV-B辐射强度对拟南芥植株的伤害程度未超出植株的自我修复能力,符合试验设计要求,即在相对长期(7 d)、低强度的UV-B辐射下观察山奈酚糖苷响应。
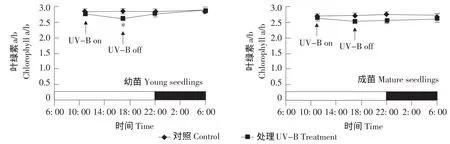
图2 拟南芥叶绿素a/b对UV-B辐射的响应(平均值±标准差)Fig.2 Influence of UV-B radiation on the chlorophyll a/b change of Arabidopsis(mean±SD)
2.2 山奈酚糖苷含量对UV-B辐射的响应
拟南芥幼苗和成苗山奈酚糖苷含量差异很大,幼苗山奈酚-3-O-鼠李葡萄糖基-7-O-鼠李糖苷(K1)、山奈酚-3-O-葡萄糖基-7-O-鼠李糖苷(K2)和山奈酚-3-O-鼠李糖基-7-O-鼠李糖苷(K3)的含量均为成苗10倍(见图3、4)。

图3 拟南芥幼苗山奈酚糖苷含量对UV-B辐射的响应(平均值±标准差)Fig.3 Influence of UV-B radiation on the kaempferol glycosides content of young Arabidopsis seedlings(mean±SD)
经过7 d的UV-B处理,拟南芥幼苗中三种山奈酚糖苷含量均高于未经UV-B处理的对照植株,山奈酚糖苷表现为响应UV-B辐射而积累(见图3)。拟南芥成苗情况有所不同,UV-B处理植株在非UV-B处理时间特别是经过暗周期恢复后,三种山奈酚糖苷含量与对照植株均无显著差异,只是在UV-B处理及其后的光恢复阶段才显著高于对照植株,山奈酚糖苷含量未因连续7 d的UV-B处理而维持在一个显著高于对照植株的水平(见图4)。
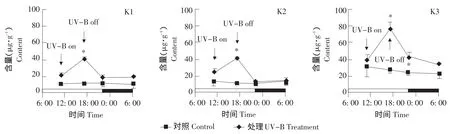
图4 拟南芥成苗山奈酚糖苷含量对UV-B辐射的响应(平均值±标准差)Fig.4 Influence of UV-B radiation on the kaempferol glycosides content of mature Arabidopsis seedlings(mean±SD)
对应于UV-B辐射处理以及光、暗周期的转变,三种山奈酚糖苷含量都呈现出一定的变化规律。在拟南芥幼苗中,一日内K1含量的变化最为明显,UV-B处理导致K1含量急剧增加,而后在UV-B处理结束后的光恢复阶段迅速下降到UV-B处理前水平,并在其后的暗周期中也维持在一个稳定水平。K2、K3含量也有类似于K1的变化趋势,但变化幅度很小。K2含量在一日中只有暗周期前、后的两个采样点之间差异显著,而K3含量是暗周期结束时分别与暗周期开始时、UV-B处理结束时差异显著。受UV-B辐射诱导,拟南芥幼苗K1含量提高163.35%,而K2和K3含量仅提高11.58%和17.35%(见图3)。
拟南芥成苗中,三种山奈酚糖苷含量随UV-B处理及光、暗周期变化的趋势与幼苗相似,而且K2、K3含量变化也同K1一样明显,尽管它们的变化幅度(绝对数值)小于幼苗。一日内三种山奈酚糖苷含量因UV-B处理都有较大幅度增加,K1、K2、K3含量分别提高91.61%、67.67%、94.22%,并在UV-B处理结束时达到峰值,随后在光恢复阶段迅速回落,至光周期结束时达到UV-B处理前水平(K3含量稍高),并维持到暗周期结束、新的光周期开始(见图4)。
2.3 山奈酚糖苷合成关键酶基因表达对UV-B辐射的响应
山奈酚糖苷的生物合成源于苯丙醇代谢途径,在拟南芥中已较清楚[17]。在该途径中,chs基因编码的查耳酮合酶是山奈酚衍生物前期合成步骤中的关键控制酶,存在于内质网、细胞核以及植物液泡膜中,能够催化柚皮苷查耳酮的合成,也涉及到植物生长激素的极性运输和根的向重力性的调节,chs功能缺失的tt4突变体不能合成山奈酚衍生物[13];fls1基因编码催化二氢黄酮生成黄酮醇的黄酮醇合酶,该酶能够催化二氢山奈酚合成山奈酚,从而进一步形成山奈酚糖苷。根据TAIR拟南芥数据库信息,本文采用Real-time PCR技术检测UV-B处理结束时拟南芥中这两个山奈酚代谢关键酶基因(chs和fls1)的表达水平,并与对照拟南芥进行比较,该时间点上的基因表达水平代表着基因对UV-B处理的响应。对应于UV-B处理,拟南芥幼苗、成苗chs和fls1基因的表达水平均表现为上调趋势,除成苗fls1外均显著高于对照植株。chs编码的查耳酮合酶是山奈酚糖苷合成途径中位于上游的关键酶,UV-B处理下chs表达水平的上调与三种山奈酚糖苷含量的增加是对应的。位于山奈酚糖苷合成途径下游的黄酮醇合酶,其编码基因fls1表达水平对应于UV-B处理的上调幅度相对小些,与山奈酚糖苷含量的增加不是很对应,尤其是成苗中的情况(见图5)。

图5 拟南芥山奈酚糖苷合成关键酶基因表达对UV-B辐射的响应(平均值±标准差)Fig.5 Expression profile of kaempferol glycosides metabolism related genes in response to UV-B radiation(mean±SD)
3 讨论
植物应对UV-B辐射最常见方式就是合成吸收紫外辐射的次生代谢产物如黄酮类化合物。植物中的黄酮类化合物多为其基本结构的衍生物,并大部分是与糖结合成糖苷形式存在[4]。作为最常见黄酮类苷元之一的山奈酚,在双子叶植物中以糖苷形式定位于表皮细胞的液泡中,起到吸收紫外辐射作用[6-7],并有报道拟南芥、欧洲云杉、垂直桦等植物经紫外辐射后山奈酚糖苷积累有增加趋势[8-9,12]。本试验对拟南芥连续7 d的UV-B辐射处理试验表明,不仅山奈酚糖苷含量对应UV-B处理有即时性增加,而且经过7 d的处理后,拟南芥幼苗中山奈酚糖苷的积累水平也显著高于对照植株。
本试验对三种山奈酚糖苷组分即山奈酚-3-O-鼠李葡萄糖基-7-O-鼠李糖苷(K1)、山奈酚-3-O-葡萄糖基-7-O-鼠李糖苷(K2)和山奈酚-3-O-鼠李糖基-7-O-鼠李糖苷(K3)的具体分析表明,它们应对UV-B辐射的变化并不是一致的。在拟南芥幼苗中,K1含量应对UV-B辐射的即时性变化幅度较大,而K2、K3含量变化幅度很小(见图3)。在拟南芥成苗中,K1、K3含量变化幅度要大于K2含量变化幅度(见图4)。Lois等研究表明,缺失一种山奈酚鼠李糖苷的拟南芥突变体uvs表现出对UV-B的高度敏感[14]。可见,不仅要分析山奈酚糖苷总量,还要深入分析山奈酚糖苷各组分及含量即组合模式的变化,对于认识山奈酚糖苷在植物应对UV-B辐射过程中的作用具有重要意义。
研究表明,拟南芥幼苗中三种山奈酚糖苷含量是成苗10倍,且经过7 d的UV-B辐射处理后,幼苗中山奈酚糖苷积累水平显著高于对照,而成苗中却不同。在对拟南芥芥子酸酯的研究中也发现类似情况,并推断拟南芥芥子酸酯对于UV-B辐射的防护作用,幼苗属于组成型防御(Constitutive defense),而到成苗则转变为诱导型防御(Inducible defense)。山奈酚糖苷是否属于这种情况,还有待于进一步探讨。
[1] Frohnmeyer H,Staiger D.Ultraviolet-B radiation-mediated responses in plants balancing damage and protection[J].Plant Physiology,2003,133(4):1420-1428.
[2] Bassman J H.Ecosystem consequences of enhanced solar ultraviolet radiation:Secondary plant metabolites as mediators of multiple trophic interactions in terrestrial plant communities[J].Photochemistry Photobio1ogy Science,2004,79(5):382-398.
[3] Tsoyi K,Park H B,Kim Y M,et al.Protective effect of anthocyanins from black soybean seed coats on UV-B-induced apoptotic cell death in vitro and in vivo[J].Journal of Agricultural and Food Chemistry,2008,56(22):10600-10605.
[4] Harborne J B,Williams C A.Advances in flavonoid research since 1992[J].Phytochemistry,2000,55(6):481-504.
[5] 高锦明.植物化学[M].北京:科学出版社,2003:157-1591.
[6] Cerovic Z G,Ounis A,Cartelat A,et al.The use of chlorophyll fluorescence excitation spectra for the non-destructive in situ assessment of UV-absorbing compounds in leaves[J].Plant,Cell and Environment,2002,25:1663-1676.
[7] Kolb C,Käser M A,Kopecky J,et al.Effects of natural intensities of visible and ultraviolet radiation on epidermal ultraviolet screening and photosynthesis in grape leaves[J].Plant Physiology,2001,127:863-875.
[8] Fischbach R J,Kossmann B,Panten H,et al.Seasonal accumulation of UV-B screening pigments in needles of Norway spruce[J].Plant Cell Environ,1999,22:27-37.
[9] Morales L O,Tegelberg R,Broschë M,et al.Effects of solar UV-A and UV-B radiation on gene expression and phenolic accumulation in Betula pendula leaves[J].Tree Physiology,2010,30:923-934.
[10] Olsson L C,Veit M,Weissenböck G,et al.Differential flavonoid response to enhanced UV-B radiation in Brassica napus[J].Phytochemistry,1998,49:1021-1028.
[11] Tegelberg R,Julkunen-Tiitto R,Aphalo P J.The effects of long-term elevated UV-B on the growth and phenolics of fieldgrown silver birch(Betula pendula)[J].Global Change Biology,2001(7):839-848.
[12] Ryan K G,Swinny E E,Markham K R,et al.Flavonoid gene expression and UV photoprotection in transgenic and mutant Petunia leaves[J].Phytochemistry,2002,59:23-32.
[13] Li J,Ou-Lee T M,Raba R,et al.Arabidopsis flavonoid mutants are hypersensitive to UV-B irradiation[J].The Plant Cell,1993(5):171-179.
[14] Lois R,Buchanan B B.Severe sensitivity to ultraviolet radiation in an Arabidopsis mutant deficient in flavonoid[J].Planta,1994,194:504-509.
[15] Ryan K G,Swinny E E,Winefield C,et al.Flavonoids and UV photoprotection in Arabidopsis mutants[J].Zeitschrift fur Naturforschung C:Journal of Biosciences,2001,56(9-10):745-754.
[16] Meißner D,Albert A,Böttcher C,et al.The role of UDP-glucose:Hydroxycinnamate glucosyltransferases in phenylpropanoid metabolism and the response to UV-B radiation in Arabidopsis thaliana[J].Planta,2008,228:663-674.
[17] Stracke R,Ishihara H,Huep G,et al.Differential regulation of closely related R2R3-MYB transcription factors controls flavonol accumulation in different parts of the Arabidopsis thaliana seedling[J].The Plant Journal,2007,50:660-677.
[18] Hectors K,Prinsen E,De Coen W,et al.Arabidopsis thaliana plants acclimated to low dose rates of ultraviolet B radiation show specific changes in morphology and gene expression in the absence of stress symptoms[J].New Phytologist,2007,175(2):255-270.
[19] Arnon D I.Copper enzymes in isolated chloroplasts polyphenoloxidase in Beat vulgaris[J].Plant Physiology,1949,24(1):1-15.
[20] Muller P Y,Janovjak H,Miserez A R,et al.Processing of gene expression data generated by quantitative real-time RT-PCR[J].Biotechniques,2002,32(6):1372-1379.
[21] 徐海明,张兴文,李东洺,等.干旱条件下增加UV-B辐射对大豆叶片光合色素的影响[J].东北农业大学学报,2010,41(3):12-16.
[22] 林文雄,吴杏春,梁义元,等.UV-B辐射胁迫对水稻叶绿素荧光动力学的影响[J].中国生态农业学报,2002,10(1):8-12.
[23] 侯扶江,贲桂英,颜景义,等.田间增加紫外线(UV)辐射对大豆幼苗生长和光合作用的影响[J].植物生态学报,1998,22(3):256-261.
[24] 訾先能,强继业,陈宗瑜,等.UV-B辐射对云南报春花叶绿素含量变化的影响[J].农业环境科学学报,2006,25(3):587-591.

