甘肃新选育党参品系与主栽品种的RAPD分析
杨 宁,陈锡莲,高新彦,史万斌,刘效瑞
(1.西北师范大学生命科学学院,甘肃 兰州 730070; 2.兰州市城关区徐家山林场,甘肃 兰州 730000;3.定西市旱作农业科研推广中心,甘肃 定西 743000)
我国对中药材的研究已有几千年的历史,中药材资源丰富,是世界中药材的主产国。甘肃省中药种植历史悠久,是全国药用党参(Codonopsispilosula)种植的主产区。中药材的品质关系到临床用药的安全有效,发展道地药材是实现中药现代化的关键,也是占有市场、增强产品竞争力的基本保障。目前,产生道地药材地域性现象的原因除了与栽培方法、生态环境、加工方法有关外,还与物种居群的遗传特异性有关,这可能是造成道地药材与非道地药材品质差异的原因。道地药材与非道地药材在形态和生药性状等特征上的差别并不显著,应用传统方法鉴别道地药材变得困难。因此,药材道地性研究已经成为中医药科研的重要课题[1-2]。
党参为桔梗科植物,党参及其同属多种植物的干燥根可入药,其性味甘平、无毒,有补中益气、生津止渴等功效。主治脾胃虚弱、中气不足、肺气亏虚、热病伤津、气短口渴、血虚萎黄、头晕心慌等症, 是我国传统的补益药[3]。甘肃党参产量居全国之首,主要生产于甘肃的武都、文县、宕昌、岷县、渭源、漳县等地[4]。目前党参生产中,普遍使用传统栽培育种方法,品系亲缘关系不明确,缺乏品系鉴定的分子依据,这已经成为甘肃党参产业发展的限制瓶颈之一。随机扩增DNA多态性(Random Amplified Polymorphic DNA,RAPD)技术以其操作简单、快速、花费少、DNA用量少、无放射性等优点,被广泛应用于中草药种质资源亲缘关系鉴定、遗传多样性及药材道地性研究等方面[5-8]。
本研究正是基于甘肃省党参生产及实际销售中不能提供科学的药材道地性鉴定方法等问题,利用RAPD技术对甘肃省定西市旱作农业科研推广中心新选育党参8个品系和2个主栽品种进行分析鉴定,考证其遗传多样性和亲缘关系,以期为甘肃省党参的产业化发展提供部分分子生物学依据。
1 材料与方法
1.1试验材料 本试验所用10个党参样品由甘肃省定西市旱作农业科研推广中心提供,采集于2010年6月。摘取10个党参样品的幼叶,用硅胶干燥后带回实验室。供试样品编号见表1。
1.2方法
1.2.1总DNA的提取 用SDS方法[9-10]提取植物基因组DNA。将足量党参的叶片加液氮研磨,加提取液后水浴保温,而后加入适量氯仿-异戊醇,离心后加无水乙醇使DNA析出。
1.2.2PCR扩增 反应在BIO-RAD普通型PCR仪上进行,RAPD引物由北京奥科生物技术公司生产,所用Taq酶及dNTPs购自天根生化科技(北京)有限公司。
引物筛选参照张建清等[11]的方法,略作修改。RAPD反应体系:100 ng·μL-1模板DNA 1 μL,10 μmol·L-1随机引物2 μL,2.5 μmol·L-1dNTPs 1 μL,10×Buffer 2.5 μL,2.5 U·μL-1Taq酶 0.5 μL,加ddH2O至25 μL。
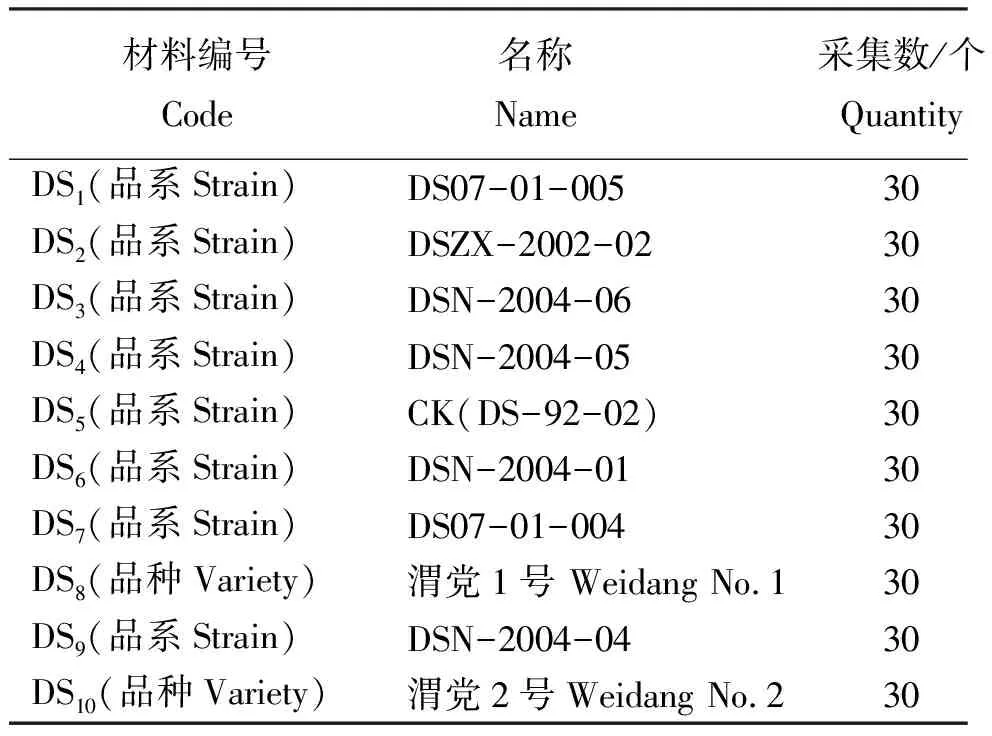
表1 供试材料编号、名称和采集数Table 1 Number, name and collection quantity of the tested materials
扩增程序:94 ℃预变性5 min后,94 ℃ 1 min,34.5 ℃ 1 min,72 ℃ 2 min,共计43个循环,最后72 ℃延伸10 min。
采用1.2%的琼脂糖凝胶电泳,溴化乙锭(EB)染色,UVI凝胶图像分析系统观察照相。每个试验至少重复3次。
1.2.3数据处理 参照Williams等[12]的方法,电泳扩增图谱中的每一条带(DNA片段)均为一个分子标记(Marker),且代表一个引物结合位点,所有位点的二元数据是通过统计标记各分子在相同电泳迁移率下(相同分子量片段)的有无得到的,有DNA扩增带(显性)为1,无带(隐性)记为0,强带和弱带赋值为1。由NTSYS-PC 统计分析软件系统中的Dice得到材料间的相似系数矩阵,建立系统聚类分支树状图。重复试验中能稳定出现的差异带即多态性位点用于数据分析。
2 结果与分析
2.1RAPD多态性分析 通过筛选,从60条随机引物中选择谱带清晰、重复性好、多态性较丰富的14条随机引物用于PCR扩增反应(表2)。14条引物共扩增出159个位点,其中多态性位点比率为46.43%,不同引物的扩增位点变幅为7~16个,平均每条引物能扩增出11.4个位点,图1为3号和5号引物的扩增结果。

表2 引物序列和扩增结果Table 2 Primers and amplified results
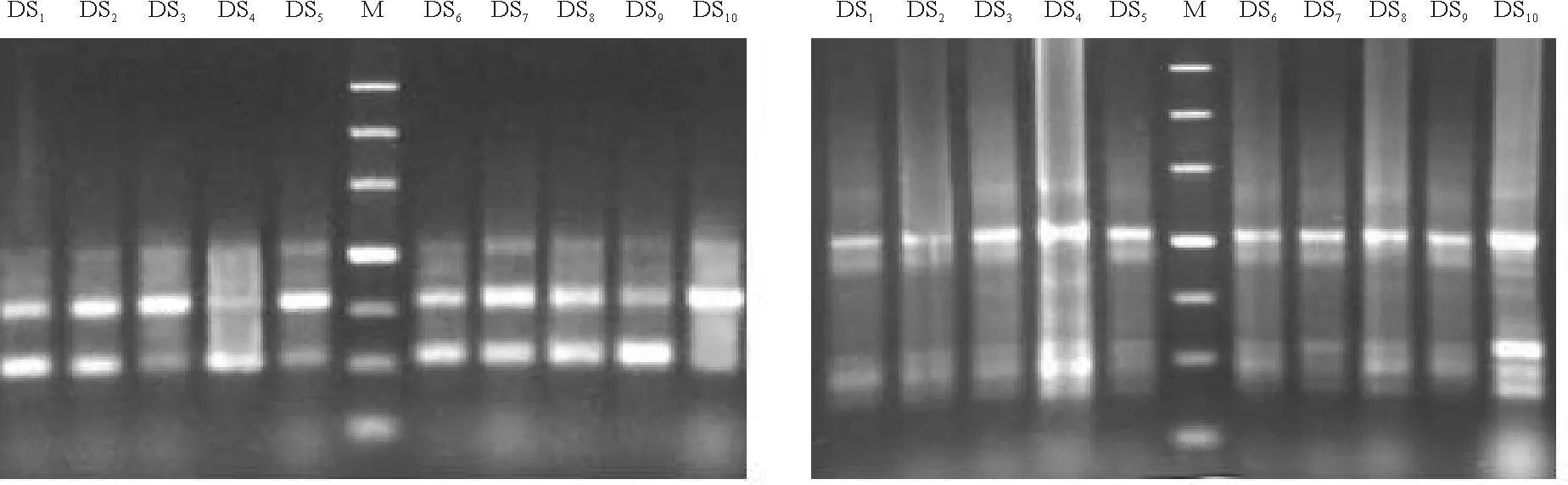
图1 引物P3(左图)和P5(右图)扩增的RAPD带型Fig.1 RAPD results generated by P3 (left) and P5 (right) primers
2.2遗传距离和聚类分析 用NTSYS-PS统计分析软件中的Dice方法得到材料间的遗传相似性系数和遗传距离(表3),供试材料间遗传相似系数(GS)值的变化范围为0.771 9~0.964 9,其平均值为0.834 2。相似系数越大,材料间的遗传距离越小;相似系数越小,反之亲缘关系越远。本研究所采用党参资源为甘肃省定西市旱作农业科研推广中心选育的8个新品系和2个主栽品种,即RAPD标记的是种间多态性,相似系数值变化范围较小,此结论与盛丽等[13]在当归种质资源RAPD分析中获得的结果相似。
根据RAPD数据得到的遗传相似系数和遗传距离图,按UPGMA法进行聚类分析,建立聚类分支树状图(图2)。DS6品系与所有其他供试材料的亲缘关系最远,可单独聚为一类;DS3品系与DS8品种的亲缘关系最近,其相似系数为0.964 9。其他党参材料间的遗传相似系数变化不大,表明党参的种间遗传关系较近。

表3 10个党参品种(品系)间的遗传相似性系数和遗传距离Table 3 Genetic similarity coefficient and genetic distance among 10 Codonopsis pilosula varieties (strains)
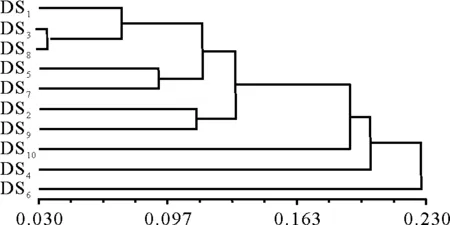
图2 10个党参品种(品系)的UPGMA聚类图Fig.2 UPGMA cluster analysis of 10 Codonopsis pilosula varieties (strains)
3 讨论与小结
3.1RAPD-PCR体系的建立 影响PCR扩增条带的因素有模板DNA、引物、dNTPs量、Taq酶、退火温度、电泳中的琼脂糖质量分数、电泳时间。本试验在前期工作中对模板DNA含量、引物含量、dNTPs含量、Taq酶含量4个因素进行了优化分析,进而建立了适合党参材料的RAPD-PCR扩增反应体系,并对引物退火温度和电泳中琼脂糖质量分数进行了梯度筛选,最终确定党参的最适RAPD-PCR体系为100 ng·μL-1模板DNA 1 μL,10 μmol·L-1随机引物2 μL,2.5 μmol·L-1dNTPs 1 μL,10×Buffer 2.5 μL,2.5 U·μL-1Taq酶 0.5 μL,ddH2O 18 μL;RAPD引物最佳退火温度为34.5 ℃,最适琼脂糖质量分数为1.2%。此体系的建立可为其他党参品种的RAPD扩增提供参照依据。
3.210个党参材料间的遗传相似性和多样性 RAPD是一种显性标记,能从分子水平上揭示材料间存在的遗传差异[14-16]。本研究从60条随机引物中筛选出谱带清晰并呈多态性的14条引物,结果证明其稳定性较好。不同供试材料在同一引物的RAPD图谱中的主谱带基本一致,说明它们的遗传背景具有很大的相似性,这是鉴定党参真伪的重要标记,可以用于党参药材道地性鉴定。另外,不同品种的次谱带之间存在不同程度的差异,说明不同党参品系间的遗传背景也具有一定的多样性。遗传相似性及聚类分析表明,甘肃省党参种质资源间的变异范围较小,种间遗传关系较近。这种情况可能是在党参种植过程中,各个品种之间的地理分布近,并且桔梗科植物多为异花授粉,从而使党参品种间相互授粉的几率大大提高,造成种间的遗传关系较近。本研究中品种DS8和品种DS10分别为选育党参品种渭党1号和渭党2号。品系DS3与品种DS8的亲缘关系最近,其相似系数为0.964 9,二者可以进一步与品系DS1聚为一类,这3个材料与品种DS10(渭党2号)的遗传距离较远;品系DS6与其他所有供试材料的亲缘关系最远,可单独聚为一类。本研究所得结果可为甘肃省党参种质资源的优化提供部分分子生物学依据。
[1] 冯洁, 韦林旭.DNA分子诊断技术在中药研究中的应用[J].广西中医药,2000,23(1):57-59.
[2] 杨宁,白雪,刘效瑞,等.几种分子标记技术的比较及其在中药材鉴定中的应用[J].生物学通报,2011,46(8):1-5.
[3] 刘恩荔,秦雪梅.党参研究进展[J].山西医科大学学报,2002,33(6):567-569.
[4] 王峥涛,徐国钧.中药党参的药源调查[J].中草药,1992,23(3):143-147.
[5] 郑学项,冯素萍,李维国.DNA分子标记研究进展[J].安徽农业科学,2009,37(26):12420-12422.
[6] 任爱农,秦民坚.基于RAPD分子标记技术的中药材鉴定研究进展[J].中南药学,2008,6(3):338-341.
[7] 付薇,唐成斌,吴家海,等.野生马蹄金种质资源的RAPD鉴别[J].草业科学,2010,27(4):106-111.
[8] 黄文达,赵学勇,赵昕,等.分子标记在种群遗传学研究中的应用[J].草业科学,2010,27(11):115-120.
[9] 王关林.植物基因工程[M].第2版.北京:科学出版社,2002:742.
[10] 刘湘丹,周日宝,童巧珍,等.百合鳞叶总DNA 提取方法的改进[J].湖南中医药大学学报,2007,27(2):12.
[11] 张建清,苏雪,吴琼,等.药用植物党参的RAPD分析[J].中药材,2006,29(5):417-420.
[12] Williams J G,Kubelik A R,Libak K J,etal.DNA polymorphisms amplified by arbitrary primers are useful as genetic markers[J].Nucleic Acids Research,1990,18(22):6531-6535.
[13] 盛丽,王蒂,司怀军.甘肃省当归种质资源的RAPD分析[J].甘肃农业大学学报,2007,42(4):60-64.
[14] 梁慧敏.不同居群狗牙根RAPD分析[J].草业学报,2010,19(1):258-262.
[15] 刘欢,慕平,赵桂琴.基于AFLP燕麦遗传多样性研究[J].草业学报,2008,17(6):121-127.
[16] 解新明,卢小良.利用RAPD标记分析狼尾草属牧草品种间的遗传关系[J].草业学报,2005,14(2):52-56.

