外源植物激素对东方山羊豆响应盐胁迫的调控效应初探
田 聪,张清斌,顾 祥,韩 青,朱忠艳,王承军,穆尼热
(1.新疆畜牧科学院草业研究所,新疆 乌鲁木齐 830000; 2.新疆维吾尔自治区农产品质量安全监督检验中心,新疆 乌鲁木齐 830049)
东方山羊豆(Galegaorientalis)又称饲用山羊豆,是一种多年生冬性豆科牧草,我国无此野生种质资源分布[1-2]。我国从20世纪90年代开始对东方山羊豆进行引种研究。1999年新疆畜牧科学院草业研究所从高加索地区引进东方山羊豆种子,并在新疆天山以北牧区进行多点引种试验。通过多年驯化栽培,于2004年通过全国牧草评审委员会审定,登记为全国引进牧草新品种——“新引1号东方山羊豆”(G.orientaliscv.Xinyin No.1),登记号为275[3]。随着退牧还草、牧民定居、草原生态保护补助奖励机制等项目的实施,东方山羊豆作为栽培草地建植用种得到进一步推广栽培,并以其综合农艺性状好[4]、营养丰富[5]、越冬能力强、产草量高和不感染菟丝子(Cuscutachinensis)[2]的特性得到了广大农牧民、基层农技、草原推广部门的认可。
土壤盐渍化是一个世界性难题[6],也是困扰牧区栽培草地建设的核心问题之一,高品质农业土地资源有限,饲草料地建设不可能挤占经济、粮食等作物的农业生产用地。采用工程学方法改良盐碱地成本高[7],无疑会增加人工饲草料地建设成本。种植抗逆性高的优良牧草不失为较佳的解决方式。但东方山羊豆在盐碱地种植时,时常表现出出苗困难,苗期生长缓慢的现象。植物生长调节剂与植物耐盐性的关系一直是植物耐盐机理研究的重要内容[8]。本试验研究植物生长激素对东方山羊豆种子发芽和苗期耐盐性的影响,旨在为东方山羊豆在盐碱地上的种植管理,以及培育筛选耐盐碱优良品系、品种提供理论依据。
1 材料与方法
1.1试验材料 东方山羊豆种子于2010年10月采自新疆畜牧科学院草业研究所东方山羊豆育种试验田,通风晾干,去种荚后4 ℃低温保存。
1.2试剂与设备 6-卞基腺嘌呤(6-BA)、α-萘乙酸(NAA)、赤霉素(GA3)为进口分装,购自上海生工生物股份有限公司;其余试剂为国产分析纯。分析天平及721分光光度计、人工气候箱均为国产仪器。
1.3试验设计
1.3.1种子发芽特性的测定 将经预处理(机械打磨)的东方山羊豆种子用0.1% HgCl2消毒3 min,然后用蒸馏水冲洗干净,置于底部垫有滤纸的发芽盒中。每盒放入种子100粒,设3个重复。采用称重法,向发芽盒中分别加入浓度梯度为0、25、50、100、150、200 mmol·L-1的NaCl溶液。通过预试验,GA3处理质量浓度为1 mg·L-1,6-BA为2 mg·L-1,NAA为5 mg·L-1,以不添加激素处理为对照将发芽盒置于人工气候箱暗培养,设置温度为26 ℃(16 h)/16 ℃(8 h)。第3天开始记录发芽数,以胚根突破种皮2 mm作为种子发芽标准,霉烂的记为无生活力的种子,计算15 d内的发芽率[9]。
1.3.2幼苗生理特性的测定 将经过预处理的东方山羊豆种子(方法同上)播于垫有滤纸的发芽盒中,在1/4浓度Hoagland营养液中培养。种子发芽后用改良的Hoagland营养液水培,每5 d更换营养液,其余时间用去离子水补充散失水分。培养30 d后分别加入浓度为0、25、50、100、150、200 mmol·L-1的NaCl溶液和GA3质量浓度为1 mg·L-1、6-BA为2 mg·L-1、NAA为5 mg·L-1的Hoagland营养液对东方山羊豆幼苗进行培养(每处理3个重复),以不添加激素处理为对照。处理5 d后,收集叶片测定游离脯氨酸[10]、丙二醛[10]、叶绿素[11]含量等各项生理指标。
1.4数据处理 所有试验数据采用微软Excel及DPS 9.1.48软件进行统计分析,完成作图。
2 结果与分析
2.1植物生长激素对NaCl胁迫下东方山羊豆种子发芽的影响 随NaCl浓度的增大,4组处理的发芽率均呈现下降趋势,因处理方式不同,降低的程度也不相同(图1)。在无激素处理组中,50 mmol·L-1的NaCl浓度下,盐胁迫对种子萌发的影响较小,发芽率呈现出下降趋势;在100 mmol·L-1的NaCl浓度下,发芽率大幅下降;当NaCl浓度达到200 mmol·L-1以上时,萌发率几乎为0(<1%)。在GA3处理组中,发芽率下降趋势较缓,在盐浓度为150 mmol·L-1时,发芽率才有较大的下降,但在盐浓度为200 mmol·L-1时,仍能有接近50%的发芽率,催芽能力明显。6-BA处理组中,随着盐浓度提高,发芽率在100 mmol·L-1之后,才大幅下降。NAA组中,发芽率与无激素处理组中趋势比较接近,基本上没有催芽的效果。
2.2植物生长激素对NaCl胁迫下东方山羊豆幼苗脯氨酸含量的影响 在无盐胁迫状态下,各激素处理差异不显著(P>0.05);随着盐浓度的提高,4组处理中东方山羊豆幼苗脯氨酸含量呈增加趋势(图2)。当NaCl浓度高于50 mmol·L-1时,脯氨酸含量较无盐胁迫状态下均显著增大。在同一胁迫处理下,NAA和6-BA处理脯氨酸含量总是高于其他处理。NAA组在200 mmol·L-1盐浓度下,脯氨酸含量最高,为本组初始期的10倍以上。虽然无激素处理组中脯氨酸含量较低,但最高盐胁迫浓度下脯氨酸含量较无胁迫状态下提高了18倍。NaCl浓度为50 mmol·L-1时,GA3组脯氨酸含量较无激素处理组差异不显著。6-BA组中,50~100 mmol·L-1盐浓度区间中,脯氨酸浓度高于NAA。

图1 植物生长激素对NaCl胁迫下东方山羊豆种子发芽率的影响Fig.1 Effects of plant growth hormones on germination of Galega orientalis under different NaCl stress seedlings under different NaCl stress
2.3植物生长激素对NaCl胁迫下东方山羊豆丙二醛含量的影响 在无盐胁迫状态下,NAA处理丙二醛含量与无激素处理差异显著(P<0.05),其他处理组MDA含量与无激素处理组差异不显著(P>0.05);随着NaCl浓度的增加,无激素处理组和GA3组丙二醛含量呈下降趋势(图3)。在25~100 mmol·L-1盐浓度区间,无激素处理组出现先下降后迅速回升的趋势,这与东方山羊豆幼苗的应激性有密切联系。在最低点,即50 mmol·L-1盐浓度是一个阈值。6-BA和NAA组丙二醛含量随着NaCl浓度的增加呈先上升后下降的趋势,拐点在50 mmol·L-1处。

图2 植物生长激素对NaCl胁迫下东方山羊豆幼苗脯氨酸含量的影响Fig.2 Effects of plant growth hormones on proline content of Galega orientalis seedlings under different NaCl stress
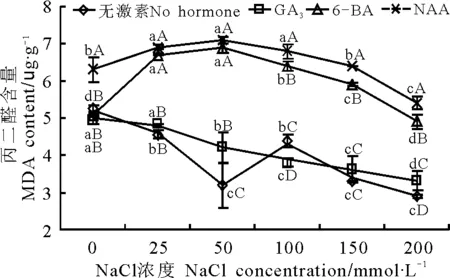
图3 植物生长激素对NaCl胁迫下东方山羊豆丙二醛含量的影响Fig.3 Effects of plant growth hormones on MDA content of Galega orientalis seedlings under different NaCl stress
2.4植物生长激素对NaCl胁迫下东方山羊豆叶绿素含量的影响 在无盐胁迫条件下,东方山羊豆幼苗无激素处理中叶绿素含量显著(P<0.05)高于GA3和6-BA处理。随着盐浓度的不断提高,4组处理叶绿素含量均总体呈现降低的趋势(图4)。低浓度的盐胁迫下,无激素处理组和NAA组叶绿素含量上升,说明NAA能够刺激东方山羊豆细胞中叶绿体的生成。随着盐浓度进一步提高,叶绿素含量逐渐下降,NAA组下降趋势强于无激素处理,NAA表现出限制叶绿素的形成。总体来说,在中、低浓度的盐胁迫条件下,NAA处理的东方山羊豆叶绿素含量高于无激素处理,对幼苗的生长是有利的。而GA3和6-BA处理降低了非盐胁迫和盐胁迫条件下叶绿素的含量。

图4 植物生长激素对NaCl胁迫下东方山羊豆叶绿素含量的影响Fig.4 Effects of plant growth hormones on chlorophyll content of Galega orientalis seedlings under different NaCl stress
3 讨论
3.1盐胁迫及激素处理对东方山羊豆种子发芽的影响 对于大多数非盐生植物,盐胁迫明显影响其种子萌发,随着盐浓度的增大,种子萌发出现迟滞的现象[12],高浓度盐分对种子有毒害作用。盐胁迫环境阻碍植物种子吸水,同时过量的离子进入植物细胞,还会打破种子体内激素平衡。植物对盐胁迫环境也会表现出应激性,但会增加植物的代谢成本。本研究发现,随着盐胁迫浓度的增加,东方山羊豆种子发芽率总体呈下降趋势,质量浓度低于50 mmol·L-1NaCl胁迫对东方山羊豆发芽影响小,这与苜蓿(Medicagosativa)等[13-14]非盐生植物的研究结论类似,即低盐浓度对种子萌发抑制作用不明显。植物生长调节剂可用于调控种子萌发[15]。外源植物激素的刺激能够调控种子中一系列信号转导途径。从而使种子萌发相关酶的活力增强,促使种子萌发,最终表现为提高了种子的生活力[16]。GA3是一种重要的植物激素,常用于打破某些植物种子的休眠,促进其萌发[17];6-BA是一种非植物内源生长调节物,能促进细胞分裂[18];NAA可促进细胞伸长与分裂,诱导形成不定根,促进扦插枝条生根[18]。本研究结果显示,GA3、6-BA、NAA 3种植物外源激素中,仅GA3的浸种处理达到了在较高盐浓度胁迫条件下,对东方山羊豆种子有催芽的效果,而6-BA、NAA的处理,虽然一定程度上可以提高种子的发芽率,但从总体上看,不能达到生产上的要求,这是否与其浸种时间和浸种浓度有关还需做进一步的研究。
3.2东方山羊豆对盐胁迫及激素处理的生理响应 当植物体受到逆境胁迫时,体内会发生一系列的生理生化变化,从而提高植株适应逆境的能力。脯氨酸作为一种有机渗透调节剂,虽然它在植物体内积累的原因和生理意义仍然存在分歧,但其可作为植物对盐碱胁迫反应敏感的协变指标[19]。通常植物中脯氨酸含量很低,但遇到盐碱、干旱、低温等逆境时,脯氨酸便会大量积累,其积累指数与植物的抗逆性有关。在本研究中的盐胁迫条件下,随着NaCl浓度的提高,东方山羊豆叶片中游离脯氨酸含量显著增加,表明东方山羊豆具有一定的渗透调节能力。特别是在NaCl浓度超过50 mmol·L-1,脯氨酸含量增长较快。在盐胁迫条件下,NAA、6-BA能够调控东方山羊豆脯氨酸快速累积。随着盐浓度的提升,低浓度的NAA就可以使东方山羊豆幼苗脯氨酸含量成倍提高。在本研究的中等盐浓度100 mmol·L-1NaCl胁迫下,2 mg·L-16-BA可使东方山羊豆幼苗脯氨酸含量显著提升,但随着盐浓度的提高,调控能力下降。GA3对东方山羊豆脯氨酸积累促进作用要明显低于NAA和6-BA。
植物器官衰老或在逆境下遭受伤害,通常会发生膜脂过氧化作用,MDA是膜脂过氧化的最终分解产物,其含量可以反映植物遭受逆境伤害的程度[20],同时也能够间接反映植物组织抗氧化性和细胞结构的完整程度。本研究中,随着盐胁迫浓度的升高,东方山羊豆丙二醛的含量表现出波动性,低盐浓度胁迫条件下,MDA含量下降,中等盐浓度下MDA含量升高,当NaCl胁迫浓度超过100 mmol·L-1,MDA含量下降,初步判断MDA不适合作为评价东方山羊豆耐盐性的重要生理指标。推测东方山羊豆可能在膜系统上有其他的耐盐结构和机制,这与李鑫等[21]的研究结果有很强的相关性。
叶绿素是参与植物光合作用的核心物质,叶绿素含量与叶片光合作用密切相关。因而,叶绿素含量可以作为评价植物生长状况的重要指标[22]。本研究显示随着盐浓度的提高,东方山羊豆幼苗叶绿素的含量随之下降,但在高浓度的NaCl胁迫下,叶绿素含量有上升,这是否与东方山羊豆自身抗逆机制有关,还是由膜系统损伤导致仍需研究。NAA可以提高东方山羊豆幼苗叶绿素含量,特别是在中、低盐浓度条件下。
在分析植物生长激素对植物生长的影响时,不能只强调某一项生理指标,而应综合考虑对植物种子萌发和苗期生长的影响。尽管NAA加大了东方山羊豆苗期细胞膜的渗透压力,但NAA能促进东方山羊豆渗透调节物质的积累和细胞光合作用,在中、低盐浓度胁迫条件下,对苗期东方山羊豆耐盐生长综合调控效果好于GA3和6-BA。由于本试验仅探讨了NaCl对东方山羊豆种子、幼苗的影响,但通常盐碱地上生长的植株会受到复盐胁迫,且不同无机离子之间存在着相互作用[23],同时幼苗与成熟植株的耐盐性是否一致等问题均值得研究。此外,已经开发出来植物生长调节剂种类繁多,用法、用量各不相同。因此,关于植物生长调节剂对东方山羊豆在实际盐碱土壤条件下的耐盐性的影响值得进一步探讨研究。
4 结论
本研究表明,东方山羊豆种子和幼苗对盐胁迫敏感。东方山羊豆能够适应0~50 mmol·L-1NaCl浓度胁迫。在NaCl浓度为150 mmol·L-1以内,GA3适合用于提高盐胁迫条件下东方山羊豆种子发芽率。NAA适合调控东方山羊豆幼苗在中、低盐浓度下的生长。试验结果对东方山羊豆育种材料选择、种子包衣技术的开发及在盐碱地上的栽培管理具有参考价值。
[1] 张清斌,杨志忠,贾纳提,等.东方山羊豆引种研究初报[J].中国草地,2001,23(4):17-21.
[2] 田聪,张清斌,顾祥,等.优良豆科牧草东方山羊豆研究现状与趋势分析[J].草食家畜,2009,145(4):64-67.
[3] 张清斌,李柱,朱忠艳,等.新引1号东方山羊豆的选育与利用[J].中国草地学报,2008,30(6):10-15.
[4] 沈禹颖,张自和,谢田玲.优良豆科牧草东方山羊豆的研究与利用[J].草业学报,2003,12(6):105 109.
[5] 穆尼热,张清斌,田聪,等.新引1号东方山羊豆牧草品质的评价[J].草业科学,2011,28(3):410-413.
[6] 蔺娟,地里拜尔·苏力坦.土壤盐渍化的研究进展[J].新疆大学学报(自然科学版),2007,24(3):318-323.
[7] 李海英,彭红春,牛东玲,等.生物措施对柴达木盆地弃耕盐碱地效应分析[J].草地学报,2002,10(1):63-69.
[8] 师晨娟,刘勇,荆涛.植物激素抗逆性研究进展[J].世界林业科学,2006,19(5):21-26.
[9] 王瑞峰,王铁梅,金晓明,等.11个审定苜蓿品种种子萌发耐盐性评价[J].草业科学,2012,29(2):213-218.
[10] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:258-261.
[11] 张宪政.作物生理研究法[M].北京:农业出版社,1982:145-147.
[12] 秦峰梅,张红香,武祎,等.NaCl胁迫对黄花苜蓿发芽及幼苗生长的影响[J].草业学报,2010,19(4):71-78.
[13] Guan D,Zhou B,Zhang H,etal.Germination responses ofMedicagoruthenicaseeds to salinity,alkalinity,and temperature[J].Journal of Arid Environments,2009,73:135-138.
[14] 沈禹颖,王锁民,陈亚明.盐胁迫对牧草种子萌发及其恢复的影响[J].草业学报,1999,8(3):54-60.
[15] 宋平,张启翔,潘会堂,等.3种植物生长调节剂对南紫薇种子萌发的影响[J].种子,2009,28(3):58-60.
[16] 丁映.几种外源激素对韭葱种子发芽的影响[J].种子,2004,23(12):50-52.
[17] 郑健,郭守华,宋瑜,等.臭椿种子萌发最适条件研究[J].西北植物学报,2007,27(5):1030-1034.
[18] 潘瑞炽.植物生理学[M].北京:高等教育出版社,2004:167-186.
[19] 全先庆,张渝洁,单雷,等.脯氨酸在植物生长和非生物胁迫耐受中的作用[J].生物技术通讯,2007,18(1):159-162.
[20] Li G,Wan S W,Zhou J,etal.Leaf chlorophyll fluorescence,hyperspectral reflectance,pigments content,malondialdehyde and proline accumulation responses of castor bean (RicinuscommunisL.) seedlings to salt stress level[J].Industrial Crops and Products,2010,31:13-19.
[21] 李鑫,王赞,王学敏,等.东方山羊豆液泡膜Na+/H+逆向转运蛋白基因的克隆与分析[J].植物生理学通讯,2009,45(5):444-448.
[22] Arkadii B R,Rostislav A S.Analysis of the chlorophyll biosynthetic system in a chlorophyll bless barley mutant[J].Photosynthesis Research,1998,58(1):71-80.
[23] 丛丽丽,张蕴薇,陈新,等.盐胁迫对虉草种子萌发与幼苗生理生化的影响[J].草业科学,2011,28(12):2136-2142.

