野油菜黄单胞菌胞内粗酶液催化合成α-熊果苷
张欣英,严 伟,李群良,姚评佳,魏远安,唐纪良
(1.广西大学化学化工学院,广西 南宁 530004;2.广西大学 亚热带农业生物资源保护与利用国家重点实验室,广西 南宁 530004)
熊果苷(Arbutin),又名熊果甙、熊果素、熊果叶甙、熊果酚甙或杨梅甙,是一种源于杜鹃花科熊果属的多年生常绿小灌木植物熊果的叶子的成分。熊果苷具有美白活性,广泛应用于化妆品行业[1],其美白机理为熊果苷对酪氨酸酶产生竞争性及可逆性抑制,从而阻断多巴及多巴醌的合成,进而抑制黑色素的生成,达到美白效果[2]。熊果苷依结构不同可分为α型(4-羟苯基-α-D-吡喃葡萄糖苷)和β型(4-羟苯基-β-2-D-吡喃葡萄糖苷),α-熊果苷是β-熊果苷的差向异构体,α-熊果苷抑制黑色素的活性为β-熊果苷的10倍[3]。作为最好、最安全的高效美白剂,α-熊果苷在国际化妆品领域占有极其重要的地位,而我国α-熊果苷的开发和利用仍处于起步阶段。因此,研究α-熊果苷的合成意义重大[4]。
目前制备α-熊果苷的方法主要有微生物细胞转化法和酶法,其中微生物细胞转化法是利用不同微生物的酶进行糖转移反应,使1分子的葡萄糖和1分子的氢醌结合形成单一的α-熊果苷[5,6],但酶法合成α-熊果苷更具优势,如王秀捧等[7]、刘春巧等[8]利用嗜麦芽黄单胞菌(Xanthomonasmaltophilia) BT-112催化合成α-熊果苷。
作者在此利用野油菜黄单胞菌(Xanthomonascampestrispv.campestris) 8004胞内粗酶液生物催化合成α-熊果苷,并对反应条件进行了初步研究。其反应方程式为:

1 实验
1.1 菌种、试剂与培养基
野油菜黄单胞菌(Xanthomonascampestrispv.campestris) 8004 由广西亚热带农业生物资源保护与利用国家重点实验室唐纪良教授提供;α-熊果苷,Sigma 公司;生化试剂,北京奥博星生物技术有限责任公司;其它试剂均为分析纯。
种子培养基(质量浓度,%):蔗糖1.0,蛋白胨0.5,牛肉膏0.3,酵母膏0.1,pH值7.0。
1.2 野油菜黄单胞菌胞内粗酶液的制备
无菌条件下,取一环菌种于种子培养液中在28 ℃、180 r·min-1下发酵培养12 h后,吸取发酵液,于新种子培养液中培养24 h,冷冻离心(8000 r·min-1,20 min),收集菌体;用缓冲溶液洗涤菌体2次,低温超声破碎,离心;取上清液,即为胞内粗酶液(湿菌体浓度为50 mg·mL-1)。
1.3 α-熊果苷的生物合成
取胞内粗酶液5 mL,加入反应物蔗糖和对苯二酚,于35 ℃、180 r·min-1下摇床反应24 h。按下式计算对苯二酚的转化率(x1)和选择性(x2):


式中:M1为加入到反应液中的对苯二酚的物质的量;M2为反应消耗掉的对苯二酚的物质的量;M3为对应生成α-熊果苷的对苯二酚的物质的量。
1.4 α-熊果苷的检测
取1 mL反应液,离心,取上清液,进行高效液相色谱检测。
色谱条件如下:色谱柱为DiamonsilTMC18柱(250 mm×4.6 mm,5 μm);紫外检测器;柱温25 ℃;流动相为 H2O-CH3OH(95∶5,体积比);流速1 mL·min-1;检测波长280 nm;进样量10 μL。
2 结果与讨论
2.1 HPLC谱图
α-熊果苷标准品与反应液的HPLC图谱见图1。
由图1可看出,反应液中出峰时间为9.306 min,与α-熊果苷标准品出峰时间(9.304 min)几乎相同。这表明野油菜黄单胞菌胞内粗酶液能催化对苯二酚与蔗糖反应生成α-熊果苷。
2.2 反应条件的优化
2.2.1 对苯二酚浓度对反应的影响(图2)

图2 对苯二酚浓度对反应的影响
由图2可知,α-熊果苷含量、对苯二酚的选择性及转化率均随着对苯二酚浓度的增大先升高后降低;当对苯二酚浓度为40 mmol·L-1时,α-熊果苷含量、对苯二酚的选择性及转化率均达到最高。这可能是因为,对苯二酚浓度过高,抑制了葡糖基转移酶的催化活性。因此,确定最佳对苯二酚浓度为40 mmol·L-1。
2.2.2 反应物摩尔比对反应的影响
理论上,对苯二酚与蔗糖合成α-熊果苷的反应中反应物摩尔比应该是1∶1,但该反应是一个可逆反应,根据反应动力学原理,增加一种反应物的量可以提高另一种反应物的转化率。考虑到增加对苯二酚浓度会抑制葡糖基转移酶的催化活性,所以本实验通过增加蔗糖的量来提高对苯二酚的转化率,从而提高α-熊果苷的产量。反应物摩尔比(对苯二酚与蔗糖摩尔比,下同)对反应的影响见图3。

图3 反应物摩尔比对反应的影响
由图3可知,α-熊果苷含量、对苯二酚的选择性及转化率均随着反应物摩尔比的减小(即蔗糖用量的增加)先升高后降低;当反应物摩尔比为1∶30时,α-熊果苷含量、对苯二酚的选择性及转化率均达到最高。这可能是因为,当对苯二酚与蔗糖的摩尔比小于1∶30时,胞内粗酶液中的其它酶竞争底物蔗糖进行其它的催化反应,从而使其对应生成α-熊果苷的量、对苯二酚的选择性及转化率均下降。因此,确定最佳反应物摩尔比(对苯二酚与蔗糖摩尔比)为1∶30。
2.2.3 缓冲溶液pH值对反应的影响(图4)

图4 缓冲溶液pH值对反应的影响
由图4可知,α-熊果苷含量、对苯二酚的选择性及转化率均随pH值的增大先升高后降低;当pH值为7.0时,α-熊果苷含量、对苯二酚的选择性及转化率均达到最高。这是因为,pH值影响着酶的活性,酶在最适pH值下可以发挥最大的活性。在本催化反应中,pH值不仅影响葡糖基转移酶的催化活性,也影响底物对苯二酚的结构变化,pH值为碱性时会导致对苯二酚的氧化,增强对葡糖基转移酶的抑制作用,导致转化率的降低。因此,确定最佳缓冲溶液pH值为7.0。
2.2.4 反应时间对反应的影响(图5)

图5 反应时间对反应的影响
由图5可知,α-熊果苷含量、对苯二酚的选择性及转化率均随反应时间的延长先升高后降低;当反应时间为36 h时,α-熊果苷含量、对苯二酚的选择性及转化率均达到最高;随着反应时间的继续延长,α-熊果苷含量、对苯二酚的选择性及转化率都有所下降。这可能是因为,反应时间过长,粗酶液中的其它酶竞争底物蔗糖催化其它反应,降低了底物浓度,使蔗糖与对苯二酚合成α-熊果苷的反应逆向进行;同时对苯二酚浓度的提高也抑制葡糖基转移酶的催化活性。因此,确定最佳反应时间为36 h。
2.2.5 菌体浓度对反应的影响
理论上,出发菌体浓度越大,其所含的酶量也越多,即反应催化剂量越大,在其它反应条件不变的情况下,底物的转化率也应该越大。菌体浓度对反应的影响见图6。
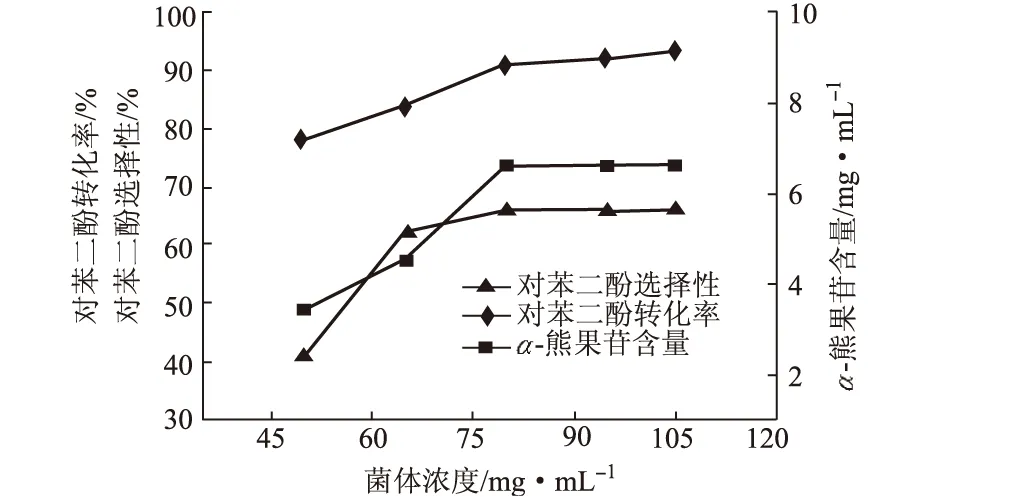
图6 菌体浓度对反应的影响
由图6可知,随着菌体浓度的增大,α-熊果苷含量、对苯二酚的选择性及转化率也明显上升;当菌体浓度超过80 mg·mL-1时,α-熊果苷含量、对苯二酚的选择性及转化率上升幅度不明显。因此,确定最佳菌体浓度为80 mg·mL-1。此时,α-熊果苷含量达到6.58 mg·mL-1、对苯二酚选择性为66%、对苯二酚转化率为91%。
3 结论
(1)确定野油菜黄单胞菌(Xanthomonascampestrispv.campestris) 8004胞内粗酶液生物催化合成α-熊果苷的最佳反应条件如下:反应温度35 ℃、摇床转速180 r·min-1、对苯二酚浓度40 mmol·L-1、对苯二酚与蔗糖的摩尔比1∶30、缓冲溶液pH值7.0、反应时间36 h、菌体浓度80 mg·mL-1,在此条件下,α-熊果苷含量达到6.58 mg·mL-1、对苯二酚选择性为66%、对苯二酚转化率为91%。
(2)以蔗糖为供糖基底物,通过生物酶法催化合成α-熊果苷,与化学合成法相比,避免了原料成本高、合成路线长、工艺流程复杂、消耗大等缺点,在生产成本、对环境的影响、产品安全性方面均更具优势。
参考文献:
[1] 郭静,徐平,金立元.熊果苷的研究进展[J].宁夏医学杂志,2008,30(3):281-283.
[2] 阎雪莹,唐晓飞,王雪莹,等.熊果苷研究及应用进展[J].中医药信息,2007,24(4):18-22.
[3] Funayama M,Arakawa H,Yamamoto R,et al.Effects of alpha- and beta-arbutin on activity of tyrosinases from mushroom and mouse melanoma[J].Biosci Biotechnol Biochem,1995,59(1):143-144.
[4] 姚斌,沈晓兰,潘亚菊.α-熊果苷的研究进展[J].中国现代应用药学,2005,22(1):32-33.
[5] 郭起,陈朗秋,蔡进,等.熊果苷的合成新方法[J].化学试剂,2010,32(1):17-20.
[6] Kitao S,Sekine H.α-D-Glucosyl transfer to phenolic compounds by sucrose phosphorylase fromLeuconostocmesenteroidesand production ofα-arbutin[J].Biosci Biotech Biochem,1994,58(1):38-42.
[7] 王秀捧,张淑荣,刘春巧,等.嗜麦芽黄单胞菌游离细胞催化合成α-熊果苷[J].微生物学通报,2007,34(3):417-420.
[8] 刘春巧,张淑荣,张鹏.嗜麦芽黄单胞菌BT-112催化制备α-熊果苷[J].日用化学工业,2005,35(6):364-367,383.

