青霉纤维素酶酶解芦竹的研究
叶艳平,周玉杰,丁一刚,刘 靖,张建安
(1.武汉工程大学 绿色化工过程教育部重点实验室,湖北 武汉 430073;2.清华大学 核能与新能源技术研究院,北京 100084)
纤维素酶为诱导型复合酶系,是生物降解纤维素生成葡萄糖的酶的总称,主要由葡聚糖内切酶(Cx酶)、葡聚糖外切酶(C1酶)、β-葡萄糖苷酶(CB酶)组成[1,2],其中前两者将纤维分解成纤维二糖,后者将纤维二糖转化为葡萄糖,当三者的活性比例适当时,就能有效地协同完成对纤维素的降解[3,4]。国内外对木霉纤维素酶研究较多[5,6],但该酶系普遍存在着β-葡萄糖苷酶活力很低的缺陷,致使纤维二糖积累,影响了酶解效率。相对于木霉属的微生物而言,青霉属(Penicillium)真菌不仅能分泌较全的降解天然木质纤维材料的聚糖酶系,而且能产生较多的β-葡萄糖苷酶[7,8]。
作者在此以蒸汽爆破预处理后的芦竹为原料,研究青霉纤维素酶酶解芦竹的适宜条件,同时探讨了向青霉纤维素酶中添加一定量的商业酶后的酶解效果,拟为利用芦竹糖化发酵制取燃料乙醇和丁醇提供理论依据。
1 实验
1.1 材料与试剂
蒸汽爆破预处理后芦竹,其组分为:纤维素46%,半纤维素8%,木质素33%,灰分13%。
青霉纤维素酶液,自制。
商业纤维素酶:NS50013(70 FPU·mL-1DM)、NS50010(250 CBU·mL-1DM),诺维信公司;木聚糖酶(Xylanase)。
1.2 纤维素酶酶解单因素实验
在50 mL三角瓶中,取蒸汽爆破预处理后芦竹使其底物质量浓度为2%,加入5 mL 1 mol·L-1醋酸缓冲溶液和一定量纤维素酶,在一定转速恒温摇床中于45 ℃、pH值4.8、酶载量30 FPU·g-1DM条件下酶解72 h。离心,取上清液适当稀释,测定还原糖浓度。
固定其它反应条件,依次改变酶解时间(12 h、24 h、36 h、48 h、60 h、72 h、84 h、96 h)、酶解温度(30 ℃、40 ℃、45 ℃、50 ℃、60 ℃)、pH值(3.5、4.0、4.8、5.6、6.5)、酶载量(10 FPU·g-1DM、20 FPU·g-1DM、30 FPU·g-1DM、40 FPU·g-1DM、50 FPU·g-1DM),考察各因素对酶解效果的影响。
1.3 混合商业酶酶解实验
1.3.1 外加木聚糖酶单因素实验
添加木聚糖酶混合至酶液总木聚糖酶酶活(IU·g-1DM)依次达到:140、150、160、170、180、190、200,酶解芦竹后测定其还原糖含量。
1.3.2 外加NS50010酶液单因素实验
添加NS50010酶液混合至酶液总β-葡萄糖苷酶酶活(CBU·g-1DM)依次达到:10、20、30、40、60、90、150,酶解后测定其还原糖含量。
1.3.3 酶解效果对比
就以下不同酶系的酶解效果进行对比:30 FPU·g-1DM青霉纤维素酶(酶系1)、30 FPU·g-1DM青霉纤维素酶加木聚糖酶至180 IU·g-1DM(酶系2)、30 FPU·g-1DM青霉纤维素酶加NS50010至β-葡萄糖苷酶40 CBU·g-1DM(酶系3)、30 FPU·g-1DM NS50013酶(酶系4)。
1.4 酶活测定
酶活力测定采用NREL推荐的标准方法[9]。一个滤纸酶活力的国际单位(FPU)等于在标准反应条件下每分钟释放1 μmol葡萄糖的酶量。葡聚糖内切酶酶活用羧甲基纤维素(CMC)测定;β-葡萄糖苷酶酶活用水杨素试剂测定;木聚糖酶酶活用木聚糖溶液测定。
1.5 还原糖含量测定
采用LC-20D型高效液相色谱仪测定酶液中的还原糖,如葡萄糖、木糖等的含量。色谱条件:色谱柱为HPX-87H有机酸分析柱,柱温65 ℃,流动相为5 mmol·L-1稀硫酸,流速0.8 mL·min-1,检测器RID-10A。
2 结果与讨论
2.1 各纤维素酶酶活比较
比较发现,不同纤维素酶的酶活和酶系组成都各不相同,青霉纤维素酶的β-葡萄糖苷酶酶活偏低,仅为0.9 CBU·mL-1,其滤纸酶酶活、木聚糖酶酶活、CMC酶活分别为5.2 FPU·mL-1、42.5 IU·mL-1、15.4 U·mL-1;Xylanase的木聚糖酶酶活较高,为2503.2 IU·mL-1,且检测不到其它酶活性;NS50013的滤纸酶酶活和NS50010的β-葡萄糖苷酶酶活较高,分别为70 FPU·mL-1DM和250 CBU·mL-1DM。
2.2 青霉纤维素酶酶解芦竹工艺条件优化
2.2.1 酶解时间对酶解效果的影响(图1)

图1 酶解时间对酶解效果的影响
由图1可知,酶解初期(1~12 h)反应速度较快,还原糖产率迅速上升;随着酶解时间的延长,反应速度急剧下降;酶解时间超过72 h后,还原糖产率提高不明显。其原因可能是:当酶解时间达到72 h后,酶与底物的反应变缓、酶的活性降低,还原糖的生成趋缓。故选取适宜的酶解时间为72 h。
2.2.2 酶解温度对酶解效果的影响(图2、图3)

图2 酶解温度对酶解效果的影响
由图2可知,随着酶解温度的升高,还原糖产率逐渐上升;酶解温度为45 ℃时达到最大值,之后迅速降低。其原因可能是:酶解温度升高时,酶解液中活化分子数增多,反应速度加快;但酶解温度升至一定程度后,酶蛋白逐渐变性甚至失活,使反应速度降低甚至很快结束。

图3 不同温度下葡萄糖产率随酶解时间的变化
由图3可知,50 ℃和60 ℃下的葡萄糖产率从12 h起即保持几乎不变,即其反应在12 h左右时即将近结束。45 ℃下的葡萄糖终产率最高。
综合上述分析,选取适宜的酶解温度为45 ℃。
2.2.3 pH值对酶解效果的影响(图4)

图4 pH值对酶解效果的影响
由图4可知,酶解效果在pH值4.0~5.5之间较好,这是由纤维素酶蛋白对pH值的敏感性所决定的,其中pH值为4.8时酶解效果最好。因此,选取适宜的pH值为4.8。
2.2.4 酶载量对酶解效果的影响(图5、图6)
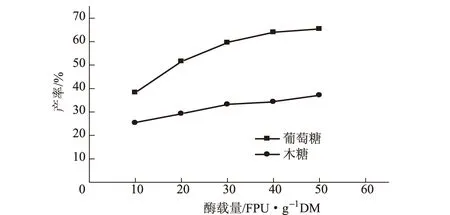
图5 酶载量对酶解效果的影响
由图5可知,随着酶载量的增加,葡萄糖的产率明显上升;当酶载量超过30 FPU·g-1DM后,葡萄糖的升幅趋缓,最高葡萄糖产率约66.4%。当酶载量持续增大时,酶解后底物的pH值急剧降低,不利于后期生产。

图6 不同酶载量下葡萄糖产率随酶解时间的变化
由图6可知,当酶载量在40 FPU·g-1DM和50 FPU·g-1DM时,随着酶解的进行,葡萄糖产率开始有起伏波动甚至出现下降的趋势。综合考虑酶解效果和成本因素,选取适宜的酶载量为30 FPU·g-1DM。
通过单因素实验分析,确定青霉纤维素酶酶解芦竹的最适条件为:酶解时间72 h、酶解温度45 ℃、pH值4.8、酶载量30 FPU·g-1DM,在此条件下,葡萄糖产率为(61.75±1.22)%、木糖产率为(40.07±6.88)%。
2.3 混合纤维素酶和商业酶酶解效果对比
2.3.1 外加木聚糖酶酶载量对酶解效果的影响(图7)

图7 外加木聚糖酶酶载量对酶解效果的影响
由图7可知,随着木聚糖酶酶载量的增加,还原糖产率明显上升;木聚糖酶酶活为180 IU·g-1DM时,还原糖产率最高,此后葡萄糖产率略有下降,木糖产率明显下降。最高的葡萄糖产率为69.82%、木糖产率为60.50%,相对于单独青霉纤维素酶酶解的最高葡萄糖产率62.97%和木糖产率46.95%,分别提高6.85%和13.55%。
2.3.2 外加NS50010酶载量对酶解效果的影响(图8)

图8 外加NS50010酶载量对酶解效果的影响
由图8可知,随着外加NS50010酶载量的增加,葡萄糖的产率逐渐上升、木糖产率迅速上升;当酶载量为40 CBU·g-1DM时,葡萄糖产率和木糖产率均达到最高;此后再增加NS50010酶载量,葡萄糖产率几乎不变、木糖产率略有下降。最高的葡萄糖产率为68.96%、木糖产率为98.16%,相对于单独青霉纤维素酶酶解的最高葡萄糖产率62.97%和木糖产率46.95%,分别提高5.99%和51.21%。添加NS50010时木糖产率显著提高,且高于添加木聚糖酶的效果,其原因可能为:青霉纤维素酶中木聚糖酶酶活与滤纸酶酶活比例已达到一定理想值,单独添加木聚糖酶提高该比例只能一定程度上提高酶解效率;而青霉纤维素酶中β-葡萄糖苷酶酶活与滤纸酶酶活比例较低,当添加一定的NS50010提高该比例后,有效地提高了各酶之间的协同作用,从而得到较好的酶解效果。
2.3.3 不同酶酶解效果对比(图9)

图9 不同酶的酶解效果对比
由图9可知,青霉纤维素酶加NS 50010 至β-葡萄糖苷酶40 CBU·g-1DM(酶系3)时木糖产率最高,为98.16%,高于单独30 FPU·g-1DM NS50013(酶系4)的84.88%。补加木聚糖酶(酶系2)或NS50010(酶系3),均能提高葡萄糖产率,且接近商业酶NS50013单独酶解效果。故通过调节酶系中不同酶活比例,可以达到较好的协同作用,并获得较好的酶解效果。
3 结论
(1)青霉纤维素酶酶解芦竹的最适条件为:酶解时间72 h、酶解温度45 ℃、pH值4.8、酶载量30 FPU·g-1DM,在此条件下,葡萄糖产率为(61.75±1.22)%、木糖产率为(40.07±6.88)%。
(2)通过添加不同商业酶如木聚糖酶、β-葡萄糖苷酶,调节纤维素酶酶系中不同酶活比例,可一定程度上提高酶解效率。当添加β-葡萄糖苷酶至40 CBU·g-1DM时,葡萄糖产率达68.96%、木糖产率达98.16%。
参考文献:
[1]王超,章超桦.酶解纤维素类物质生产燃料酒精的研究进展[J].纤维素科学与技术,2003,11(3):52-59.
[2]武秀琴.纤维素酶及其应用[J].微生物学杂志,2009,29(2):89-92.
[3]Kumar Rajeev,Wyman Charles E.Effects of cellulase and xylanase enzymes on the deconstruction of solids from pretreatment of poplar by leading technologies[J].Biotechnology Progress,2009,25(2):302-314.
[4]Saha Badal C,Cotta Michael A.Lime pretreatment,enzymatic saccharification and fermentation of rice hulls to ethanol[J].Biomass and Bioenergy,2008,32(10):971-977.
[5]Xia Liming,Shen Xueliang.High-yield cellulase production byTr-ichodermareeseiZU-02 on corn cob residue[J].Bioresource Technology,2004,91(3):259-262.
[6]Krisztina Kovács,George Szakacs,Guido Zacchi.Comparative enzymatic hydrolysis of pretreated spruce by supernatants,whole fermentation broths and washed mycelia ofTrichodermareeseiandTrichodermaatroviride[J].Bioresource Technology,2009,100(3):1350-1357.
[7]孙宪昀,曲音波,刘自勇.青霉木质纤维素降解酶系研究进展[J].应用与环境生物学报,2007,13(5):736-740.
[8]Jorgensen Henning,Morkeberg Astrid,Krogh Kristian B R,et al.Production of cellulases and hemicellulases by threePenicilliumspecies:Effect of substrate and evaluation of cellulose adsorption by capillary electrophoresis[J].Enzyme and Microbial Technology,2005,36(1):42-48.
[9]Ghose T K.Measurement of cellulase activities[J].Pure and Applied Chemistry,1987,59(2):257-268.

