重症急性呼吸窘迫综合征34例临床资料回顾性分析
沈奕播, 刘双林, 李 琦
(第三军医大学新桥医院全军呼吸内科研究所, 重庆 400037)
急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)是由心源性以外的各种肺内外致病因素导致的急性进行性缺氧性呼吸衰竭。其发病机制错综复杂, 病死率居高不下[1]。本文回顾性分析了2009年1月~2012年1月期间第三军医大学新桥医院全军呼吸病学研究所呼吸重症监护室(respiratory intensive care unit, RICU)收治的34例ARDS患者的临床资料, 报告如下。
1 对象与方法
1.1 纳入标准
所选临床病例诊断符合1999年9月中华医学会呼吸病学分会在昆明召开的全国呼吸衰竭会议推荐的诊断标准[2]:(1)有发病的高危因素;(2)急性起病,呼吸频数和(或)呼吸窘迫;(3)低氧血症, 氧合指数[动脉氧分压/吸入氧浓度, (PaO2/FiO2)]≤200 mmHg(1 mm Hg = 0.133 kPa);(4)胸部X线或CT检查: 两肺浸润阴影;(5)肺毛细血管楔压≤18 mmHg或临床可以除外的心源性肺水肿。在此标准基础上本组资料将PaO2/FiO2<150作为重症ARDS的纳入标准。本研究诊断上均未测量肺毛细血管楔压, 而是根据患者症状、体征、心电图和超声心动图等常规检查以排除心源性肺水肿。多器官功能障碍(multiple organ dysfunctions syndrome, MODS)的诊断标准参照1995年中华医学会急诊医学专业委员会通过的MODS病情分期诊断及严重程度评分标准[3]。
1.2 一般资料
根据以上纳入标准, 2009年1月~2012年1月期间我院RICU共收治重症ARDS患者34例, 男性28例,女性6例, 年龄18~98岁, 平均年龄(54.09±18.34)岁。收集资料包括患者发病诱因、既往有无基础疾病、确诊24h内患者的生命体征(体温、脉搏、呼吸、血压)、实验室检查结果(血气分析、血常规、肾功、电解质、降钙素原、C-反应蛋白、血沉、乳酸、PaO2/FiO2)、急性生理学和慢性健康状况评分系统Ⅱ(acute physiology and chronic health evaluationⅡ,APACHEⅡ)评分以及治疗方法。
1.3 治疗方法
除积极治疗导致ARDS的诱因和原发病以外,34例患者均采用机械通气治疗。其中经鼻气管插管有创通气29例, 主要采用压力控制通气或容量控制通气模式,行保护性肺机械通气策略; 5例采用无创面罩呼吸机辅助通气, 采用压力支持通气+持续气道正压或双时相气道正压模式。另外, 11例患者因脓毒血症休克、间质性肺疾病以及病毒性肺炎早期予以大剂量激素冲击治疗(甲泼尼龙≥160 mg); 5例预防性抗真菌治疗; 2例接受持续血液滤过治疗。
1.4 统计学处理
应用SPSS18.0软件分析, 计量资料以±s表示,采用χ2分析和t检验, 相关分析采用Spearman等级相关方法。P<0.05为差异有统计学意义。
2 结 果
2.1 患者总体情况
34例患者除创伤1例、重症胰腺炎2例及产褥期感染1例在发病前无基础疾病外, 其余30例均伴有1项或1项以上基础疾病, 主要以糖尿病、冠心病、高血压、慢性阻塞性肺疾病、肿瘤及肾病为主。根据ARDS诱因部位, 直接肺损伤29例(85.3%), 主要为严重肺部感染 26例(89.7%)、吸入性肺炎 3例(10.3%); 间接肺损伤主要表现为全身性炎症反应综合征(systemic inflammatory response syndrome,SIRS)5例(14.7%)。患者RICU住院时间最长28 d,最短1 d。29例经鼻气管插管, 插管时间最长20 d, 最短1 d; 无创面罩呼吸机辅助通气5例, 最长16 d, 最短4 d。本研究观察终点为确诊后21 d, 截止观察终点共死亡患者24例(70.6%)。
2.2 存活组与死亡组ARDS患者临床资料比较
按确诊后21 d是否存活, 将34例患者分为存活组(10例)和死亡组(24例)。结果显示, 死亡组APACHEⅡ评分、乳酸、降钙素原、PaO2/FiO2相对于存活组有显著性差异(P<0.05), 其他指标两组间无统计学差异(表1)。
表1 存活组与死亡组ARDS患者临床资料比较Table 1 Comparison of the clinical data in ARDS patientsbetween survival and death groups (±s)
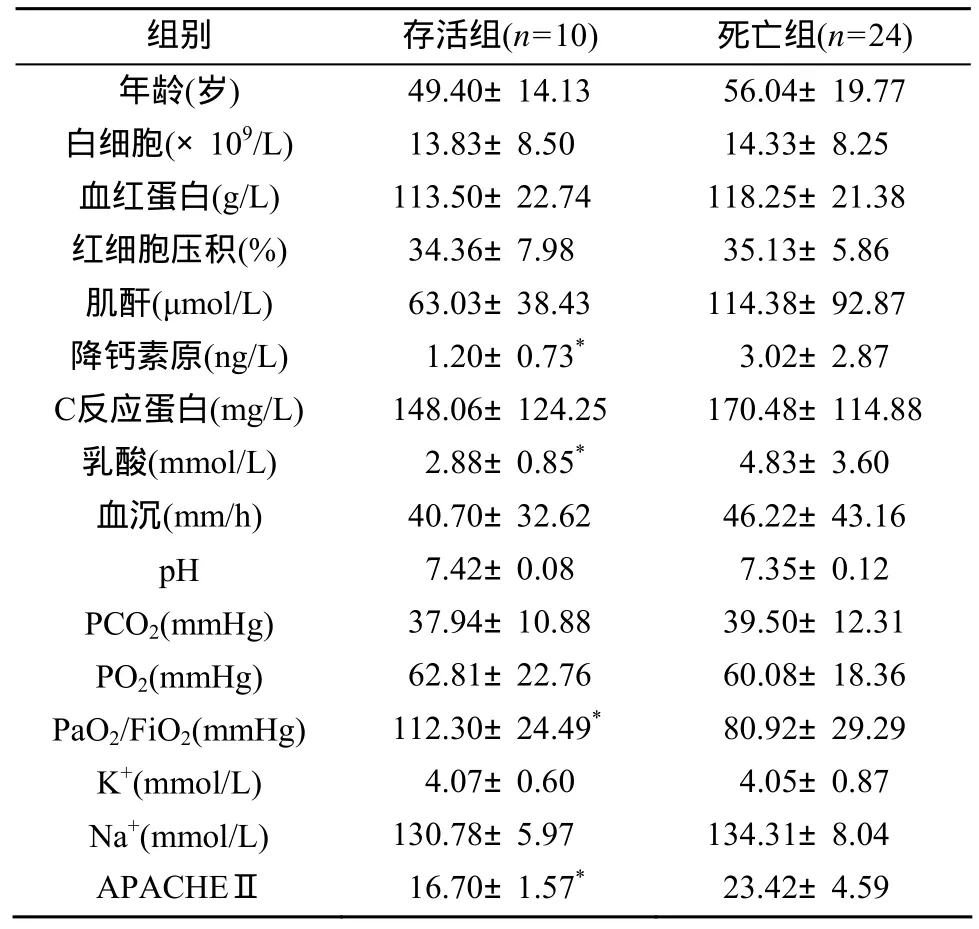
表1 存活组与死亡组ARDS患者临床资料比较Table 1 Comparison of the clinical data in ARDS patientsbetween survival and death groups (±s)
注: APACHEⅡ: 急性生理学和慢性健康状况评分系统Ⅱ; PCO2: 二氧化碳分压; PO2: 氧分压; FiO2: 吸入氧浓度。1 mmHg = 0.133 kPa。与死亡组比较, *P<0.05
组别 存活组(n = 10) 死亡组(n = 24)年龄(岁) 49.40±14.13 56.04±19.77白细胞(×109/L) 13.83±8.50 14.33±8.25血红蛋白(g/L) 113.50±22.74 118.25±21.38红细胞压积(%) 34.36±7.98 35.13±5.86肌酐(μmol/L) 63.03±38.43 114.38±92.87降钙素原(ng/L) 1.20±0.73* 3.02±2.87 C反应蛋白(mg/L) 148.06±124.25 170.48±114.88乳酸(mmol/L) 2.88±0.85* 4.83±3.60血沉(mm/h) 40.70±32.62 46.22±43.16 pH 7.42±0.08 7.35±0.12 PCO2(mmHg) 37.94±10.88 39.50±12.31 PO2(mmHg) 62.81±22.76 60.08±18.36 PaO2/FiO2(mmHg) 112.30±24.49* 80.92±29.29 K+(mmol/L) 4.07±0.60 4.05±0.87 Na+(mmol/L) 130.78±5.97 134.31±8.04 APACHEⅡ 16.70±1.57* 23.42±4.59
2.3 APACHEⅡ评分与乳酸、降钙素原水平的相关性分析
Spearman等级相关分析显示, ARDS患者随APACHEⅡ评分增高, 血乳酸及降钙素原浓度亦随之增加, APACHEⅡ评分与乳酸、降钙素原水平正相关(r= 0.531,r= 0.527;P<0.01), 而与血沉及C反应蛋白无显著相关性(P>0.05)。
2.4 不同 APACHEⅡ评分间血乳酸及降钙素原浓度的比较
APACHEⅡ评分 10~19分组血乳酸及降钙素原浓度低于20~30分组, 差异有统计学意义(P<0.05;表2)。
表2 APACHEⅡ评分组间乳酸及降钙素原浓度的比较Table 2 Comparison of the concentrations of lactic acid and procalcitonin between different APACHEⅡscores (±s)
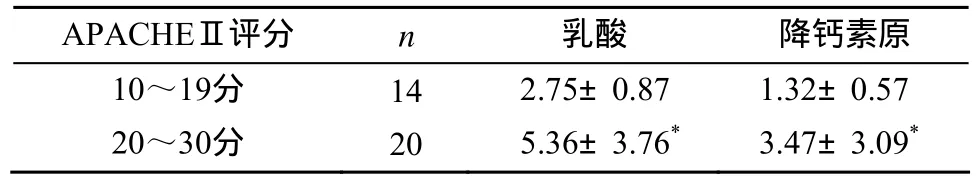
表2 APACHEⅡ评分组间乳酸及降钙素原浓度的比较Table 2 Comparison of the concentrations of lactic acid and procalcitonin between different APACHEⅡscores (±s)
注: 与10~19分比较, *P<0.05
APACHEⅡ评分 n 乳酸 降钙素原10~19分 14 2.75±0.87 1.32±0.57 20~30分 20 5.36±3.76* 3.47±3.09*
2.5 MODS与ARDS的关系
34例ARDS患者中, 发生肺外器官衰竭23例(67.6%)、死亡18例(78.3%); 23例合并MODS的ARDS患者中, 11例发生循环衰竭、10例发生肾功能衰竭、6例出现凝血功能障碍。发生上述器官功能衰竭≥3个的患者有12例, 仅存活1例(8.3%), 而发生2个器官功能衰竭的病例11例, 存活4例(36.4%),发生1个器官衰竭的11例, 存活5例(45.5%)。三者间差异没有统计学意义(P>0.05)。
3 讨 论
近年来, 虽然对ARDS的发病机制有了更深入的研究, 许多新的理念和治疗策略得以应用, 但目前ARDS的总体死亡率仍居高不下[4,5]。而目前ARDS病死率的报道不一, 主要与入选标准、发病因素、病情严重程度以及治疗条件差异等因素有关[6]。我院RICU入组的34例重症ARDS患者中, 根据ARDS诱因部位, 直接肺损伤29例(85.3%), 主要为严重肺部感染26例(89.7%)、吸入性肺炎3例(10.3%)。间接肺损伤主要表现为SIRS 5例(14.7%)。共死亡患者24例(70.6%)。因入组患者总体APACHEⅡ评分[(21.44±5.00)分]较高, 病情严重, 故高于国外报道病死率32.3%~57.9%[7,8]。本文与宋鹏等[9]统计2002年至2005年第三军医大学新桥医院全军呼吸病学研究所RICU的重症ARDS死亡率(76.47%)基本一致。
ARDS的预后指标一直是临床科研工作的重要内容。APACHEⅡ评分自1985年首次报告以来, 已经普遍被国内外ICU作为评价患者病情严重程度的权威性评分系统。因其可以全面反映患者整体的病情严重程度, 所以对危重患者死亡风险预测比较可靠, 其分值与病情严重程度密切相关,分值越高, 病情越重, 死亡风险越大。故Luecke等[10]研究认为,APACHEⅡ评分是ARDS预后的唯一评价指标。而PaO2/FiO2作为ARDS诊断的重要指标, 反映肺通气、换气和肺部损伤情况, 亦可以作为预后指标。帅维正等[11]研究认为, PaO2/FiO2≤150和APACHEⅡ≥18分作为ARDS患者致死的独立危险因素与ARDS的病死率密切相关。而近年来文献报道, 血清降钙素原、乳酸与ARDS患者预后相关[12-16]。本研究中,ARDS患者存活组和死亡组两组数据统计结果显示,APACHEⅡ评分、降钙素原、乳酸、PaO2/FiO2两组间存在显著性差异(P<0.05); 相关分析显示,ARDS患者随APACHEⅡ评分增高, 血乳酸及降钙素原浓度亦随之增加, APACHEⅡ评分与乳酸、降钙素原水平正相关(r= 0.531,r= 0.527;P<0.01), 提示血清乳酸、降钙素原水平与ARDS患者病情严重程度正相关, 这与文献报道相同[12-16]。因本组实验样本少, 并未对ARDS患者确诊后行多时间段的样本采集, 因此血清降钙素原及乳酸水平是否有助于预警ARDS的发生以及成为重要的预后指标, 还需经多中心、大样本数据的验证。
ARDS的预后除与抢救措施是否得当有关外,常与患者原发病、并发症有关。本研究组入组34例重症ARDS患者中, 30例伴有1项或1项以上基础疾病, 合并 MODS的病例 23例, 死亡 18例, 病死率78.3%, 高于未发生 MODS的患者, 这与 Eachempati等[17]的报道一致。本组资料同时显示, 合并 MODS病例中发生3个或3个以上器官功能障碍的患者有12例, 仅存活1例(8.3%), 而发生2个器官功能障碍的病例11例, 存活4例(36.4%), 但各组间无统计学差异, 可能与入选病例较少有关。本组资料亦显示, 循环衰竭、肾功能衰竭及凝血功能障碍在重症ARDS合并MODS患者中较为常见, 这提示我们, 在临床上对 ARDS的治疗不应该仅局限于呼吸衰竭本身, 更应当重视其他脏器功能的保护, 保持内环境的稳定性, 才能提高ARDS的治愈率。
[1]钱桂生. 急性肺损伤和急性呼吸窘迫综合征的诊断与治疗[J]. 解放军医学杂志, 2009, 34(4): 371-373.
[2]中华医学会呼吸病学分会. 急性肺损伤/急性呼吸窘迫综合征的诊断标准(草案)[J]. 中华结核和呼吸杂志, 2000,23(4): 203-203.
[3]王今达, 王宝恩. MODS病情分期诊断及严重程度评分标准[J]. 中国危重病急救医学, 1995, 7(6): 346-347.
[4]Phua J, Badia JR, Adhikari NK,et al. Has mortality from acute respiratory distress syndrome decreased over time?: A systematic review[J]. Am J Respir Crit Care Med, 2009,179(3): 220-227.
[5]Gómez-Caro A, Badia JR, Ausin P. Extracorporeal lung assist in severe respiratory failure and ARDS. Current situation and clinical applications[J]. Arch Bronconeumol,2010, 46(10): 531-537.
[6]马晓春, 王 辰, 方 强, 等. 急性肺损伤/急性呼吸窘迫综合征诊断和治疗指南(2006)[J]. 中国危重病急救医学,2006, 18(12): 706-710.
[7]Irish Critical Care Trials Group. Acute lung injury and the acute respiratory distress syndrome in Ireland: a prospective audit of epidemiology and management[J]. Crit Care, 2008,12(2): 122-128.
[8]Agarwal R, Aggarwal AN, Gupta D,et al. Etiology and outcomes of pulmonary and extrapulmonary acute lung injury/ARDS in a respiratory ICU in North India[J]. Chest,2006, 130(3): 724-729.
[9]宋 鹏, 李 琦, 王长征, 等. 17例重症急性呼吸窘迫综合征临床资料回顾性分析[J]. 中国呼吸与危重监护杂志,2006, 5(1): 35-38.
[10]Luecke T, Muench E, Roth H,et al. Predictors of mortality in ARDS patients referred to a tertiary care centre: a pilot study[J]. Eur J Anaesthesiol, 2006, 23(5): 403-410.
[11]帅维正, 李 琦, 王长征, 等. 71例急性呼吸窘迫综合症的预后指标分析[J]. 解放军医学杂志, 2009, 34(4):377-380.
[12]钟耀区, 吕泽峰, 吴思仿, 等. ARDS患者血乳酸水平与APACHEⅡ评分相关性研究[J]. 临床和实验医学杂志,2010, 9(12): 883-884.
[13]叶东平, 牛媛媛, 张丽香. 血乳酸代谢及其清除率对急性呼吸窘迫综合征患者预后的评估[J]. 中国社区医师(医学专业), 2011, 23(13): 240-241.
[14]饶惠清, 莫北溪, 黄道永. 急性呼吸窘迫综合征患者血乳酸定量分层的临床价值[J]. 中国医药导报, 2011, 8(35):34-40.
[15]何义平, 费军, 余洪俊, 等. 严重多发伤患者血清降钙素原与 ARDS关系研究[J]. 创伤外科杂志, 2006, 8(3):231-233.
[16]任天成, 王 赤, 杨 健, 等. 血清降钙素原、C反应蛋白和白蛋白对急性呼吸窘迫综合征预后的评估价值[J]. 江苏医药, 2011, 37(23): 2837-2838.
[17]Eachempati SR, Hydo LJ, Shou J,et al. Outcomes of acute respiratory distress syndrome (ARDS) in elderly patients[J].J Trauma, 2007, 63(2): 344-350.

