不同消化液介质对难溶中药溶出量的影响:以牛黄为例
刘斐斐 张萍 王伽伯 马致洁 臧清策 肖小河
溶出是难溶性药物发挥药效的关键环节,是化学药固体制剂的重要研究内容,而中药及其制剂的研究对溶出问题重视不足[1]。在中药临床调剂中,难溶性药材仍主要是按照传统方式提取处理的,其中药效成分是否有效溶出,给临床疗效带来多大影响?药效成分的溶出比例是多少,是否有药材浪费问题?这些均缺少科学试验数据的支持。
牛黄(Calculusbovis)为脊椎动物哺乳纲偶蹄目牛科动物黄牛(BostaurusdomesticusGmelin)或水牛(BubalububalisL.)的干燥胆结石[2]。牛黄在中国应用历史悠久,是临床常用的名贵中药,也是多种著名中成药的重要原料,如牛黄解毒片、安宫牛黄丸、清开灵注射液[3,4]等都以牛黄为主药。牛黄为难溶性结石药物,其所含主要成分如多种游离胆汁酸、胆红素(钙盐)、胆固醇[5-7]等均为难溶性物质。牛黄传统用药方式主要为口服,因此牛黄药效成分是否能在消化道溶出,将直接影响其临床疗效的发挥;同时药效成分溶出率的大小也直接影响该名贵药物的有效利用。目前,人工牛黄为天然牛黄的常用代用品,其所含成分与天然牛黄基本一致,但有不少文献报道人工牛黄的药效弱于天然牛黄[8]。人工牛黄与天然牛黄是否存在溶出差异,并是否影响疗效,尚未见报道。为此,本文以天然牛黄、人工牛黄为研究对象,考察其所含胆汁酸类重要成分在人工胃液、小肠液和大肠液中的溶出差异,从体外溶出的角度探讨影响难溶中药疗效的可能因素。
1 材料与方法
1.1 试药与仪器
天然牛黄购于北京同仁堂中医医院(生产厂家为北京亚微饮片厂,批号0812450);人工牛黄购于武汉某药业有限公司(批号110206)。对照品胆酸(cholic acid,CA)、去氧胆酸(deoxycholic acid,DCA)、鹅去氧胆酸(chenodeoxycholic acid,CDCA)、熊去氧胆酸(ursodeoxycholic acid,UDCA)、牛磺胆酸(taurocholic acid,TCA)、甘氨胆酸(glycocholic acid,GCA)、甘氨去氧胆酸(glycodeoxycholic acid hydrate,GDCA)、牛磺去氧胆酸(taurodeoxycholic acid hydrate,TDCA)购自中国药品生物制品检定所(批号分别为110795-200505、110796-200716、110757-200206、110759-200804、110758-200610、110799-200806、110725-200608、877-200001),甲醇(分析纯及色谱纯,由北京泰博昌生物技术有限公司提供)。其余试剂均为分析纯。
XC-00 dt超声仪(南京新辰生物科技有限公司),Waters Acquity UPLC TM超高效液相色谱仪(Waters, Milford, MA, USA),ZKYY-5L智能型恒温水浴锅(巩义华仪器有限责任公司)。
1.2 人工消化液的配制
人工胃液(pH 1.2)的配制:取1 mol/L的稀盐酸16.4 ml,加水800 ml与胃蛋白酶10 g,摇匀后,加水稀释成1000 ml。人工小肠液(pH 6.8)的配制:取磷酸二氢钾6.8 g,加水500 ml使溶解,用0.1 mol/L NaOH溶液调节pH值至6.8,另取胰酶10 g。加水使适量溶解,将两液混合后,加水稀释至1000 ml。人工大肠液(pH 7.6)的配制:取磷酸二氢钾27.22 g,加水使溶解至1000 ml,取500 ml,加0.2 mol/L NaOH溶液42.4 ml,再加水稀释至200 ml。
1.3 对照品溶液制备
分别精密称取胆酸等8种胆汁酸对照品适量,加甲醇分别制成每1 ml含胆酸、去氧胆酸、鹅去氧胆酸、熊去氧胆酸、牛黄胆酸、甘氨胆酸、甘氨去氧胆酸、牛磺去氧胆酸各900 μg的储备液,该储备液在4℃避光冷藏可稳定保存2个月以上。用0.22 μm的微孔滤膜过滤,备用。
1.4 供试样品制备
取天然牛黄、人工牛黄各约0.1 g,精密称定,分别以甲醇、人工胃液(pH 1.2)、人工小肠液(pH 6.8)和人工大肠液(pH 7.6)为溶出介质,温度37℃,超声提取3次,每次30分钟,合并上清,晾干,并定容至20 ml,沉淀蛋白。样品置于-20℃冷冻可稳定保存2个月以上,UPLC进样前用0.22 μm的微孔滤膜过滤,测定胆汁酸类成分溶出后的含量。
1.5 胆汁酸UPLC测定
色谱柱:Waters Acquity CSH C18色谱柱(50 mm×2.1mm,1.7 μm),柱温35℃。流动相组成:流动相A:乙腈;流动相B:0.2%甲酸-水。线性梯度洗脱程序:0~2.0分钟,10%~12%;2.0~3.0分钟,12%~25%A;3.0~3.01分钟,25%~35%A;3.01~10分钟,35%~37%A;10~17分钟,37%~43%A;17~17.01分钟,43%~48%A;17.01~20分钟, 48%~52%A。流速0.40 ml/min,检测波长254 nm;进样量5μl;理论塔板数按胆酸计算,应不低于3000。检测GCA、TCA、CA、GDCA、TCDCA、CDCA和DCA共7个成分在不同人工消化液中的含量,计算溶出比例(人工消化液中的溶出成分峰面积占甲醇中溶出成分峰面积的的百分率)。
2 结果
天然牛黄和人工牛黄在不同溶剂中的溶出结果见图1和表1。
天然牛黄中各胆汁酸成分在甲醇、人工胃液、人工小肠液和人工大肠液中的溶出比例较同溶剂中人工牛黄高。如在人工大肠液中,天然牛黄CDCA的溶出比例是人工牛黄的9.13倍。
不同溶剂间,以甲醇为参比,天然牛黄和人工牛黄在人工小肠液、大肠液中各胆汁酸成分的溶出均高于人工胃液中的溶出。如天然牛黄中CDCA的溶出人工大肠液是人工胃液的1.83倍;人工牛黄中DCA在人工大肠液中的溶出是人工胃液的1.36倍。
各胆汁酸成分的溶出间,天然牛黄中GCA、GDCA的溶出比例较大,均高于80%,而TCA、CA和DCA等成分溶出比例小,最低为16.6%;人工牛黄中GDCA的溶出比例最高,在人工大肠液中为73%;CDCA溶出最小,在各溶剂中的溶出比例均为8%。
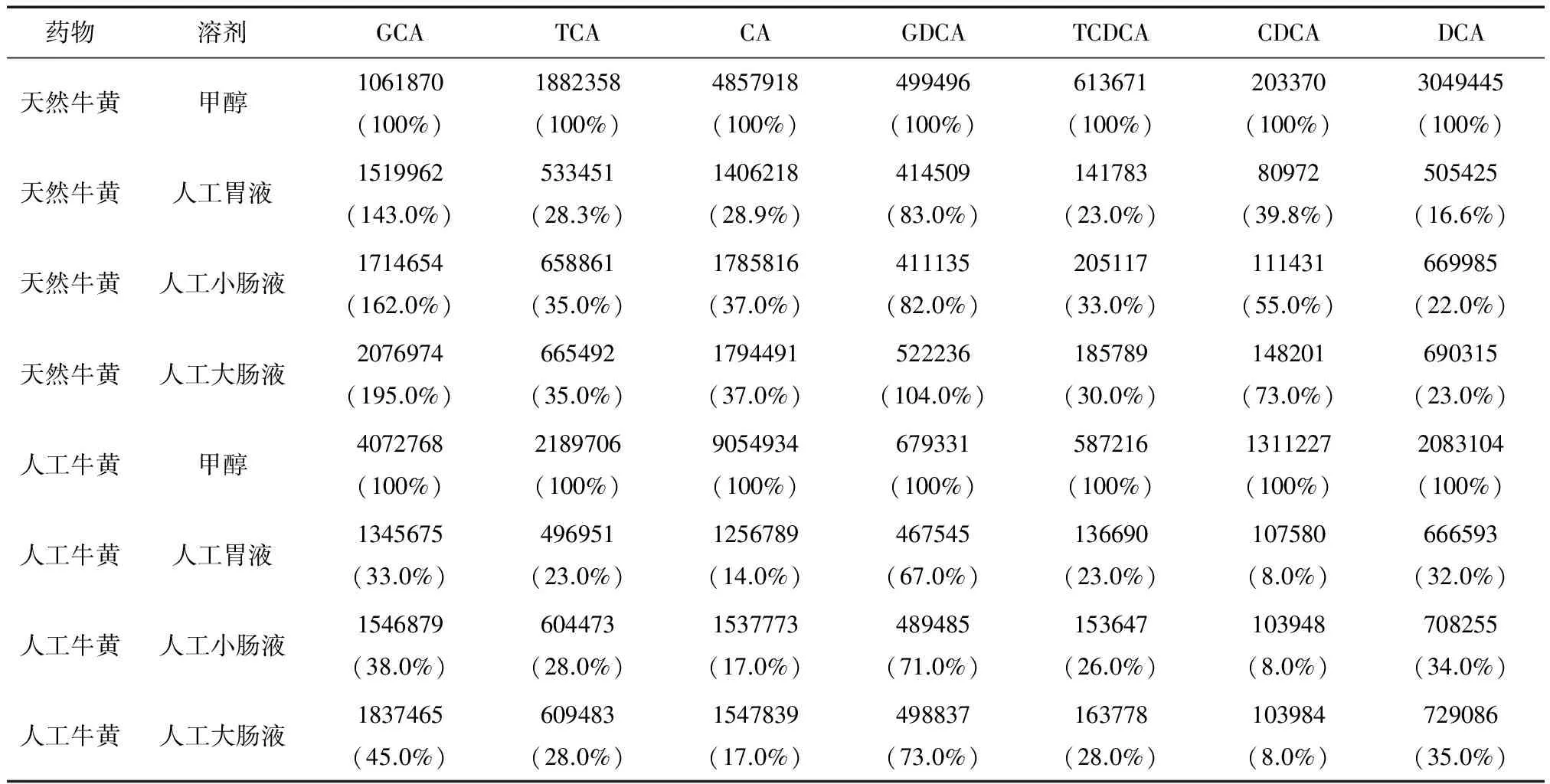
表1 天然牛黄、人工牛黄胆汁酸成分在不同溶剂中的溶出量比较[溶出成分峰面积(mV·min),溶出比例(%)]
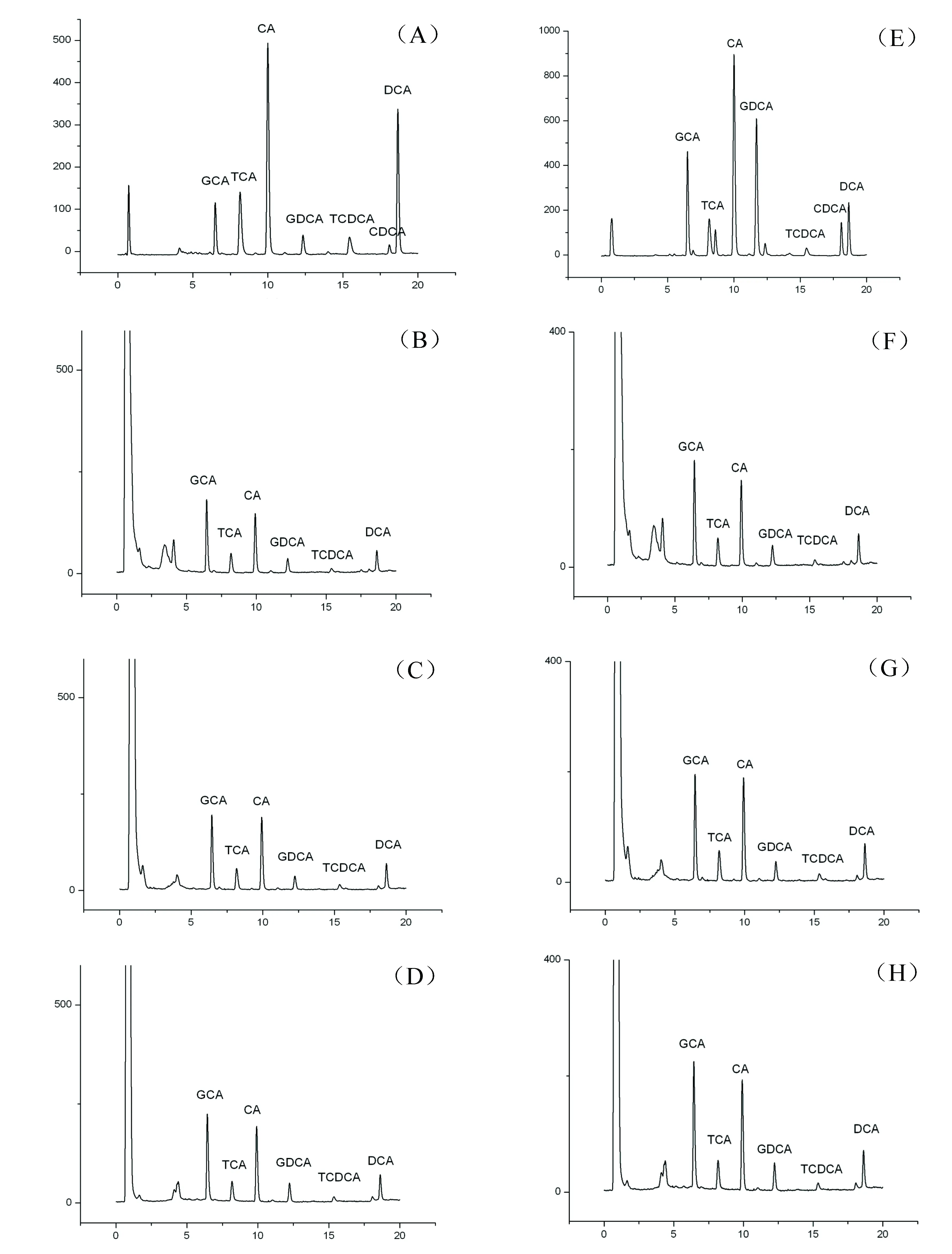
(A)天然牛黄+甲醇;(B)天然牛黄+人工胃液;(C)天然牛黄+人工小肠液;(D)天然牛黄+人工大肠液;(E)人工牛黄+甲醇;(F)人工牛黄+人工胃液;(G)人工牛黄+人工小肠液;(H)人工牛黄+人工大肠液图1 天然牛黄、人工牛黄在不同溶剂中溶出成分色谱图
3 讨论
胆汁酸类成分是牛黄的重要药效物质[9-11],并且游离胆汁酸类成分均为难溶性物质,因此本文选择胆汁酸类成分作为评价指标,考察天然牛黄和人工牛黄在人工胃液、小肠液及大肠液中溶出能力。需要说明的是,本实验不是严格意义的溶出试验,常规溶出试验需要大量的天然牛黄,成本过高。因此为了方便比较,本文采用平行对比的方式,以胆汁酸的良溶剂甲醇为参比,比较天然牛黄和人工牛黄在3种模拟人体胃肠消化液中的溶出成分差异。
在含量测定方法方面,现有文献报道中多用HPLC[12-15]作为牛黄胆汁酸类成分的检测手段;本文采用的UPLC法,能够更加快速、高效的进行成分的分离和指认,实验结果表明天然牛黄和人工牛黄各胆汁酸类成分均能较好的分离。
本文研究发现,所检测的8种胆汁酸成分除UDCA外在不同pH的人工消化液中均可检测到,其中结合型胆汁酸因具有甘氨酸或牛磺酸亲水性基团,故比游离型胆汁酸的溶出率高,提示牛黄溶出成分主要以结合型胆汁酸为主。文献报道,结合型胆汁酸如GCA在镇静、解痉、镇咳、祛痰、抗炎等多方面的药效作用强于游离型胆汁酸如CA、DCA等[16-18]。因此,尽管从药材含量上看游离型胆汁酸是牛黄的主要胆汁酸类成分,但由于结合型胆汁酸溶出较好、药效较强,结合型胆汁酸可能是牛黄的主要药效物质。现行药典质量控制指标为胆酸,而未考虑结合型胆汁酸,有待补充完善。
按现行药典规定,人工牛黄配方中应加入熊去氧胆酸。本文实际检测发现,所购人工牛黄样品的甲醇提取液中却未检测出熊去氧胆酸。由于药典标准中并不要求控制熊去氧胆酸,故该样品按药典标准仍属合格品,但实际上该批次产品可能未按药典要求生产。熊去氧胆酸具有较强的利胆作用,市售产品如熊去氧胆酸胶囊是临床治疗原发性胆汁性肝硬化(primary biliary cirrhosis,PBC)的一线药物。但由于现行药典标准未控制UDCA,不利于人工牛黄的质量控制,建议补充修改药典标准。
比较3种人工消化液,各胆汁酸成分在人工胃液溶出最差,在人工大肠液(pH 7.6)中溶出相对较好。如CDCA在人工大肠液中溶出量达73.0%,而在人工胃液仅39.8%,相差1.83倍。这与胆汁酸类成分均含有酸性基团,在偏碱性条件的溶解度较好有关。结果提示,牛黄胆汁酸类成分在肠道尤其是大肠部位溶出较好,通过制剂学手段延长牛黄在肠道停留时间,将有助提高牛黄中胆汁酸类成分的生物利用度及临床疗效。另外,GCA在人工消化液中的溶出量高于甲醇,可能与GCA亲水性较强有关。
根据本文结果,天然牛黄中除GCA、GDCA和CDCA外,其它胆汁酸成分的溶出比例均较低。通过制剂学手段提高名贵中药牛黄的溶出量,进而提高药材利用率,对提高牛黄制剂的疗效、节约药材等具有重要意义。进一步与人工牛黄对比发现,天然牛黄中各胆汁酸成分(除DCA外)的溶出率均高于人工牛黄,其中尤以CDCA相差最显著,在人工大肠液中溶出比例相差达9.13倍。提示溶出能力偏差可能是人工牛黄临床疗效低于天然牛黄的原因之一。据报道,国产UDCA片剂的溶出能力显著低于进口产品,其原因可能与晶型有关[19]。人工牛黄溶出能力偏低的原因尚有待深入研究。
目前难溶性中药的溶出研究尚没有得到足够重视,由此可能给临床疗效发挥带来巨大影响[20]。本文以牛黄为例,初步探讨了难溶中药在不同介质中溶出的问题和可能的影响因素,为重视和解决难溶性中药的溶出问题提供了数据支持,对于保障难溶性中药及其制剂的临床疗效具有一定的参考意义。
参考文献
[1] 袁海龙,黄雪,肖小河.中药固体制剂溶出度研究与展望[J].世界科学技术-中医药现代化,2010,12(6):915-919.
[2] 国家药典委员会.中华人民共和国药典(一部)[S].北京:化学工业出版社,2005:41.
[3] 江英桥.HPLC-ELSD法测定清开灵注射液中胆酸和猪去氧胆酸的含量[J].中国药品标准,2006,7(4):31-33.
[4] 徐雅,李澎涛,陈杰,等.安宫清开灵对自发性高血压大鼠脑出血模型前炎症细胞因子与黏附分子含量的影响[J].世界科学技术-中医药现代化,2007,9(2):45-49,72.
[5] 曹流,孙冶,曹澜,等.人工牛黄中胆红素含量测定的影响因素[J].中国卫生工程学,2005,4(2):91-92.
[6] 邓峰.气相色谱法对血清总胆固醇的测定[J].中华医学检验杂志,1988,11(3):133.
[7] 洪筱坤,陈怡,范广平,等.6个熊胆样品中结合型胆汁酸的种类和含量研究[J].中成药,1999,21(8):426.
[8] 赵艳红,阮金秀.牛黄及其代用品的药理作用及临床应用[J].军事医学科学院院刊,2007,31(2):175-178.
[9] 侯世祥,廖工铁,吴德全,等.人工牛黄的质量分析[J].华西药学杂志,1990,5(3):149-151.
[10] 张明霞,欧阳贵平.胆汁酸衍生物的合成及应用[J].合成化学,2009,17(2):140-145.
[11] 徐伟,袁惠楠,路岐祥,等.人工牛黄与几种新配方的药理学比较研究[J].中药药理与临床,1994,27(6):34.
[12] 李文春,孙永慧.HPLC-ELSD法测定青羚散中胆酸的含量[J].中国实验方剂学杂志,2005,11(5):18-20.
[13] 司徒少金,罗建明,马玲云,等.HPLC-ELSD测定消痔灵片中胆酸的含量[J].中药材,2005,28(4):344-345.
[14] 倪坤仪,王健,陈健,等.反相高效液相色谱法测定牛黄类中成药中胆汁酸的含量[J].药学学报,1994,29(8):629-632.
[15] 陈剑,刘频健,王晓一,等.HPLC法测定复方制剂中人工牛黄的胆红素含量[J].安徽农业科学,2009,37(21):9839-9840.
[16] 彭顺金,邹其超,张金枝,等.反相高效液相色谱法分析人体胆汁中结合型胆汁酸[J].分析试验室,2000,19(3):12.
[17] 王猛,张晓清,丁敏,等.反相高效液相色谱法测定鼠胆汁中游离与结合型胆汁酸[J].分析测试技术与仪器,2007,13(1):1-4.
[18] 王文娟,邓文平,王猛,等.高效液相色谱法同时测定胆汁中9种结合型胆汁酸[J].重庆医科大学学报,2009,34(1):59-62.
[19] 张涛,赵先英.药物研究和生产过程中的多晶型现象[J].中国新药与临床杂志,2003,22(10):615-620.
[20] 黄献,潘洪平,莫志江,等.不同厂家牛黄解毒片的体外溶出度考察[J].中成药,2005,27(1):107-109.

