索拉非尼对人肾癌荷瘤裸鼠血清IL-2及TNF-α水平影响的实验研究
杨政兴, 严 伟, 陈忠铭, 刘美宝, 李 炤
肾癌是泌尿系统最常见的恶性肿瘤之一,占男性泌尿生殖系统肿瘤的28.7%,约30%的肾癌患者首次就诊时即已属晚期[1]。美国转移性肾癌患者的2年生存率在0~20%之间波动[2]。肾癌具有多药物耐药基因,对化学治疗及放疗不敏感。非特异性免疫治疗白细胞介素-2(IL-2)或干扰素-α(IFN-α)联合应用虽被公认是肾癌的第一线治疗方案,但只有少数患者受益,显然急需新的治疗策略[3]。索拉非尼(sorafenib)是一种新型靶向抗肾癌药物,2008年NCCN肿瘤治疗指南已经将sorafenib应用于晚期肾癌的一线治疗。目前sorafenib与其他靶向治疗药物、细胞因子、化疗药物联合应用治疗晚期肾癌的多个临床试验正在进行或即将开始,部分试验已初步显示出其疗效显著。本文通过研究sorafenib对人肾癌荷瘤裸鼠血清IL-2及TNF-α水平的影响,进一步探讨sorafenib与细胞因子之间的关系,旨在为临床联合用药,提高疗效,扩大适应证范围提供依据。
1 材料与方法
1.1 实验动物及肾癌细胞株 BALB/c-nu/nu裸鼠由北京维通利华实验技术公司提供(SPF级),33只,4 周龄,体重(14.0 ±0.5)g,雌雄各半。OS-RC-2肾癌细胞株购于上海中科院。
1.2 主要试剂 sorafenib购于拜耳公司,200 mg/片;ELISA试剂盒(检测IL-2及TNF-α水平)购于美国BMS公司;RPMI1640培养基、胎牛血清购于海克隆生物化学制品(北京)有限公司。
1.3 OS-RC-2肾癌细胞的培养及细胞悬液制作OS-RC-2肾癌细胞株于含10%胎牛血清RPMI1640培养基、37℃、5%CO2温箱中培养,每2天更换1次培养基,用0.25%胰蛋白酶+0.02%EDTA消化液传代,每3天传代1次。当OS-RC-2肾癌细胞生长至对数生长期时,用 0.25%胰蛋白酶 +0.02%EDTA消化液离心收集OS-RC-2细胞,PBS洗3次,用PBS重悬OS-RC-2细胞,调整细胞浓度为2.5×106个/150μL。
1.4 裸鼠人肾癌模型的建立及鉴定 BALA/c-nu/nu裸鼠,用4%水合氯醛(0.1mL/10g)麻醉后,用带25号针头1 mL注射器分别吸取上述OS-RC-2细胞悬液150μL,注射于每只裸鼠于左前肢腋部皮下,共33只。1周后皮下瘤块形成,随机选取3只裸鼠,处死后取皮下瘤块行病理检查,确定OS-RC-2细胞瘤块造模成功。
1.5 实验分组及给药 选取经鉴定合格裸鼠人肾癌模型(接种后1周)30只,随机分3组:对照组、sorafenib低剂量组及sorafenib高剂量组各10只。对照组:1 mL PBS灌胃,每天1次,连续灌胃14天;sorafenib低剂量组:sorafenib按20 mg/kg剂量,溶于1 mL PBS灌胃给药,每天1次,连续灌胃14天;sorafenib高剂量组:sorafenib按80 mg/kg剂量,溶于1mL PBS灌胃给药,每天1次,连续灌胃14天。
1.6 IL-2及TNF-α测定 分别于给药后第7天及14天,随机选取对照组、低剂量组及高剂量组各5只,通过眼球摘除法采血,每只小鼠采血量约为0.5 mL,用ELISA法测定给药后第7、14天各组血清中细胞因子IL-2和TNF-α水平。具体实验步骤按照试剂盒说明书进行。
1.7 统计学处理 应用SPSS 16.0统计软件包对数据进行统计分析,所有数据采用均数±标准差(x±s)表示,多组间均数比较采用方差分析,两组间均数比较采用 LSD-t法检验,α =0.05,以 P <0.05为差异有统计学意义。
2 结果
2.1 给药后第7天sorafenib对人肾癌荷瘤裸鼠血清中IL-2及TNF-α的影响(表1) 由表1可见,sorafenib低剂量组及高剂量组血清中IL-2含量明显低于对照组(P<0.05);sorafenib高剂量组血清中TNF-α含量明显低于对照组(P<0.05)。
表1 给药后第7天人肾癌荷瘤裸鼠血清中IL-2及TNF-α的含量±s,n=5)

表1 给药后第7天人肾癌荷瘤裸鼠血清中IL-2及TNF-α的含量±s,n=5)
*:与对照组相比,P <0.05;△:与对照组相比,P <0.05。
组别 IL-2(ng/L) TNF-α(ng/L)对照组 1.77 ±0.36 1.34 ±0.21 sorafenib 低剂量组 1.38 ±0.16* 1.32 ±0.26 sorafenib高剂量组 1.34 ±0.30* 1.07 ±0.26△
2.2 给药后第14天sorafenib对人肾癌荷瘤裸鼠血清中IL-2及TNF-α的影响(表2) 由表2可见,对照组、sorafenib低剂量组及高剂量组血清中IL-2含量两两比较差异均无统计学意义(均P>0.05);对照组、sorafenib低剂量组及高剂量组血清中TNF-α含量两两比较差异也均无统计学意义(均 P>0.05)。
表2 给药第14天后人肾癌荷瘤裸鼠血清中IL-2及TNF-α的含量±s,n=5)
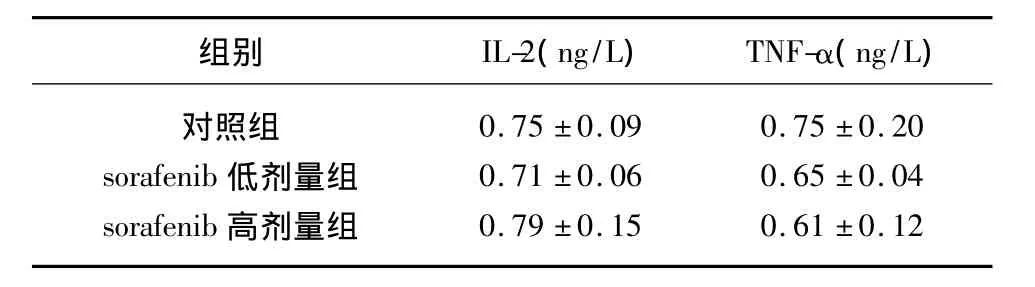
表2 给药第14天后人肾癌荷瘤裸鼠血清中IL-2及TNF-α的含量±s,n=5)
组别 IL-2(ng/L) TNF-α(ng/L)对照组 0.75 ±0.09 0.75 ±0.20 sorafenib 低剂量组 0.71 ±0.06 0.65 ±0.04 sorafenib高剂量组0.79 ±0.15 0.61 ±0.12
3 讨论
根治性肾切除术为肾癌目前首选的治疗方法,但术后及转移性肾癌目前尚无标准的辅助治疗方案。由于肾癌对放化疗均不敏感,所以免疫治疗就成为目前临床上治疗晚期转移性肾癌的主要治疗手段。然而研究表明,只有约15%的患者对细胞因子IL-2和IFN-α的免疫治疗敏感,而其他大部分患者不敏感,效果不理想[4]。有学者进行了局限性晚期肾细胞癌行全肾切除后是否应用IFN-α及IL-2治疗的随机对照研究,结果发现,术后细胞因子的辅助治疗在延缓复发时间和延长患者生存期上并没有明显优势[5-6]。
索拉非尼(sorafenib)是一种新型抗肾细胞癌的分子靶向药物,其为多靶点酪氨酸激酶抑制剂,能通过抑制RAF-MEK-ERK信号传导通路直接抑制肿瘤生长,还能通过抑制VEGF、PDGF及EGF等生长因子的表达而阻断肿瘤新生血管的形成而间接抑制肿瘤细胞的生长[7]。Strumberg 等[8]开展了 sorafenib的Ⅰ期临床试验,应用剂量范围为50~800 mg(bid),结果发现,该药的最大耐受剂量为400 mg,在超过最大耐受剂量时会有皮疹、腹泻、疲劳以及高血压等毒副反应产生,需要停止治疗。Ratain等[9]报道了一项随机非连续性的Ⅱ期临床试验,结果显示sorafenib治疗肾癌有效,显著延长了无进展生存期。而随后 Escudier等[10]进行了 sorafenib与安慰剂随机双盲对照的Ⅲ期临床试验,验证sorafenib治疗肾癌可延长肾癌患者的无进展生存期。根据Ⅰ~Ⅲ期临床试验的结果,美国FDA于2005年12月批准本药在临床上用于治疗肾癌患者。
目前,有关sorafenib联合干扰素、白介素的治疗肾癌的研究甚少。本研究通过检验sorafenib对人肾癌荷瘤裸鼠血清IL-2及TNF-α水平,进一步探讨sorafenib与细胞因子之间的关系。结果发现,给药后第7天,sorafenib低剂量组及高剂量组人肾癌荷瘤裸鼠血清中IL-2的含量低于对照组,sorafenib高剂量组人肾癌荷瘤裸鼠血清中TNF-α的含量低于对照组;而给药后第14天,对照组、sorafenib低剂量组及sorafenib高剂量组人肾癌荷瘤裸鼠血清中IL-2、TNF-α的含量均无差异。说明sorafenib对人肾癌荷瘤裸鼠IL-2及TNF-α的表达有影响,但影响较短暂且远期影响并不明确。此外,sorafenib与干扰素、白介素之间的具体作用方式、作用机制、远期影响等均不清楚,还需进一步研究。
综上,sorafenib对人肾癌荷瘤裸鼠IL-2及TNF-α的表达虽有影响,但较为短暂,远期相互作用也不明确,还需进行更广泛的实验研究,为sorafenib联合干扰素、白介素应用于肾癌的临床治疗提供更多的依据。
[1]袁香庆,崔传亮,斯璐,等.化疗联合CIK细胞回输治疗转移性肾细胞癌Ⅱ期临床研究[J].肿瘤学杂志,2008,14(5):362-365.
[2]Heldwein FL,Escudier B,Smyth G,et al.Metastatic renal cell carcinoma management[J].Int Braz J Urol,2009,35(3):256-270.
[3]王肇炎.肾癌的靶向药物治疗进展[J].实用肿瘤杂志,2008,23(6):491-493.
[4]吴永吉,刘硕,袁爱民,等.IL-2联合α干扰素对局部进展期肾癌患者疗效观察[J].河北医药,2009,31(22):3099-3100.
[5]Messing EM,Manola J,Wilding G,et al.PhaseⅢ study of interferon alfa-NL as adjuvant treatment for resectable renal cell carcinoma:an Eastern Cooperative Oncology Group/Intergroup trial[J].J Clin Oncol,2003,21(7):1214-1222.
[6]Clark JI,Atkins MB,Urba WJ,et al.Adjuvant high-dose bolus interleukin-2 for patients with high-risk renal cell carcinoma:a cytokine working group randomized trial[J].J Clin Oncol,2003,21(16):3133-3140.
[7]夏克良.索拉非尼治疗晚期转移性肾癌的现况及展望[J].内蒙古中医药,2010,29(14):110-111.
[8]Strumberg D,Awada A,Hirte H,et al.Pooled safety analysis of BAY 43-9006(sorafenib)monotherapy in patients with advanced solid tumours:Is rash associated with treatment outcome[J].Eur J Cancer,2006,42(4):548-556.
[9]Ratain MJ,Eisen T,Stadler WM,et al.Phase II placebo-controlled randomized discontinuation trial of sorafenib in patients with metastatic renal cell carcinoma[J].J Clin Oncol,2006,24(16):2505-2512.
[10]Escudier B,Eisen T,Stadler WM,et al.Sorafenib in advanced clear-cell renal-cell carcinoma[J].N Engl J Med,2007,356(2):125-134.

