高聚物萃取-光度法测定水果硬糖中色素的含量
杜建中,董柳余,金 蓓
高聚物萃取-光度法测定水果硬糖中色素的含量
杜建中,董柳余,金 蓓
(湛江师范学院化学科学与技术学院,广东 湛江 524048)
利用水溶性高聚物溶液在无机盐存在条件下可分成两相的特点,将水果硬糖中的色素转入高聚物相,采用单波长法和双波长等吸收法对色素含量进行定量测定。结果显示,胭脂红在0.2~30μg/mL、柠檬黄在0.2~40μg/mL、诱惑红在0.2~35μg/mL、日落黄在0.2~30μg/mL、亮蓝在0.1~10μg/mL范围内有良好的线性关系,相关系数(R2)均大于0.997。该方法所需仪器设备简单,操作简单,准确度较高。
聚乙二醇-4000;水果硬糖;分光光度法;色素
常见的食用合成色素主要有胭脂红、苋菜红、日落黄、柠檬黄、新红、诱惑红、亮蓝等,它们进入人体后不仅无营养价值,而且过量摄入其化学构成物质本身对人体有害,会消耗体内解毒物质,干扰人体正常代谢功能并直接作用靶器官,其毒性主要表现在不耐受性、致癌和儿童多动症[1]。同时,在色素合成过程中产生的杂质如砷、汞、苯酚、苯胺、铅、镉、乙醚、氯化物、硫酸盐等均有不同程度的毒性[2]。由于合成色素具有着色力强、色泽鲜艳、不易褪色、稳定性好、易溶解、成本低等特点,被广泛使用。目前,对食用色素检测的方法主要有光谱法[3-5]、极谱法[6-7]、液相色谱法[8-10]、高效液相色谱-质谱联用法[11-12]、毛细管电泳法[13]等。糖果中色素的检测方法有一阶导数分光光度法[14]、示波极谱法[15]、毛细管电泳法[16]、液相色谱法[17]。利用高聚物萃取分光光度法测定糖果中色素含量的研究未见报道。本实验根据在无机盐存在条件下,聚乙二醇-4000溶液能分成两相的特点,将糖果溶液中的色素定量转移至聚乙二醇-4000相中,利用单波长或者双波长等吸收法,实现糖果中不同色素含量的定量测定。
1 材料与方法
1.1 材料、试剂与仪器
不同品牌水果味棒棒糖、薄荷味硬糖 市售。
胭脂红、诱惑红 东京化成工业株式会社;柠檬黄、亮蓝、日落黄 天津市密欧化学试剂有限公司;聚乙二醇-4000 汕头市光华化学厂;硫酸铵 广州化学试剂厂。所用试剂均为AR级,实验用水均为蒸馏水。
UV-2550紫外-可见分光光度计 日本岛津公司;亚东微孔滤膜(孔径0.45μm) 上海医药工业研究所亚东分离仪器厂;SHI-DII型循环水真空抽滤机 巩义市予华仪器有限责任公司;FA1004型分析天平 上海精科天平公司。
1.2 方法
1.2.1 标准储备液的配制
准确称取15.2mg柠檬黄、15.3mg日落黄、16.2mg诱惑红、15.1mg胭脂红、9.2mg亮蓝,分别溶解定至100.0mL,其质量浓度为0.152、0.153、0.162、0.151、0.092mg/mL。使用前稀释至所需质量浓度。
1.2.2 色素的萃取
准确移取一定体积的色素溶液于60mL的分液漏斗中,加入5.0mL 300g/L聚乙二醇-4000溶液,摇匀,加入3.5g(NH4)2SO4固体,充分振荡2min,静置。待两相分层清晰后,分液,弃去萃余水相,将萃取相转移至25mL容量瓶中,洗涤分液漏斗,洗涤液并入容量瓶,加水定容,摇匀。
1.2.3 吸收曲线的绘制
取5个60mL的分液漏斗,分别加入柠檬黄、日落黄、诱惑红、胭脂红、亮蓝标准溶液,按1.2.2节操作得到各色素的萃取溶液,以未加色素的萃取相为参比溶液,在波长350~800nm范围对色素溶液进行扫描,吸收曲线见图1。

1.2.4 标准曲线的绘制
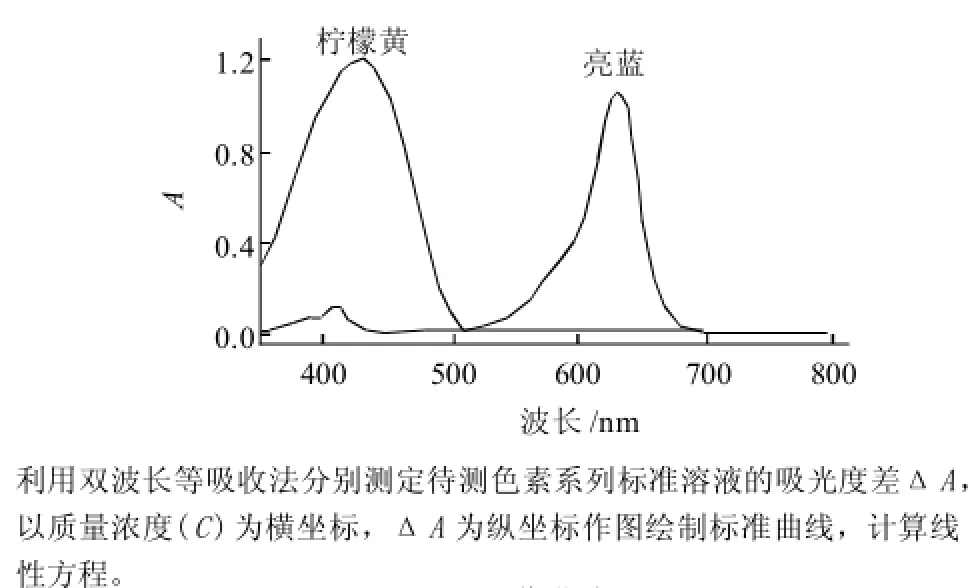
图1 吸收曲线Fig.1 Absorption curves of pigments
准确移取柠檬黄、日落黄、诱惑红、胭脂红、亮蓝标准溶液,按1.2.2节操作配制其系列标准溶液,以未加色素的萃取相做参比溶液,在各色素的测定波长下,测定其吸光度(A),以质量浓度(C)为横坐标,A为纵坐标作图绘制标准曲线,计算线性方程。
1.2.5 样品的处理
准确称取一定量的待测糖果,加适量水微热溶解,冷却至室温,定容至一定体积,用0.45μm的微孔滤膜减压干过滤,滤液转入干燥的试剂瓶中,待用。
1.2.6 样品的测定
准确移取一定体积糖果滤液于60mL的分液漏斗中,按1.2.2节操作萃取糖果中的色素,在各种色素的测定波长下,测定其A或ΔA,代入线性方程,求出待测溶液中色素的质量浓度,依据其称量质量,计算样品中色素的含量。
2 结果与分析
2.1 测定波长的确定
对只含有单一色素的糖果,根据吸收曲线,选择其最大吸收波长为测定波长,胭脂红的测定波长为510nm,柠檬黄的测定波长为427nm,日落黄的测定波长为483nm。
对于含有两种色素的糖果,观察其吸收曲线,柠檬黄与亮蓝相互干扰很小,在450nm和631nm波长处直接测定柠檬黄和亮蓝。若两色素吸收曲线相互干扰,采用双波长等吸收法或依据吸收最大干扰最小的原则确定其测定波长。柠檬黄与诱惑红:诱惑红可采用单波长法测定,测定波长为540nm,柠檬黄采用双波长法测定,组合波长为λ测=427nm,λ参=563nm。诱惑红与亮蓝:诱惑红采用双波长法测定,其组合波长为λ测=505nm,λ参=690nm,亮蓝采用单波长法测定,测定波长为631nm。柠檬黄与日落黄:柠檬黄采用双波长法,其波长组合为λ参=428nm,λ参=525nm;日落黄采用单波长法测定,其测定波长为523nm。
2.2 标准曲线的绘制
按1.2.4节操作,配制各色素的标准溶液,在选定的波长下测定其A或ΔA,以A-C或ΔA-C绘制标准曲线,计算线性方程,结果见表1。

表1 定量分析特征参数Table 1 Characteristic parameters for qualitative analysis of pigments
2.3 空白溶液的影响
准确称取一定质量的上好佳薄荷味无色硬糖,按1.2.5节方法操作,配制无色糖果溶液。分别移取10.00mL水、10.00mL无色糖果溶液于两个60mL分液漏斗中,按1.2.2节操作配制溶液1溶液2,分别以两种溶液为参比溶液,对徐福记甜香橙味硬糖中的日落黄进行定量测定,结果见表2。结果显示,分别以溶液1、溶液2做参比溶液,其测定结果无显著性差异。

表2 日落黄含量的测定结果(n=3)Table 2 Results of analysis of sunset yellow (n=3)
2.4 萃取效果的测定
为考察溶液中的色素转移至萃取相的程度,按1.2.2节操作,将萃余水相转移至容量瓶中,定容、摇匀。以未加色素的萃余水相为参比溶液,对色素溶液的萃余水相进行光谱扫描,见图2。结果显示,萃余水相的最大吸光度小于0.004,说明萃取过程中,绝大多数色素已转移至聚乙二醇-4000相,萃取效果好,一次萃取即能满足实验的要求。
2.5 样品测定
将处理好的待测糖果溶液,按1.2.6节操作测定其A或ΔA,代入线性方程,求出其色素含量,结果见表3。
2.6 加标回收实验
准确称取一定质量的待测样品,加入一定体积的色素标准溶液,按1.2.5节操作处理样品,按1.2.6节操作进行加标回收实验,结果见表4。

图2 萃余水相的吸收曲线Fig.2 Absorption curve of aqueous phase extract
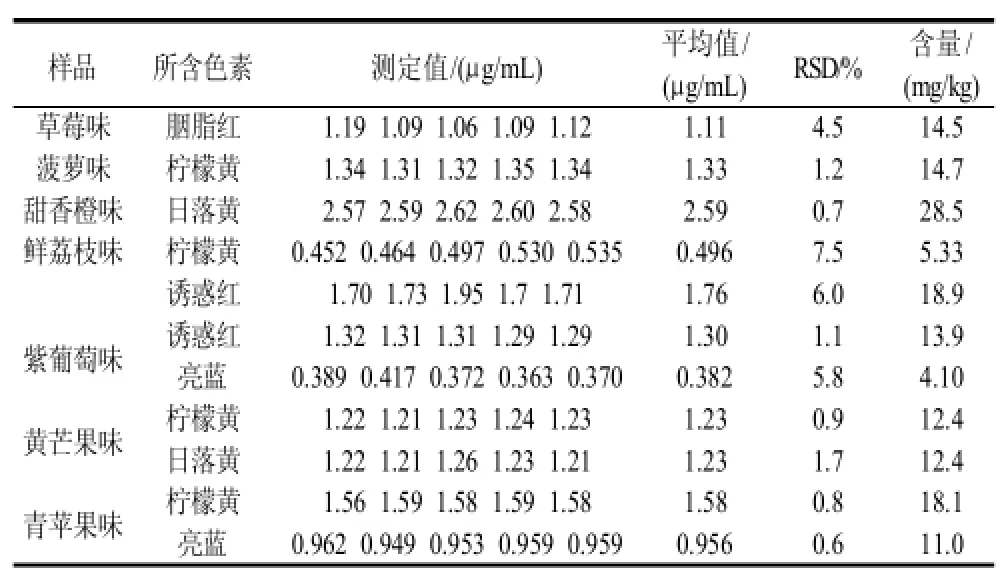
表3 样品中色素含量的测定(n=5)Table 3 Results of determination of pigments in fruit hard candies with different flavors(n=5)

表4 回收率实验结果(n=5)Table 4 Results of spike recovery experiments(n=5)
3 结 论
根据我国的食品添加剂使用标准GB 2760—2011《食品添加剂使用标准》[18],糖果中柠檬黄、日落黄、诱惑红、胭脂红、亮蓝的最大使用量分别为0.1、0.1、0.3、0.05、0.3g/kg,根据本实验所测得的结果,所测糖果中色素含量符合国家标准。
利用水溶性高聚物可将水果硬糖溶液中的色素转移至聚乙二醇-4000相中,实现了对待测色素的定量测定。方法操作简单,测定结果准确度较高,为水果硬糖中柠檬黄、日落黄、诱惑红、胭脂红、亮蓝5种色素的定量测定提供了较理想的方法。
[1]丁成翔, 代汉慧, 陈冬东. 六种着色剂毒性研究进展[J]. 检验检疫学刊, 2009, 19(2)∶ 70-73.
[2]许牡丹, 毛根年. 食品安全性与分析检测[M]. 北京∶ 化学工业出版社, 2003∶ 223.
[3]景顺杰, 李建晴. 分光光度法直接测定饮料中的柠檬黄和胭脂红[J].山西大同大学学报, 2007, 23(3)∶ 22-24.
[4]刘冷, 李建晴, 郭芬, 等. 紫外分光光度法同时测定柠檬黄和日落黄[J]. 光谱实验室, 2007, 24(3)∶ 423-427.
[5]杜建中, 李青梅, 朱艺强, 等. 双波长比值光谱法测定饮料中的色素[J]. 食品科学, 2010, 31(10)∶ 259-262.
[6]刘红, 曹红, 戴永强, 等. 3种食用合成色素的示波极谱法测定[J]. 农垦医学, 2003, 25(4)∶ 233-235.
[7]宋新, 纪双利, 杨丽, 等. 示波极谱法在食品合成食用色素测定中的应用[J]. 中国食品卫生杂志, 2009, 21(5)∶ 422-423.
[8]徐明敏, 陈波. 变波长紫外液相色谱法测定果汁中5种人工合成色素[J]. 浙江预防医学, 2007, 19(5)∶ 93-94.
[9]阿布都外力·吐尼亚孜, 杨涛, 鹿毅, 等. 反相高效液相色谱法同时测定10种食品添加剂[J]. 食品科技, 2009, 34(8)∶ 275-279.
[10]张婉, 王覃, 杜宁, 等. 超高效液相色谱法同时测定饮料中5种人工合成色素[J]. 食品科学, 2011, 32(4)∶ 177-181.
[11]陈晓红, 李小平, 姚浔, 等. 高效液相色谱-质谱联用法测定饮料中人工合成色素的研究[J]. 中国卫生检验杂志, 2005, 15(8)∶ 941-942.
[12]李帮锐, 冯家力, 潘振球, 等. 高效液相色谱-质谱/质谱联用法测定饮料中人工合成色素[J]. 中国卫生检验杂志, 2007, 17(4)∶ 579-580.
[13]巫素琴, 温亚波, 邹兰, 等. 毛细管电泳法分离测定饮料中色素含量的研究[J]. 湛江师范学院学报, 2009, 30(6)∶ 73-77.
[14]潘晓菲, 王俊霞. 一阶导数分光光度法测定糖果中食用色素[J]. 中国食品卫生杂志, 1992, 4(3)∶ 51.
[15]刘玉莹, 马永民, 李耀红, 等. 示波极谱法测定饮料及糖果中合成色素日落黄[J]. 中国卫生检验杂志, 1998, 8(6)∶ 351-352.
[16]赵新颖, 贾丽, 周晓晶, 等. 毛细管电泳法同时测定糖果中5种人工合成色素的含量[J]. 现代仪器, 2008(4)∶ 58-60.
[17]王红青, 潘向荣, 姜荷, 等. 糖果中6种合成色素液相色谱检测方法的改进[J]. 中国卫生检验杂质, 2010, 20(2)∶ 351-352.
[18]GB2760—2011 食品添加剂使用标准[S].
Determination of Pigments in Fruit Hard Candy by Polymer Extraction and Spectrophotometry
DU Jian-zhong,DONG Liu-yu,JIN Bei
(School of Chemistry Science and Technology, Zhanjiang Normal University, Zhanjiang 524048, China)
Based on the fact that aqueous solution of water-soluble polymers can be separated into two phases upon addition of inorganic salt, pigments in fruit hard candy were transferred into the polymer phase, resulting in reduced interference, and quantitatively determined by single-wavelength or dual-wavelength spectrometry. The results showed that the linear ranges of cochineal, lemon yellow, fancy red, sunset yellow, and bright blue were 0.2-30, 0.2-40, 0.2-35, 0.2-30, mg/mLand 0.1-10μg/mL, respectively, with correlation coefficient (r2) of larger than 0.997. This method needs only simple equipment and is easy to use, and accurate.
polythene glycol-4000;fruit hard candy;spectrometry;pigment
O658.2
A
1002-6630(2012)18-0191-04
2011-07-08
广东省高校优秀青年创新人才培育项目(LYM09110)
杜建中(1956—),男,教授,本科,主要从事分析化学及微量组分分析研究。E-mail:djz560119@126.com

