氟铃脲在甘蓝植株及种植土壤中残留量的分析方法研究
杨丽华,龚道新
(1.湖南农业大学资源环境学院,湖南 长沙 410128;2.湖南农业大学农业环境保护研究所,湖南 长沙 410128)
氟铃脲(hexaflumuron)化学名称:1-[3,5-二氯-4-(1,1,2,2-四氟乙氧基) 苯基]-3-(2,6-二氟苯甲酰基)脲,分子式为C16H8CL2F6N2O3,是近年来国外开发的新型昆虫生长调节剂[1],可有效防治棉花、蔬菜、果树、林木等多种植物上的害虫,并对已产生药物抗性(如有机磷类、氨基甲酸酯类、拟除虫菊酯类杀虫剂等)的害虫具有良好的防治效果[2]。但是作为农药,氟铃脲的使用是否会危及食品安全,是否会造成环境污染仍然是人们关注的一个重要问题。目前,日本已规定氟铃脲在羽衣甘蓝、卷心菜中的最大残留限量(MRL值)为0.20mg/kg,韩国规定氟铃脲在甘蓝中的MRL值为0.30 mg/kg,而中国,目前尚未规定氟铃脲在甘蓝中的MRL值。因此,研究氟铃脲在甘蓝上的残留分析方法具有一定的意义。
目前关于氟铃脲的报道主要集中在其药效、毒理、农药合成和制备以及色谱分析方法等方面[3],关于其在甘蓝植株中的残留分析方法的报道还较少,笔者在前人工作的基础上[4-12],采用高效液相色谱(HPLC)法较为系统地研究并建立了氟铃脲在甘蓝植株和种植土壤中的残留分析与检测方法。
1 材料与方法
1.1 仪器、试剂与材料
HP-1100型HPLC(美国HP公司,带紫外检测器及HP化学工作站),SHY-2AS水浴恒温振荡器,HY-Z型调速多用振荡器,RE-2000A型旋转浓缩仪,TP-220A电子天平,布氏漏斗,梨形抽滤瓶,玻璃层析柱(长20 cm,直径1.5 cm),具塞磨口三角瓶等试验室常用玻璃仪器设备;乙腈、丙酮、乙酸乙酯、二氯甲烷、氯化钠、无水硫酸钠均为分析纯,甲醇为色谱纯;Florisil(色谱层析用,60~100 目,650灼烧5 h,冷却后加2%蒸馏水脱活,保存在130℃的烘箱中,备用);氟铃脲标准样品(纯度≥98%)(浙江威尔达化工有限公司)。
1.2 高效液相色谱条件
色谱柱Welchmaterials ultimateXB-C18柱(4.6 mm×150mm,5μm,美国 Welch公司);流动相为甲醇∶水(73∶27,V/V),柱温为 30℃,流速为 0.8mL/min,检测波长为220 nm,进样量为20μL。
1.3 标准溶液的配制
准确称取氟铃脲标准品0.051 0 g(纯度为98%),用色谱甲醇溶解并定容至100.0 mL,得到浓度为500.0mg/L的氟铃脲标准母液,于4℃冰箱中保存。
1.4 样品的提取及净化
1.4.1 样品的提取 准确称取甘蓝和甘蓝种植土壤样品各20.0 g,置于250 mL具塞三角瓶中,加入60 mL乙腈(甘蓝样品需加入适量的无水硫酸钠,以吸取甘蓝样品解冻后的水分),在恒温振荡器中振荡提取30min,经布氏漏斗减压抽滤;用乙腈分别洗涤残渣和抽滤瓶2次,每次使用20mL乙腈,合并乙腈提取液并转入旋转蒸发仪中(40℃)蒸发近干,待弗罗里硅土(Florisil)柱净化。
1.4.2 样品的净化 弗罗里硅土层析柱从下至上依次装填有少许脱脂棉、2 cm厚无水硫酸钠、5 g弗罗里硅土、2 cm厚无水硫酸钠,在装柱的过程中要敲紧敲实,在弗罗里硅土净化柱装好后,用乙酸乙酯作淋洗液。先用20mL淋洗液预淋,再将上述提取浓缩液无损移入弗罗里硅土净化柱中,用50 mL乙酸乙酯分次洗脱,收集全部洗脱液,于旋转蒸发器上浓缩至近干,然后用色谱甲醇定容至5.0 mL,过0.45μm滤膜,待HPLC检测。
2 结果与讨论
2.1 样品的提取与净化方法
试验比较了乙腈、二氯甲烷和甲醇提取甘蓝及甘蓝种植土壤中氟铃脲的效果,结果表明:3种提取溶剂的提取回收率均超过85%,但乙腈作为提取剂,回收率更稳定且与样品中的杂质分离更完全,说明使用乙腈作提取剂是比较合适的。
在柱层析净化中,比较了乙酸乙酯、丙酮和乙酸乙酯的混合液(1∶1,V/V)和丙酮3种淋洗液对氟铃脲洗脱的影响,结果表明:前两种淋洗液都能较好地将氟铃脲洗脱下来,回收率较高且能使氟铃脲与杂质较好地分离,而丙酮作为淋洗液,虽能将氟铃脲洗脱下来,回收率也较高,但氟铃脲与杂质分离不好,故不考虑用丙酮作为洗脱液;乙酸乙酯比丙酮和乙酸乙酯的混合液(1∶1,V/V)在操作过程更简便,综合考虑选择乙酸乙酯作淋洗液是较为适宜的。
2.2 HPLC检测条件的选择
设计水和甲醇以不同比例混合作为流动相进行等度洗脱,研究其对氟铃脲的峰形,与杂质峰的分离度及分离时间等因素的影响,试验结果显示:甲醇∶水=73∶27(V/V)时分离效果最好。同时还对流动相的流速和柱温等条件进行了优化,选定了流动相的流速为0.8mL/min,柱温为30℃。
氟铃脲在190~210 nm波长范围内有最大吸收峰,其中最大吸收波长为205 nm,但氟铃脲在250~260 nm范围内,有次吸收峰,并且甲醇对小于210 nm的紫外光随波长减少吸光度增大,所以205 nm不宜作为检测波长。在试验过程中分别选择了210 nm、215 nm和220 nm作为测定波长,结果表明:220 nm处氟铃脲的测定灵敏度高,也比较稳定,并且在进行实际样品测定时分离较完全,故选择220 nm作为测定波长。在选定的色谱条件下,氟铃脲的保留时间为13.80 min,标样、甘蓝植株和种植土壤样品色谱图见图1~5。

图1 氟铃脲标样色谱分析
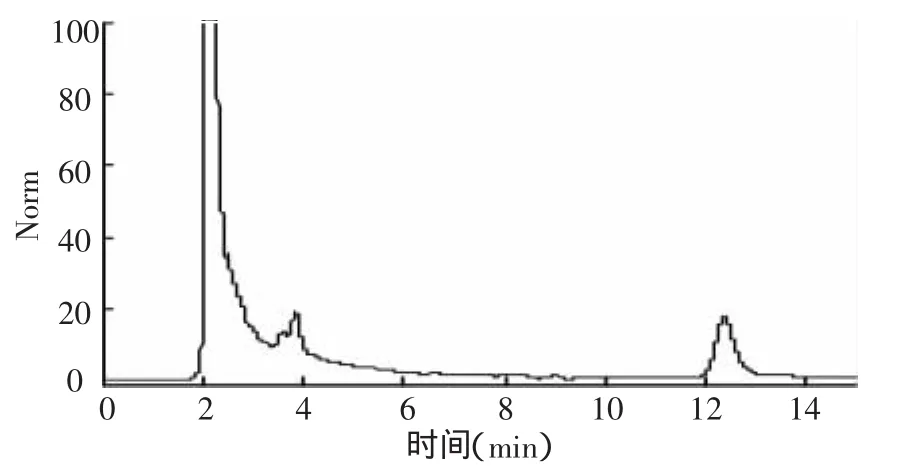
图2 氟铃脲在甘蓝种植土壤中空白样品色谱分析
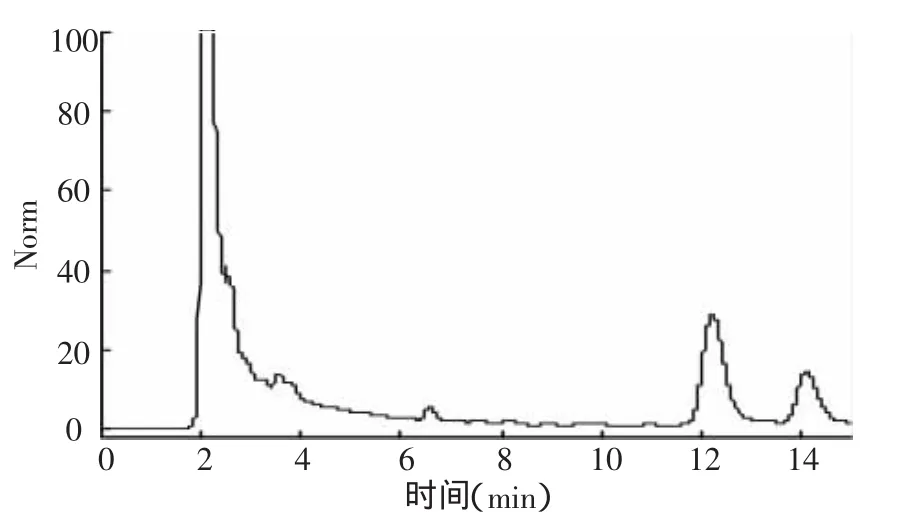
图3 氟铃脲在甘蓝种植土壤中添加样品色谱分析
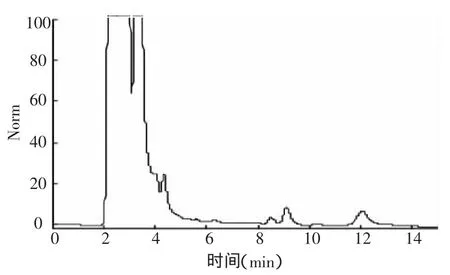
图4 氟铃脲在甘蓝植株中空白样品色谱分析
2.3 方法的线性相关性
利用氟铃脲母液配制成质量浓度分别为0.02、0.05、0.10、0.50、1.00mg/L 的标准工作溶液,并在选定的HPLC检测条件下对标准工作溶液进行浓度测定(x,mg/L),所对应色谱峰的峰面积(y)。经统计分析得到氟铃脲的标准工作曲线的回归方程为:y=102.7 x+0.490 9,相关系数为0.999 6。这表明氟铃脲的标准工作溶液与其相对应的色谱峰面积在所选定的浓度范围内呈良好的线性关系,可以用来进行含氟玲脲样品的定量分析。
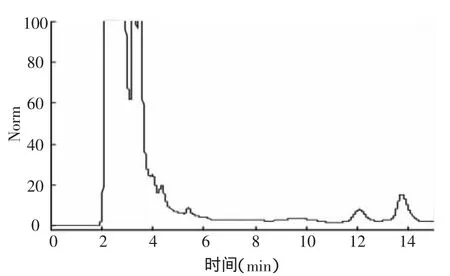
图5 氟铃脲在甘蓝植株中添加样品色谱分析
2.4 添加回收率试验
在甘蓝植株和种植土壤的空白对照样品中分别添加氟铃脲的标准溶液,使样品中氟铃脲的浓度分别达到0.05、0.20、1.00mg/kg,每个浓度处理重复5次,按上述所选定的方法及检测条件进行样品的分析与检测,结果见表1,结果显示:氟铃脲在甘蓝植株和种植土壤样品中的添加回收率在78.84%~90.72%之间,平均回收率为82.73%~85.56%,相对标准偏差为1.25%~4.65%,氟铃脲的添加回收率和相对标准偏差均在农药残留试验准则允许的范围内;在选定的分析与检测条件下,氟铃脲的最小检出量为4.0×10-10g,氟铃脲在甘蓝植株和种植土壤中的最低检出浓度均为5.0×10-3mg/kg。
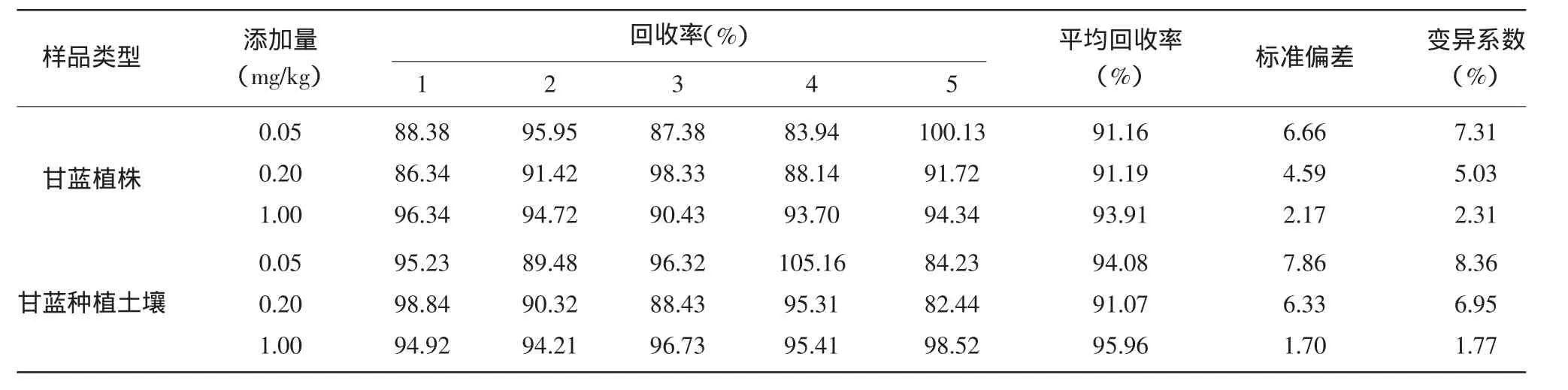
表1 氟铃脲在甘蓝植株和种植土壤中的添加回收率
3 结论
该检测方法采用乙腈对甘蓝植株和种植土壤样品中的氟铃脲进行提取,用Florisil柱净化,HPLC分析。应用该方法对甲维·氟铃脲11%水分散粒剂在甘蓝上残留试验进行了研究,获得了较满意的结果,证明该方法具有操作简单、分离效果好、线性范围宽、回收率高、精密度好和分析效率高等特点,能满足该农药残留检测的要求。
[1] 郭正元,杨仁斌,徐 珍,等.5%氟铃脲乳油在棉田生态系统中的安全使用评价[J].农业环境科学学报,2007,26(6):2329-2333.
[2] 盛 宇,徐 军,刘新刚,等.分散固相萃取-超高效液相色谱-串联质谱法快速检测棉花和土壤中氟铃脲的残留 [J].农药学学报,2010,12(3):294-298.
[3] 徐 珍.氟铃脲在菜园环境中的持久性及对几种土壤生物学指标的影响研究[D].长沙:湖南农业大学硕士论文,2007.
[4] 王雪娟,魏金旺.氟铃脲的液相色谱分析研究[J].农药,1999,9(38):14.
[5] 何红梅,吴俐勤,章 虎,等.蔬菜中苯甲酰脲类药物残留的测定方法研究[J].分析化学,2006,10(34):1379-1383.
[6] 韩红新,吴莉宇,徐 志,等.液质联用(ESI)检测蔬菜中4种农药残留[J].农药,2008,3(47):198-200.
[7] 李 敏,秦金平,徐春祥.蔬菜中氟铃脲·氟苯脲·氟虫脲和氟啶脲的高效液相色谱分析 [J].安徽农业科学,2011,39(1):204-205.
[8] 曾 鑫,柏连阳.农产品中农药残留检测技术研究进展和发展方向[J].安徽农业科学,2011,39(26):16465-16467.
[9] Alexis Peppuy,Alain Robert.Efficacy of Hexayumuron against the Fungus-Gr-owing Termite Pseudacanthotermesspiniger(Sjo.stedt)(Isoptera,Macroterm-itinae)[J].Pesticide Science,1998,54(1):22-26.
[10] 王同涛,张瑞生,刘自友,等.氟铃脲50%水分散粒剂的研制[J].农药科学与管理,2009,30(3):16-18.
[11] Fisher M H.Reeent Progress in Avermectin research[J].ACS Symposium Series American Chemical Society,1993,524:169.
[12] 罗 杨,龚道新,李小娇,等.杀扑磷在柑橘和土壤中的消解动态及残留安全性评价[J].湖南农业科学,2011,(9):98-100,104.

