基于SNP标记的种子纯度高效检测分析模型的建立
李欧静,张桂华,兰青阔 ,王 永 ,赵 新 ,朱 珠 ,陈 锐,郭永泽
(1.天津市农业质量标准与检测技术研究所,天津 300381;2.天津科润农业科技股份有限公司,天津 300192)
蔬菜种子纯度是种子质量的重要指标,其鉴定方法有田间形态试验、RAPD、SSR、同工酶标记等,但这些方法在操作性、稳定性、多态性等方面不能满足目前的需要。单核苷酸多态性(Single nucleotide polymorphism,SNP)是指基因组水平上由单个核苷酸的变异所引起的DNA序列多态性。近年来,SNP标记以其二态性、等位基因性、高密度性以及高遗传稳定性等优点成为研究热点,被广泛应用于农作物遗传学研究[1]和品种鉴定当中[2]。
焦磷酸测序技术(Pyrosequencing)是实时、定量分析DNA序列的新一代测序技术,是基于引物引导的多聚酶延伸下的核酸合成的新型DNA测序技术[3],具有操作简单、费用低、通量高、结果准确和自动化程度高等优点,特别适合SNP、small InDel等短序列分析,具有较高的灵敏性和准确性。Pyrosequencing技术的另一突出优势在于与DNA池(DNA Pooling)技术的结合应用。Pooling技术的原理是将已知对照样本和多个未知样本混合在一起进行PCR扩增,PCR产物经基因分型、最后用统计学方法对数据进行分析,得到已知样本在总样本中的比例[4]。Pyrosequencing和Pooling联用技术兼有Pyrosequencing的定量测序优点和Pooling高通量的优点,特别适用于大规模样品的等位基因频率分析[5],能满足种子纯度鉴定大样本量的需求。
笔者分析了黄瓜SNP位点CLA13(C/G)在16个黄瓜育种材料中的多态性,结合Pyrosequencing和DNA Pooling技术,建立3Pooling SNP Pyrosequencing标准曲线,快速、高效的鉴定黄瓜种子纯度,旨在为后续的品种鉴定及大批量的蔬菜种子纯度鉴定奠定基础。
1 材料和方法
1.1 材料
供试材料:16个黄瓜杂交种及其母本、父本的基因组DNA由天津科润农业科技股份有限公司黄瓜研究所提供。
1.2 方法
1.2.1 SNP位点的选择及引物设计 经网络数据库检索、验证获得黄瓜SNP位点CLA13(C/G),利用PSQ Assay Design软件设计用于焦磷酸测序的PCR引物、测序引物以及需要分析的目标序列(Sequence to Analyze),其中前引物5’加生物素(Biotin)标记修饰见表1。引物由上海生工生物工程有限公司合成。

表1 CLA13(C/G)位点焦磷酸测序引物序列
1.2.2 焦磷酸测序反应 包括用于制备测序反应模板的PCR扩增和焦磷酸测序反应[6]。PCR扩增采用50μL反应体系,其中2×GoTaq Green Master Mix(Promega)25μL,上下游引物(10 μmol/L)各 1μL,DNA模板100 ng,灭菌去离子水补足至50μL。反应程序为94℃预变性5min;50个循环反应(94℃30 s,50℃ 30 s,72℃ 40 s);72℃延伸 7 min;4℃保存。PCR仪为ABIverity 96 well Thermal cycler。
焦磷酸测序反应在PyroMark ID焦磷酸测序仪(Biotage)上进行。PCR产物中加入47μL Binding buffer(Biotage)和 3 μL Sepharose beads(Biotage),1 300 r/min涡旋混匀 15 min,经 Vacuum prep workstation单链分离,释放到预先加入38.8μL Annealing buffer(Biotage)和1.2μL测序引物(10 μmol/L)的PSQ 96测序反应板中,80℃金属加热块(Labnet)上加热2min后冷却至室温。将酶、底物和A、T、C、G 成分(Qiagen)加入试剂仓,即可上机测序。测序结果可通过分型分析模式(Genotyping)直接获得样品SNP类型,或者通过等位基因频率AQ(Allele Quantification)模式分析C基因型频率C%和G基因型频率G%。
1.2.3 DNA Pooling最适数量的确定 取3号杂交种(基因型记为C/G)及其父本(基因型记为C/C)基因组DNA,精确稀释至20 ng/μL,按照C/C与C/G 的比例为 1∶1、1∶2、1∶3、1∶4、1∶5、1∶6、1∶7、1∶8、1∶9 和1∶19 进行混合,模拟 2、3、4、5、6、7、8、9、10、20 个杂交种Pooling中混杂1个C/C的情况。将上述10种充分混匀DNA模板进行PCR扩增及焦磷酸测序分析,获得C等位基因频率C%和G等位基因频率G%(G%=1-C%)。试验设置10次重复。
1.2.4 3 Pooling SNPPyrosequencing标准曲线的建立 取3号杂交种(C/G)及其母本(G/G)、父本(C/C)的基因组 DNA(20 ng/μL),按照 C3(3C/C)、C2(2C/C∶1C/G)、C1(1C/C∶2C/G)、Hybrid(3C/G)、G1(1G/G∶2C/G)、G2(2G/G∶1C/G)、G3(3G/G)的梯度比例混合DNA模板,进行PCR扩增和焦磷酸测序,分析等位基因频率C%,并建立C%与不同梯度的标准曲线。
1.2.5 3 Pooling SNPPyrosequencing分析模型样品检验 选择SNP位点为C/G分型的黄瓜杂交品种8号进行样品检验试验。选颗粒饱满、大小均匀籽粒30粒,浸泡、萌发、每3个种子DNA等量混合,进行PCR扩增、焦磷酸测序以及等位基因频率分析。根据建立的标准曲线模型,换算出其中来自亲本的污染。
1.2.6 数据分析 SNP多态信息量PIC值使用PIC_CALC软件计算,TTEST和标准曲线制定使用office excel软件完成。
2 结果与分析
2.1 CLA13(C/G)位点分型及多态信息量分析
对16个黄瓜杂交种及其亲本的CLA13(C/G)位点进行PCR扩增及焦磷酸测序分析,分型结果见表2。在16个子代中,7个检测为C/G杂合,因此CLA13(C/G)位点适合7个品种做黄瓜种子纯度鉴定试验。进一步对CLA13(C/G)位点多态信息量(PIC)分析表明,在16个黄瓜杂交种的群体中该SNP位点PIC达0.556,处于高度多态。
2.2 DNA Pooling最适数量的确定
为提高种子纯度检测效率,研究引入DNA Pooling技术,通过分析DNA Pooling中SNP位点的等位基因频率,确定样品的杂合程度,并转换为种子纯度。按一定梯度比例混合C/C基因型和C/G基因型DNA,模拟不同DNA Pooling,并通过比较不同DNA Pooling下等位基因频率差异显著性,确定最适DNA Pooling。
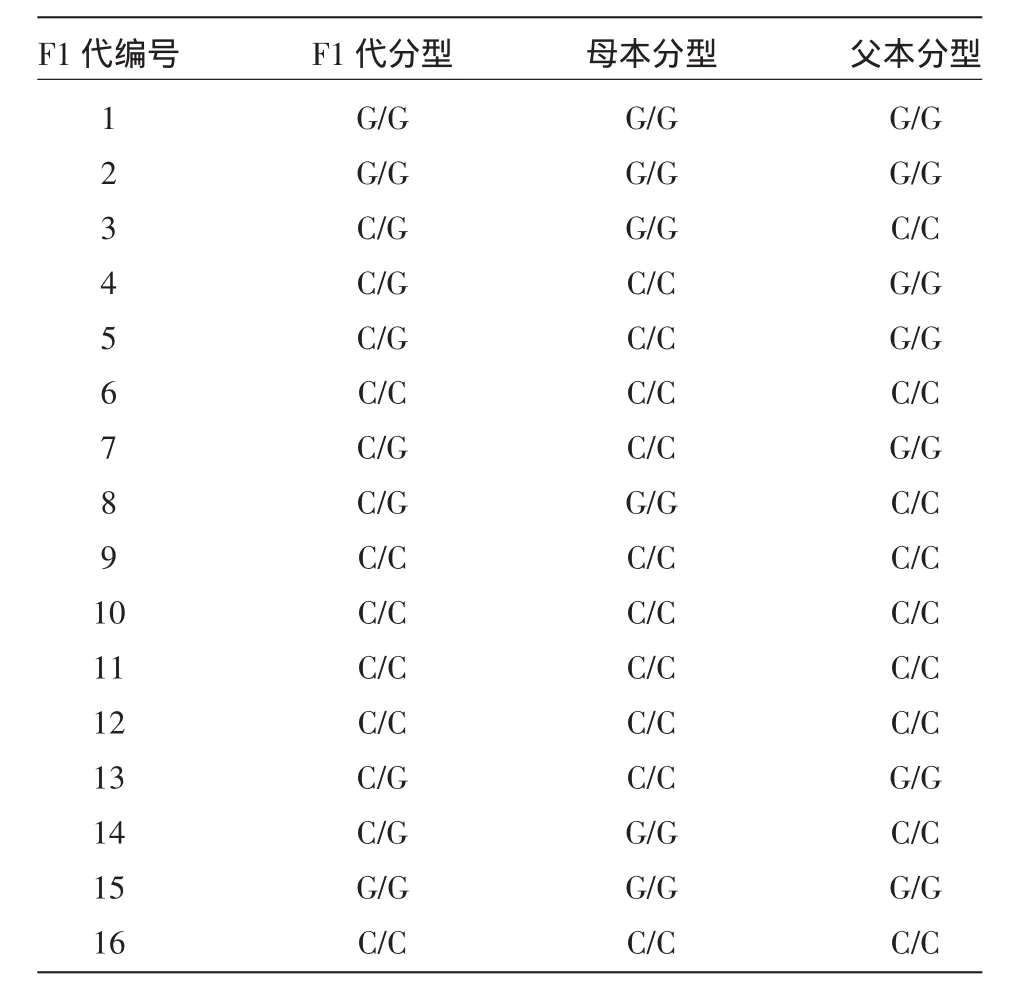
表2 16个黄瓜杂交种及其亲本CLA13(C/G)位点分型分析
如表3所示,随着Pooling数量的增加,C%平均值逐渐下降并接近50%。对2~20 Pooling C%值进行TTest分析显示,4 Pooling以下呈显著差异水平,3 Pooling以下呈极显著差异水平。考虑试验的准确性和可靠性,选择3 Pooling作为最佳Pooling数量,即在种子纯度检测过程中,将3粒种子作为1个Pooling进行检测具备较高的效率和准确度。
2.3 3 Pooling SNPPyrosequencing标准曲线的建立
为了把C等位基因频率转换为3 Pooling中杂交种的数量,需建立3 Pooling SNPPyrosequencing标准曲线。结果显示,随着C3-G3七个梯度样品中C基因降低和G基因升高,焦磷酸测序峰图(图1A)中C碱基峰高从后续碱基T、C、G的1倍峰高逐步降低为0,G碱基峰高从0逐渐升高到与后续碱基T、C、G的峰高持平;建立C%与C3-G3七个梯度样品标准曲线(图1B),两者呈线性关系,R2达0.998 2。参考该标准曲线,可通过画图比较或计算的方法将C%转换出3 Pooling样品中是否含有或含有几粒C/C或G/G类型种子。
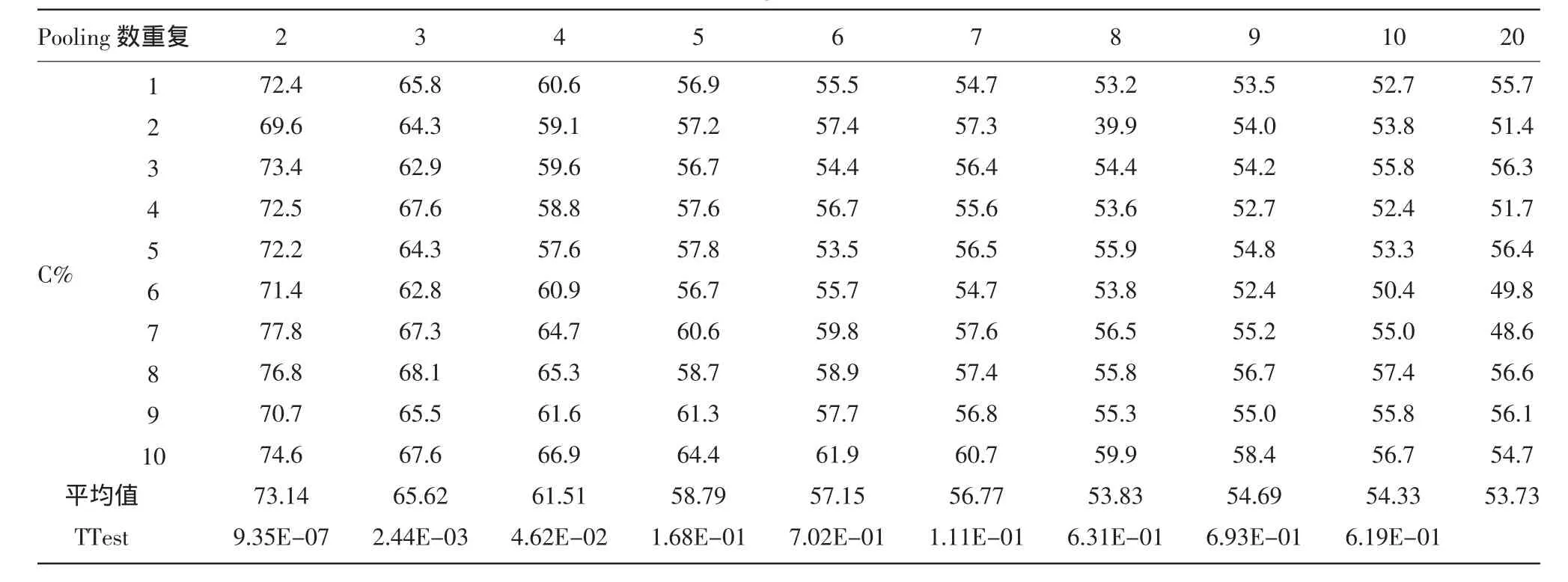
表3 不同DNA Pooling数量C等位基因频率分析
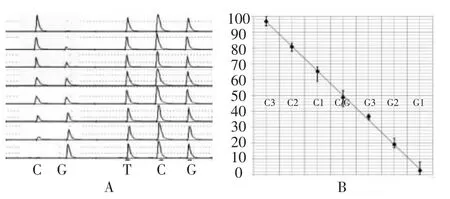
图1 3Pooling下C梯度测序结果及标准曲线
2.4 3 Pooling SNPPyrosequencing分析模型样品检验
如表4所示,10个Pooling中第1 Pooling C%值为65.3%,第7 PoolingC%值为66.2%,说明第1 Pooling和第7 Pooling的3粒种子中含有1个C/C类型的种子,而其他8个Pooling均为C/G类型的种子。因此,该30粒种子中含有2粒非杂交种,纯度可记为93.3%。

表4 3Pooling检验黄瓜杂交品种种子纯度结果
3 讨论与结论
种子纯度是指杂交种后代表型的一致性,是黄瓜种子质量的重要指标。造成黄瓜种子纯度低的主要原因有亲本纯度不够高、生物混杂和机械混杂等原因,其中来自母本的混杂较为普遍。因此,杂交种中母本基因型的检测是分子检测的重点。SNP分子标记是继SSR标记以后的第三代分子标记,具有高密度和高度遗传稳定性等优点,而且大多数只有两种等位基因型,所以也被称为双等位基因标记(biallelic marker),能够明显区分出母本、父本及杂交种基因型。因此,SNP分子标记适合于黄瓜品种真实性和纯度检测的要求。
研究将SNP标记技术、Pyrosequencing技术和DNA Pooling技术有机结合,建立3 Pooling SNP Pyrosequencing种子纯度检测分析模型,克服了RAPD、SSR等分子标记技术必须凝胶电泳的瓶颈,提高了黄瓜杂交种纯度鉴定效率。同时,3 Pooling SNPPyrosequencing分析模型可应用于其他作物种子纯度鉴定,具有推广价值和应用前景。
[1] 李兆波,吴 禹,王 岩,等.SNP标记技术及其在农作物育种中的应用[J].辽宁农业职业技术学院学报,2010,5(12):8-9.
[2] Jung JK,Park SW,Liu W Y,et al.Discovery of single nucleotide polymorphism in Capsicum and SNPmarkers for cultivar identification[J].Euphytica,2010,175(1):91-107.
[3] Pati N,Schowinsky V,Kokanovic O,et al.A comparison between SNa Pshot,pyrosequencing,and biplex invader SNP genotyping methods:accuracy,cost,and throughput[J].J Biochem Biophys Methods,2004 ,60(1):1-12.
[4] 李树珍,万慧荣,杨 光.DNA池结合DHPLC和直接测序技术在江豚 SNPs检测中的应用[J].兽类学报,2009,29(2):185-190.
[5] Lin Y S,Liu FG,Wang T Y,et al.A simplemethod using PyrosequencingTM to identify de novo SNPs in pooled DNA samples[J].Nucleic Acids Research,2011,39(5):28.
[6] 兰青阔,张桂华,王 永,等.基于InDel标记快速检测黄瓜津优38 种子纯度[J].种子,2011,30(6):19-23.

