交联可调式抗结核药物缓释型纳米人工骨复合体的生物安全性研究
席焱海,薛敏涛,叶晓健,何海龙
目前临床上对于结核病灶清除术后的骨组织缺损理想的治疗策略就是设计具有促进骨缺损组织修复作用并且同时可以长效缓释抗结核药物的人工骨填充缓释材料,这样就可以在促进骨组织再生修复骨缺损的同时维持局部有效的抗结核药物浓度,有助于骨移植物周围骨组织再生的同时抑制局部结核杆菌的繁殖,从而避免局部结核病灶的复发,促进患者的康复[1]。本研究将磷酸三钙生物陶瓷(tricalcium phosphate bioceramics,TPB) 人工骨支架与一定浓度的海藻酸钠(sodium alginate ,SA) 、氯化钙水溶液、抗结核药利福平(rifampicine,RFP) 相混合,利用SA 在钙离子作用下的自组装特性制备成TPB/SA-RFP 抗结核药物微球复合体,并将此复合体分别用聚乳酸(poly lactic acid,PLA) 、PLA 与羟基乙酸共聚物[poly (lactic-co-glycolic acid) ,PLGA]或聚乙内酯[poly (ε-caprolactone) ,PCL]进行表面涂层化处理,从而最终制备出交联可调式抗结核药物缓释型纳米人工骨 TPB/SA-RFP/PLA(PLGA、PCL) 复合体。在对其骨修复活性进行测试之前,分别进行了复MTT 细胞毒性实验、急性全身毒性实验、皮内刺激实验及致敏实验,并与对照组比较,对其生物安全性进行初步测试,以证实其安全可靠。
1 材料与方法
1.1 实验材料
TPB/SA-RFP/PLA(PLGA、PCL) 复合体制备:称取质量百分比浓度为1 mg/mL 的SA 10 g,浓度为0.2%的RFP 5 g,氯化钙10 g,TPB 50 mg(10 mm×5 mm×5 mm) 加入到500 mL PBS(pH 7.4) 溶液中混合静止,48 h 后将该混合物取出晾干,然后加入到500 mL 浓度为5 mg/mL 的氯化钙水溶液中1 min,即可制得TPB/SA-RFP 抗结核药物微球复合体。然后将TPB/SA-RFP 抗结核药物微球复合体和质量百分比浓度为5%的PLA、PLGA 或PCL 浸入500 mL的氯仿溶液中2 h,最后将其取出烘干,挥发除去溶剂,即可得到实验材料。
1.2 实验方法
1.2.1 TPB/SA-RFP/PLA(PLGA、PCL) 复合体MTT 细胞毒性的测定
制备实验用浸提液。以MC-3T3 为实验细胞,分别测定阴性对照组(单纯TPB) 、阳性对照组(RFP 直接给药) 、实验组[TPB/SA-RFP/PLA(PLGA、PCL) 复合体]对MC-3T3 的毒性。用α-MEM 培养基在37℃、5% CO2环境下按材料表面积/溶液量(cm2/mL) =2.0(ISO 标准:0.5~6.0 cm2/mL) 的比例对各组材料进行浸提72 h,之后收集原始浸提液,然后用0.2 μm的微孔滤膜过滤除菌。以α-MEM 培养基作为稀释液,将浸提液按比例逐步稀释至实验所需浓度(RFP 浓度) ,作为实验用浸提液。各组RFP 浓度为:阴性对照组不含RFP;阳性对照组RFP 浓度有3 种,10 μg/mL、20 μg/mL 和40 μg/mL;实验组3 种材料所含RFP 浓度均为1 mg/mL。
培养MC-3T3-E1 细胞(以上各组细胞培养制备过程相同) 。在50 mL α-MEM 培养液中培养MC-3T3-E1 细胞,待细胞长成单层后传代,弃去培养液,加入0.25%的胰酶消化液,在37℃消化1~2 min,加入少量的α-MEM 培养液,反复吹打,使细胞分散均匀,制成细胞悬液,种植到96 孔板中培养24 h后移除培养基备用。
测量吸光度,计算细胞存活率。取50 μL 实验用浸提液及50 μL 的α-MEM 培养基加入MC-3T3-E1 细胞作为a 组;取100 μL 的α-MEM 培养基不加入浸提液及细胞作为b 组; 取100 μL 的α-MEM 培养基不加入浸提液直接加入MC-3T3-E1 细胞作为c组。本步骤中的3 组在37℃、5%CO2条件下培养7 d后,每孔加入20 μL的MTT 试剂,反应4 h 后每孔加入100 μL DMSO,反应10 min 后置入到酶标仪中,在490 nm 波长下检测每孔的吸光度(A) ,每个标本重复6 次。计算活细胞的存活率(survival rate,SR) ,SR=(Aa-Ab) /(Ac-Ab) ×100%。最后转化为相应的细胞毒性等级,标准为:0 级为≥100%;1 级为≥75%且<100%; 2 级为≥50%且<75%; 3 级为≥25%且<50%;4 级为>0%且<25%;5 级为≤0%。
1.2.2 致敏实验
选择健康成年豚鼠19 只,其中实验组9 只,阴性、阳性对照组各5 只,体重300~360 g。事先将1 g复合材料于生理盐水中浸提72 h(37℃) ,获材料浸液备用。实验组在每只动物两侧肩胛骨内缘处皮内注射浸取液0.1 mL; 阴性对照组注射生理盐水0.1 mL;阳性对照组注射2%二硝基氟苯0.1 mL。于注射完成即刻、注射后24 h、48 h 和72 h 观察皮肤反应(见表1) 。阳性反应的动物数>30%判定受试物为变态反应阳性。
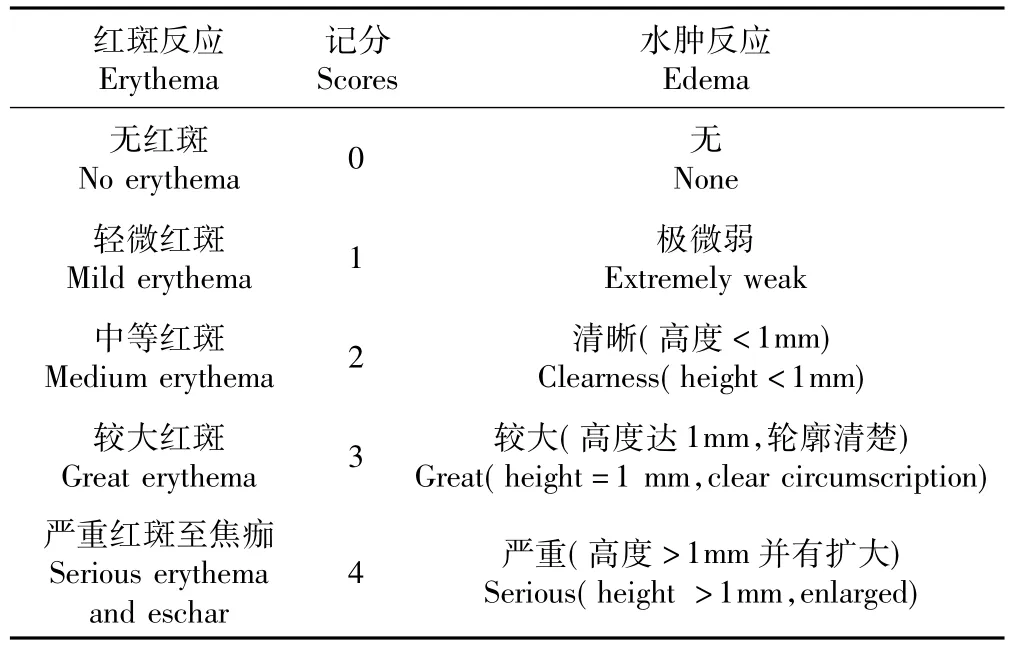
表1 皮肤反应分类标准Tab.1 Skin reaction classification criteria
1.2.3 原发性皮肤刺激实验
选择健康新西兰兔6 只,雌雄各3 只,体重2.0~2.5 kg。实验前于兔脊柱两侧各选2 个面积为3 cm×3 cm 的备皮区(共12 片,6 片实验组,3 片阳性对照组,3 片阴性对照组) ,间距10 cm。实验前24 h 用8%的硫化钠溶液脱毛。事先将1 g 复合材料制备成浸提液(同致敏实验) 。滤纸充分吸附复合材料的浸提液至饱和,贴敷于消毒后的实验部位;使用生理盐水浸提后作为阴性对照;3.5%甲醛溶液作为阳性对照。固定贴敷24 h 后,移去贴敷物,用温水清洁贴敷区并吸干,观察移去贴敷物后24 h、48 h和72 h 皮肤的红斑及水肿情况。计算原发刺激指数(primary stimulus index,PSI) ,参考表1 进行记分并评价。具体方法为:PSI =(24 h、48 h 和72 h 的红斑、水肿总分) /注射点总数。<0.5 分为无刺激;≥0.5 且<2.0 分为轻度刺激;≥2.0 且<5.0分为中度刺激; >5.0 且≤8.0 分为强刺激。
1.2.4 皮内刺激实验
采用健康新西兰兔4 只,雌雄各2 只,体重2.0~2.5 kg。事先将1g 复合材料复合材料制备成浸提液(同致敏实验) 。实验前24 h 用8%的硫化钠溶液将兔脊柱两侧各5 cm×25 cm 区域脱毛。实验动物脊柱两侧旁开2.5 cm 纵线上各取10 个皮内注射点,每点间距2 cm。一侧注射复合材料浸提液0.2 mL,另一侧注射生理盐水0.2 mL 作为对照。注射后即刻、24 h、48 h 和72 h 观察局部及周围皮肤组织反应,并按表1 所列标准进行记分,再根据记分结果推算PSI 和平均原发刺激指数(average primary stimulus index,APSI) ,APSI =所有动物PSI 总和/动物数。
1.2.5 急性全身毒性实验
采用健康小鼠16 只,雌雄各8 只,体重为150~200 g。将动物随机分为实验材料组和对照组,每组8 只。实验组动物由尾静脉注射复合材料生理盐水浸提液(制备过程同致敏实验) ,剂量为50 mL/kg。对照组动物由尾静脉注射的生理盐水,剂量为50 mL/kg。于注射后24 h、48 h 和72 h 观察所有动物的一般情况、中毒表现和死亡数量,并作记录。实验组和对照组小鼠如出现中毒表现则根据其症状程度记为无中毒、轻度中毒(轻度异常,但无运动减少、呼吸困难或腹部刺激症状) 、明显中毒(有腹部刺激症、运动减少、呼吸困难、眼睑下垂、腹泻等,体重通常下降至15~17 g) 、重度中毒(严重腹部刺激症状、发绀、震颤、衰竭、眼睑下垂、呼吸困难等,体重减轻至<15g) 和死亡。根据观察结果作出评价。
2 结 果
2.1 MTT 细胞毒性实验
MTT 细胞毒性实验结果见图1。阴性对照组7 d内的生存率为100%,阳性对照组7 d 内细胞存活率明显比实验组要低,其中PLA 为最佳的涂层材料。各浸提液浓度下,各样品组分别与阴性对照组两两比较差异均无统计学意义(P >0.05) 。细胞毒性等级:阴性对照组0 级; 实验组1 级; 阳性对照组1 级。

图1 MTT 细胞毒性实验结果Fig.1 MTT cytotoxicity results
2.2 致敏实验
3 组通过观察动物在历经皮内诱导、局部诱导和全身激发3 个阶段后,实验组动物皮肤反应与阴性对照组相同,未见动物出现过敏反应;阳性对照组动物全部出现过敏反应。
2.3 原发性皮肤刺激实验
TPB/SA-RFP/PLA(PLGA、PCL) 复合体浸提液贴敷家兔皮肤未见红斑,无水肿形成,说明该材料对家兔皮肤无刺激性(见表2) 。

表2 原发性皮肤刺激实验结果Tab.2 Primary skin irritation test results
2.4 皮内刺激实验
TPB/SA-RFP/PLA(PLGA、PCL) 复合材料的浸取液背部皮内注射后,在24 h、48 h 和72 h 均未发现局部出现严重皮内反应,基本为无红斑或微弱红斑,少数有微弱水肿。对各个时间段结果进行记分,计算出PSI(见表3) ,并计算出APSI 为0.40。
2.5 急性全身毒性实验
TPB/SA-RFP/PLA(PLGA、PCL) 复合材料的浸取液经小鼠尾静脉注射后24 h、48 h、72 h 进行观察,实验动物一般活动良好,生命体征正常,无急性反应甚至死亡等发生(见表4) 。延长观察时间至2周,小鼠未见明显异常。对照组小鼠同样无不良反应出现。

表3 皮内刺激实验结果Tab.3 Intracutaneous reactivity test results

表4 急性全身毒性实验结果Tab.4 Acute systemic toxicity test results
3 讨 论
SA 是一种具有药物制剂辅料所需的稳定性、溶解性、粘性和安全性的天然有机高分子化合物,能够作为释放和包埋RFP 等药物的载体,并被证实安全有效[2]。PLA、PLGA 及PCL 是典型的合成类可完全降解的高分子有机材料,其降解速度还与组织细胞的生长速度相适应,而且降解产物可参加体内循环,最终以CO2和水的形式排出体外,对机体和环境无害,因此具有可靠的生物安全性,并且其具有良好的生物力学性能及易于加工成形等优点,目前已广泛用于生物医用材料中[3]。本研究将上述材料复合加工并载入抗结核药物RFP,制作成交联可调式抗结核药物缓释型纳米人工骨TPB/SA-RFP/PLA(PLGA、PCL) 复合体,其呈多孔结构、大小均匀、排列有序,有较低的结晶度,在体内更易降解,该材料具有更好的化学稳定性。考虑人工骨复合材料属于置入性生物材料,在体内存留时间长,所用材料的安全性如何,是否对人体具有毒性、致癌致病性、致畸性或其他潜在危害,是必须关注的问题。一种医用材料在正式投入生物体研究或临床应用前,必须依照国家有关标准[4],对其进行生物安全性评价。
生物安全性评价包括体外测试和体内实验。前者一般是以材料的浸提液为对象,测试其对组织细胞增殖、生长、分化等活动的影响,以MTT 细胞毒性实验为代表[5]。这一方法被广泛应用于细胞增殖和细胞毒性的检测,目前己成为生物材料和医疗器械生物评价体系中最重要的指标之一,它能在短期内检出受试品对细胞新陈代谢的影响,对毒性物质有较高的敏感性。体内实验包括致敏实验、原发性皮肤刺激实验、皮内刺激实验、急性全身毒性实验等,其中原发性皮肤刺激、皮内刺激实验可评价复合材料中可滤过性物质的毒性作用。由于生物材料中许多杂质对免疫系统的干扰剂量常低于其中毒剂量,这些实验在杂质含量低、中毒症状不出现之前就可以诱出免疫反应症状。致敏实验用于评价复合材料中是否具有潜在过敏原。急性全身毒性实验是常选的生物学性能测试方法之一,国际标准化组织和我国国家标准[4-5](GB16175) 都规定了相应的实验方法。
本实验研究结果表明实验组7 d 生存率较阴性对照组稍低,但明显高于阳性对照组,由此可以得出TPB/SA-RFP/PLA(PLGA、PCL) 复合体具有良好的的生物相容性,说明复合材料中除RFP 外的主体物质及辅料(如固化液等) 成分无毒性,并且通过材料合成后甚至能够降低RFP 所产生的毒性。体内实验结果表明本实验材料无毒性,无致敏性。
因此,交联可调式抗结核药物缓释型纳米人工骨TPB/SA-RFP/PLA(PLGA、PCL) 无MTT 细胞毒性,细胞相容性良好,并能够降低RFP 直接给药的生物毒性,不引起全身毒性反应、皮肤/皮内刺激反应和急性过敏反应。
[1]伍卫刚,郑启新,郭晓冬.利福平-异烟肼-控释型载药人工骨的实验研究[J].中国生物医学工程学报,2010,1(1) :137-143.
[2]肖海军,薛锋,何志敏,等.纳米羟基磷灰石/羧甲基壳聚糖-海藻酸钠复合骨水泥的性能[J].中国组织工程研究与临床康复,2011,15(38) :7113-7117.
[3]季航宇,潘功茂,谢友扬,等.影像学测量锁骨与周围血管毗邻关系:置钉的安全区和危险区[J].中国组织工程研究,2012,16(9) :1593-1596.
[4]中国标准出版社第一编辑室.GB/T16175-1996 医用有机硅材料生物学评价试验方法[M].北京:中国标准出版社,2003:9-16.
[5]Srivastava S,Gorham SD,Courtney JM.Screening of in vitro cytotoxicity by the adhesive film test[J].Biomaterials,1990,11(2) :133-137.