黄芪甲苷的抗氧化性对缺氧缺糖H9c2细胞的保护作用探讨
承燕,吕磊,江时森
(南京大学医学院临床学院,南京军区南京总医院心内科,江苏南京 210002)
黄芪甲苷(AST-Ⅳ)是传统中药黄芪的主要成分。有关AST-Ⅳ减轻心肌缺氧作用机制的研究[1-4]均强调其抗氧化能力的重要性。但AST-Ⅳ的抗氧化性在其治疗效果中究竟起多大作用还有待进一步研究。本实验以耗氧剂连二亚硫酸钠(Na2S2O4)配制的无糖DMEM溶液处理H9c2细胞作为缺氧模型,以水溶性维生素E(Trolox)作为阳性对照,通过检测细胞内氧化应激状态和细胞存活、凋亡、死亡等情况,探索AST-Ⅳ的抗氧化性对缺氧细胞保护的能力。
1 材料与方法
1.1 细胞、药物与试剂
H9c2细胞(ATCC细胞库),高糖 DMEM、无糖DMEM、胎牛血清、胰蛋白酶(Gibco公司),青霉素、链霉素(博士德),Na2S2O4(>99%,无锡市亚盛化工有限公司),AST-Ⅳ标准品(>98%,中国药品生物制品鉴定所),RIPA裂解液、BCA蛋白浓度测定试剂盒(碧云天),丙二醛(MDA)、乳酸脱氢酶(LDH)试剂盒(南京建成生物研究所),细胞增殖/毒性检测试剂-8(CCK-8,日本同仁化学研究所),Trolox、DCFH-DA(Sigma-Aldrich公司);annexin V/PI细胞凋亡试剂盒(Invitrogen)。
1.2 仪器
净化工作台(AIRTECH VS-1300),CO2培养箱(NAPCO 5410),低温离心机(eppendorf centrifuge 5417R),荧光显微镜(OLYMPUS IX71-F22FL/PH),酶标仪(Bio-RAD,Model 680),紫外可见分光光度计(日立U-3010),流式细胞仪(BD FACSCalibur)。
1.3 方法
1.3.1 细胞培养 H9c2细胞用含10%胎牛血清、100 U·ml-1青霉素、0.1 mg·ml-1链霉素的高糖 DMEM培养液按1×104cm-2接种于培养瓶中,置于37℃、体积分数为5%的CO2饱和湿度培养箱培养。当细胞生长至90%时传代。
1.3.2 细胞缺糖缺氧模型及药物处理 当细胞进入对数生长期时,弃培养液,PBS洗涤2遍,换上Na2S2O4无糖 DMEM 溶液(10 mmol·L-1,pH7.2,现配),37 ℃细胞培养箱内孵育3 h后PBS洗涤2遍,换上完全培养液继续培养20 h。Na2S2O4溶液孵育3 h后取细胞上清液作血气分析,氧分压始终低于15 mmHg(1 mmHg=0.133 kPa)。AST-Ⅳ(60 μmol·L-1)和Trolox(50 μmol·L-1)预处理在 Na2S2O4损伤前 1 h 进行,同时药物处理贯穿整个缺氧、复氧过程。细胞按处理方法不同分为4组:(1)对照组,未作处理;(2)模型组,予缺氧处理;(3)AST-Ⅳ预处理组,缺氧处理前1 h 予以不同浓度(6.7、20、60、400 μmol·L-1)AST-Ⅳ预处理;(4)Trolox预处理组,缺氧处理前1 h予以50 μmol·L-1Trolox 预处理。
1.3.3 细胞匀浆的制备 收集细胞,RIPA裂解液冰上裂解细胞30 min,反复冻融3次后,4℃、12 000×g、离心10 min,收集上清,BCA法测蛋白浓度。
1.3.4 细胞活性检测 损伤处理后复氧2 h,用CCK-8测细胞活性。该试剂中的WST-8可被细胞中的脱氢酶还原为高度水溶性的黄色甲臜染料,其生成数量与细胞数量成正比。每次实验每组3个样本,实验重复3次。
1.3.5 LDH检测 根据试剂盒说明测细胞上清和细胞内的 LDH,LDH漏出率 =上清 LDH/总 LDH×100%。每次实验每组3个样本,实验重复3次。
1.3.6 MDA检测 根据试剂盒说明,用硫代巴比妥酸法测细胞匀浆中的MDA。每次实验每组3个样本,实验重复3次。
1.3.7 细胞内氧自由基(ROS)检测 当细胞融合度达70%左右进行实验。
流式细胞仪检测:损伤处理后收集细胞,用终浓度为 20 μmol·L-1的 DCFH2-DA 溶液(高糖 DMEM 稀释)重悬并调整细胞浓度为1×106ml-1。37℃细胞培养箱内避光孵育15 min,每5 min颠倒混匀一下。PBS洗涤3次后检测荧光强度。实验重复5次。
荧光显微镜观察:损伤处理后用PBS洗涤细胞2次。加入终浓度为 5 μmol·L-1的 DCFH2-DA 溶液,37℃细胞培养箱内避光孵育15 min。用PBS洗涤3次,荧光显微镜下观察。
1.3.8 凋亡检测 收集细胞,调整细胞浓度至1×106ml-1,冷PBS洗涤后用结合缓冲液重悬,加FITC-annexinⅤ和PI室温避光染色15 min,流式检测凋亡情况。左下象限(annexinⅤ-,PI-)代表活细胞,右下象限(annexinⅤ+,PI-)代表早期凋亡细胞,右上象限(annexinⅤ+,PI+)代表死亡细胞。
1.3.9 统计学处理 用SPSS 17软件进行统计学分析。数据以±s表示,组间差异用单因素方差分析和S-N-K法进行比较,P<0.05为差异有统计学意义。
2 结 果
2.1 AST-Ⅳ对细胞活力的影响
如图1所示,经无糖Na2S2O4溶液损伤处理后,细胞存活率显著下降(P < 0.01)。20 μmol·L-1和60 μmol·L-1的 AST-Ⅳ能明显改善细胞存活率(P <0.01),但 400 μmol·L-1却不能。

图1 不同浓度AST-Ⅳ对Na2S2O4损伤H9c2细胞存活率的影响Fig 1 Effects of different concentrations of AST-Ⅳon survival of H9c2 cells subjected to Na2S2O4
2.2 细胞内的氧化应激情况
与对照组相比,模型组细胞内ROS和MDA的含量显著增加。当损伤前以 60 μmol·L-1的 AST-Ⅳ或50 μmol·L-1的 Trolox 预处理时,这两项氧化应激指标能降至接近对照组,两种药物效果相近(图2)。荧光显微镜下各组细胞内ROS含量的差异与流式细胞仪检测结果类似。Trolox预处理组的细胞形态更接近对照组,而AST-Ⅳ预处理组则更偏向于模型组(图3)。
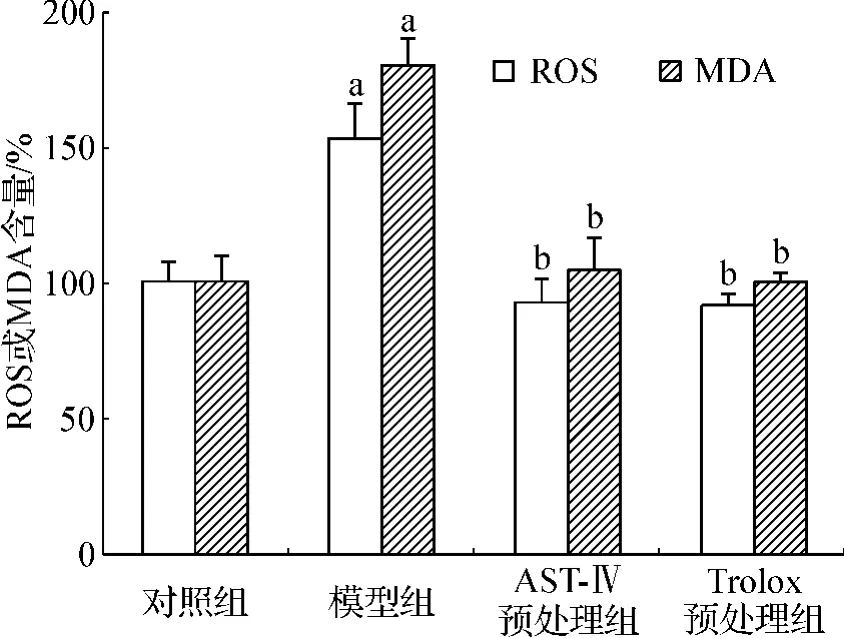
图2 AST-Ⅳ或Trolox对Na2S2O4损伤H9c2细胞内ROS和MDA的影响Fig 2 Effects of AST-Ⅳor Trolox on intracellular ROS and MDA production in H9c2 cells subjected to Na2S2O4
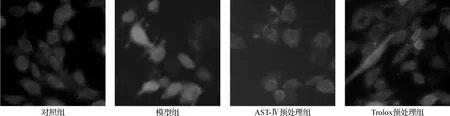
图3 AST-Ⅳ或Trolox对Na2S2O4损伤H9c2细胞内ROS的影响 荧光显微镜 ×400Fig 3 Effect of AST-Ⅳor Trolox on intracellular ROS in H9c2 cells subjected to Na2S2O4 microscopy images ×400
2.3 细胞存活率和LDH释放率
CCK-8的检测结果(图4)显示,模型组的细胞存活率较对照组显著下降,而经药物预处理组存活率则较模型组有明显改善。但AST-Ⅳ预处理组的存活率低于Trolox预处理组。
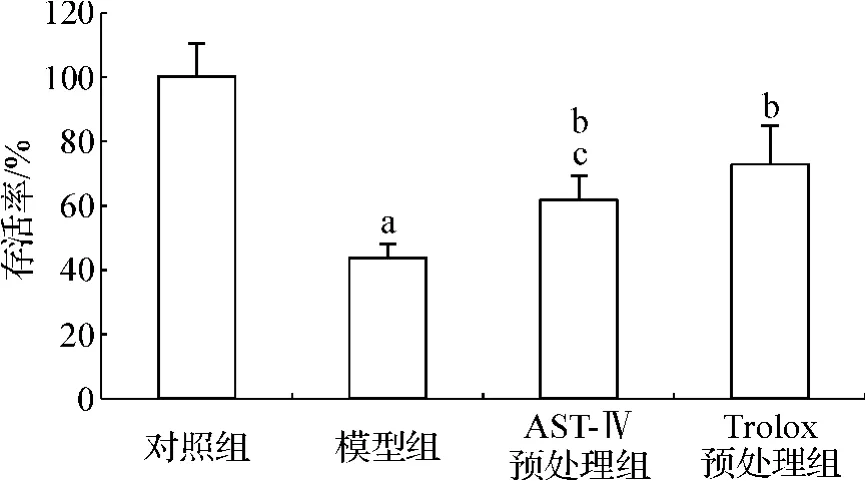
图4 AST-Ⅳ或Trolox对Na2S2O4损伤H9c2细胞存活率的影响Fig 4 Effect of AST-Ⅳor Trolox on survival of H9c2 cells subjected to Na2S2O4
LDH主要由坏死细胞释放入细胞培养液。图5显示,模型组LDH释放率明显高于对照组。而药物预处理组LDH释放率较模型组均有下降,且Trolox预处理组明显比AST-Ⅳ预处理组下降得多。
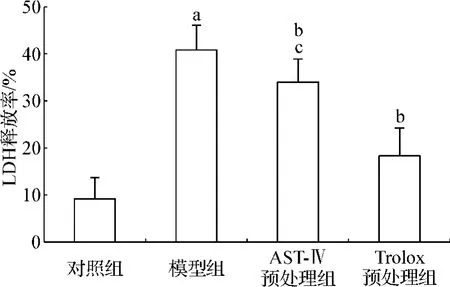
图5 AST-Ⅳ或Trolox对Na2S2O4损伤H9c2细胞LDH释放率的影响Fig 5 Effect of AST-Ⅳor Trolox on the release of cellular LDH into culture medium of H9c2 cells subjected to Na2S2O4
2.4 细胞凋亡
如图6所示,FITC-annexin V和PI双染的流式细胞仪检测结果显示,模型组的细胞凋亡率(27.42%)较对照组(1.5%)显著升高。药物预处理组的细胞凋亡率较模型组均有下降,且Trolox预处理组(7.36%)比AST-Ⅳ预处理组(17.86%)下降更明显。
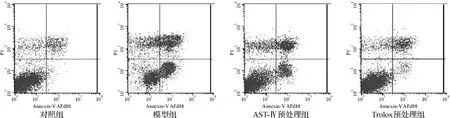
图6 AST-Ⅳ或Trolox对Na2S2O4损伤H9c2细胞凋亡的影响Fig 6 Effect of AST-Ⅳor Trolox on apoptosis of H9c2 cells subjected to Na2S2O4
3 讨 论
AST-Ⅳ是传统中药黄芪的一种重要活性成分。随着提取工艺的完善和成熟,20世纪90年代末人们开始了对AST-Ⅳ这种单体成分的生物学研究。研究所涉范围甚广,体现了AST-Ⅳ在循环、免疫、神经、内分泌等系统多方面的保护作用。
2002 年 Li等[5]在 Acta Pharmacol Sin 上发表的AST-Ⅳ对心肌缺血小鼠心脏功能和心肌钙离子转运的影响一文揭开了研究AST-Ⅳ对心肌缺血保护作用的序幕,提出AST-Ⅳ减轻心肌细胞内钙超载是其改善缺血心肌功能的主要机制。Xu等[6]随后发现,缺氧再复氧后心肌细胞肌浆网Ca2+-ATP酶的表达和活性均下降,而AST-Ⅳ能改善这种情况,支持了AST-Ⅳ能减轻钙超载的观点。
与此同时,AST-Ⅳ抗自由基的能力备受关注。一方面,AST-Ⅳ在体外直接清除自由基的能力值得肯定,甚至有人提出,以此特性为标准来鉴定和评价黄芪[7]。另一方面,AST-Ⅳ无论在缺血再灌注的心肌还是在体外缺氧复氧的心肌细胞中均能提高SOD的活力,降低 MDA 的生成。胡炯宇等[1,4]认为,黄芪甲苷在细胞内的抗氧化作用可通过上调SOD的表达和活性来实现。
ROS和Ca2+都是信号传导中的重要信使,它们不仅相互作用,彼此影响,而且能调节很多信号通路,控制细胞存亡。AST-Ⅳ减轻细胞缺氧损伤的作用主要是通过哪条途径实现还不能确定[8]。鉴于ROS在细胞病理生理中的重要作用,我们想要探索AST-Ⅳ清除ROS的能力在保护缺氧细胞中能否体现出显著效果。
我们用无糖Na2S2O4造成缺氧环境。在复氧前,血气分析显示缺氧液的氧分压始终低于15 mmHg。此外,在OH-存在条件下,Na2S2O4溶液可生成超氧阴离子(O·-2),对细胞造成一定损伤,但O·-2不能通过细胞膜自由扩散。H9c2细胞在10 mmol·L-1的无糖Na2S2O4溶液中孵育3 h后,存活率显著下降,LDH漏出增加,损伤明显。
我们采用DCFH2-DA测定细胞内ROS的浓度,并检测MDA评价细胞脂质过氧化程度,发现60 μmol·L-1的 AST-Ⅳ和 50 μmol·L-1的 Trolox 在此损伤模型中表现出相同的抗氧化能力。DCFH2-DA能自由扩散进入细胞膜和线粒体膜,在细胞内脂肪酶作用下水解成不能自由透过细胞膜的DCFH2,在ROS作用下生成强荧光的DCF,故可检测细胞内ROS的浓度。MDA为自由基作用于脂质的终产物,反映脂质过氧化程度。
我们又通过 CCK-8检测细胞存活率、FITC-annexinⅤ/PI染色检测细胞凋亡率、LDH释放率观察细胞坏死情况,结果发现,抗氧化能力相同的AST-Ⅳ和Trolox对损伤细胞的保护作用存在明显差异,AST-Ⅳ不如 Trolox 有效。60 μmol·L-1的 AST-Ⅳ预处理后,损伤细胞中的ROS和MDA浓度确实有很明显的下降,体现了AST-Ⅳ抗氧化的作用。AST-Ⅳ对细胞存活的保护效果与Trolox存在显著性差异,提示:(1)细胞总体的氧化应激状态并不能准确提示细胞状态;(2)AST-Ⅳ和Trolox的抗氧化机制可能不同,其差异可能由以下两方面原因造成,一是在直接清除自由基时,AST-Ⅳ和Trolox所清除的自由基类型和部位不尽相同,二是除直接清除自由基外,AST-Ⅳ参与了其他调控自由基的途径,如SOD和Ca2+等,而且这些间接途径可能起着更重要的作用。
另外,实验中特高浓度的 AST-Ⅳ(400 μmol·L-1)并没有表现出对缺氧H9c2细胞的保护作用,提示要关注AST-Ⅳ的治疗窗。大剂量与小剂量的AST-Ⅳ可能在作用机制上也存在差别。
总而言之,虽然AST-Ⅳ能够降低无糖Na2S2O4损伤的H9c2细胞的氧化应激,但其抗氧化性在改善细胞存活率以及凋亡、坏死情况上效果有限。AST-Ⅳ在细胞内作用于哪些自由基,对自由基产生的影响等均需要明确。另外,本实验的结果提示AST-Ⅳ抗氧化之外的作用,它很可能在AST-Ⅳ抗缺氧复氧中起了更重要的作用。一些研究证实其干预了抗氧化之外的信号通路,如对 Ca2+、NF-κB 等的调节[2,9]。这些非抗氧化途径是否起了主要作用需要进一步明确。
致谢 本实验中流式细胞仪上机操作由南京军区南京总医院中心实验室研究生周鑫同学完成,特此感谢。
[1]HU J Y,HAN J,CHU Z G,et al.Astragaloside Ⅳ attenuates hypoxia-induced cardiomyocyte damage in rats by upregulating superoxide dismutase-1 levels[J].Clin Exp Pharmacol Physiol,2009,36(4):351-357.
[2]关凤英,李红,杨世杰.黄芪甲苷诱导NO生成并激活PKCε对大鼠心肌缺血再灌注损伤的保护作用[J].吉林大学学报:医学版,2010,36(2):340-344.
[3]ZHANG W D,CHEN H,ZHANG C,et al.Astragaloside Ⅳfrom Astragalus membranaceus shows cardioprotection during myocardial ischemia in vivo and in vitro[J].Planta Med,2006,72(1):4-8.
[4]胡炯宇,黄跃生,张琼,等.黄芪甲苷减轻缺氧心肌细胞氧化损伤的机制研究[J].中国烧伤杂志,2007,23(3):175-178.
[5]LI Z P,CAO Q.Effects of astragaloside Ⅳ on myocardial calcium transport and cardiac function in ischemic rats[J].Acta Pharmacol Sin,2002,23(10):898-904.
[6]XU X L,CHEN X J,JI H,et al.Astragaloside Ⅳ improved intracellular calcium handling in hypoxia-reoxygenated cardiomyocytes via the sarcoplasmic reticulum Ca-ATPase[J].Pharmacology,2008,81(4):325-332.
[7]夏之宁,庞媛,郑国灿.基于毛细管电泳的黄芪抗氧化生物指纹图谱研究[J].分析化学,2008,36(12):1646-1650.
[8]承燕,江时森.黄芪甲苷对心血管保护功能的研究进展[J].医学研究生学报,2011,24(6):637-640.
[9]杨国富,刘革新,董果雄,等.黄芪甲苷对缺氧/复氧损伤人脐静脉内皮细胞与中性粒细胞黏附能力及细胞核转录因子κb表达的影响[J].中国组织工程研究与临床康复,2008,12(15):2843-2846.

