TaqMan探针实时定量PCR检测肉中单增李斯特菌的研究
邵美丽,刘思国,赵燕丽,孔保华
(1.东北农业大学食品学院,哈尔滨 150030;2.中国农业科学院哈尔滨兽医研究所动物细菌病研究室,哈尔滨 150001)
作为四大食源性致病菌之一,单增李斯特菌(Listeria monocytogenes,LM)是食品安全部门重点监管对象之一[1],其对肉、奶、蛋、水产品及蔬菜等均有不同程度污染[2],以肉及肉制品污染最严重[3]。故建立肉中单增李斯特菌快速、准确、定量、可靠的检测方法尤为重要。目前肉制品中常见致病菌检测方法操作繁琐、费时费力、灵敏度较低、特异性较差、易产生假阳性且不能准确定量,无法不能满足当今肉品行业发展需求。TaqMan探针实时荧光定量PCR方法具有PCR技术高效性、探针技术高特异性、光谱技术的高敏感性和高精确性等优点,可弥补传统检测方法的不足[4-5]。本研究旨在以单增李斯特菌hlyA基因为对象,建立肉中单增李斯特菌的TaqMan探针实时定量PCR检测方法,以期为提高肉制品监管效率和水平,预防食物中毒和食源性疾病发生奠定基础。
1 材料与方法
1.1 菌种和生肉样品
单增李斯特菌标准株(CMCC54001,CMCC-54002,CMCC54005,CM54006,CM54007),大肠杆菌标准株(ATCC25922),沙门氏菌标准株(CMCC-5217)、志贺氏菌标准株(CMCC51570),结核杆菌标准株(ATCC25177),猪链球菌标准株(ATCC-49619),金黄色葡萄球菌标准株(ATCC259235),均由东北农业大学食品学院提供。新鲜猪肉购于黑龙江省哈尔滨市家乐福超市。
1.2 试剂和仪器
Premix ExTaqTM(Perfect Real time)、梯度PCR仪(宝生物工程大连有限公司);细菌基因组DNA(小量)抽提试剂盒(上海华舜生物技术有限公司);Mx3005P荧光定量PCR仪(吉泰生物科技有限公司)。
1.3 引物和探针
根据GenBank收录的单增李斯特菌的溶血素hlyA基因(AF253320)的保守区域,用Primer Exp ress2.0软件设计引物'(预期扩增片段长度为106 bp)和特异性探针,探针5'端标记FAM,3'标记Eclipse。具体序列为LM-F 5'GGGAAATCTGTCTCA GGTGATGT 3';LM-R 5'CGATGATTTGAACTTCAT CTTTTGC 3';LM-P 5'CAAAAATTCTTCCTTCAAA GCCGTAATTTACGG 3'。
1.4 细菌基因组DNA的提取
取纯培养菌液1 mL,用细菌基因组DNA(小量)抽提试剂盒提取单增李斯特菌基因组DNA,并利用OD260/OD280比值来确定DNA的纯度。
1.5 阳性质粒标准品的制备
以单增李斯特菌基因组DNA为模板,PCR扩增目的片段,将其克隆于pMD18-T中,并将重组质粒转化至E.coli DH5α感受态细胞,提取质粒进行PCR和测序验证,并用紫外分光光度计进行浓度和纯度的分析后,作为荧光定量PCR的质粒标准品,于-20℃保存备用。
1.6 反应体系和反应条件的建立
以质粒标准品为模板,在梯度PCR仪上对退火温度(51~63℃)进行优化,确定最佳引物退火温度。在Mx3005P荧光定量PCR仪上按照以下反应体系和反应条件进行荧光定量PCR扩增。反应体系:Premix ExTaqTM12.5 μL,正、反向引物(10 μmol·L-1)各0.5 μL,荧光探针溶液(3 μmol·L-1)1.0 μL,ROX Reference DyeⅡ(50×)0.5 μL,模板2.0 μL,用灭菌去离子水补至25 μL。反应条件:94℃预变性30 S,94℃变性5 S,56°C退火20 S,72℃延伸15 S,40个循环。退火延伸时检测荧光信号。
1.7 特异性检测
用细菌基因组DNA(小量)抽提试剂盒分别提取5株单增李斯特菌标准株,1株大肠杆菌标准株,1株沙门氏菌标准株,1株志贺氏菌标准株,1株结核杆菌标准株,1株猪链球菌标准株和1株金黄色葡萄球菌标准株基因组作模板,按照1.6反应体系和反应条件进行荧光定量PCR扩增,验证该方法特异性。
1.8 标准曲线的建立及敏感度确定
将已知浓度的重组质粒标准品进行10倍梯度稀释,使终浓度分别为1.95×106、1.95×105、1.95×104、1.95×103、1.95×102、1.95×101和1.95×100copies·μL-1,按照1.6的反应体系和反应条件进行荧光定量PCR扩增,制作标准曲线,并确定其敏感度。
1.9 人工染菌肉样中单增李斯特菌最低检出限确定
取新鲜无菌的肉样25 g加入225 mL灭菌生理盐水,匀浆。以匀浆液作为稀释液对过夜培养的单增李斯特菌菌液进行10倍梯度稀释,使菌终浓度依次为2.8×106~2.8×100cfu·mL-1。然后按照细菌基因组DNA抽提试剂盒提取人工染菌肉样中菌体基因组作为模板进行荧光定量PCR扩增,以确定人工染菌肉样中单增李斯特菌的最低检出限。
2 结果与分析
2.1 退火温度的优化结果
以单增李斯特菌的基因组为模板,在退火温度51~63℃之间对目的片段进行扩增,琼脂糖凝胶电泳分析结果显示,在不同退火温度下均扩增出约106 bp的片段,与预期大小一致,但在56.2℃时扩增效果最好,所以后续试验选取56℃作为最佳退火温度,具体见图1。
2.2 荧光定量PCR特异性检测结果
荧光定量PCR特异性检测结果如图2所示,5株单增李斯特菌均产生扩增曲线,且循环阈值均小于35。而其它6株非单增李斯特菌及去离子水空白对照均不能产生扩增曲线。

图1 退火温度的优化Fig.1 Optimization of the annealing temperature
2.3 荧光定量PCR标准曲线及敏感性检测结果
以10倍梯度稀释的标准质粒为模板,以水代替模板作为阴性对照,进行定量扩增,所得扩增曲线和标准曲线分别如图3和图4所示。可知,循环阈值(Ct值)和初始细胞数的对数具有良好的相关性,相关系数为 0.998,线性方程为 Y=3.281×log(X)+36.84。且在质粒浓度为19.5 copies·μL-1时仍有扩增曲线,Ct值小于35,表明该方法敏感度为1.95×101copies·μL-1。
2.4 人工染菌肉样的定量检测结果
以10倍梯度稀释人工染菌肉样为模板,以水代替模板为阴性对照,进行定量扩增,所得扩增曲线和标准曲线分别见图5、6。

图2 荧光定量PCR特异性分析Fig.2 Speficity analysis of the real-time PCR

图3 10倍梯度稀释阳性质粒的荧光定量PCR扩增曲线Fig.3 Real-time PCR amplifacation curve of serial 10-fold dilutions of positive recombinant plasmids

图4 10倍梯度稀释阳性质粒荧光定量PCR的标准曲线Fig.4 Real-time PCR standard curve of serial 10-fold dilutions of positive recombinant plasmids

图5 10倍梯度稀释人工染菌肉样的荧光定量PCR扩增曲线Fig.5 Real-time PCR amplifacation curve of serial 10-fold dilutions of artificially inoculated meat samples
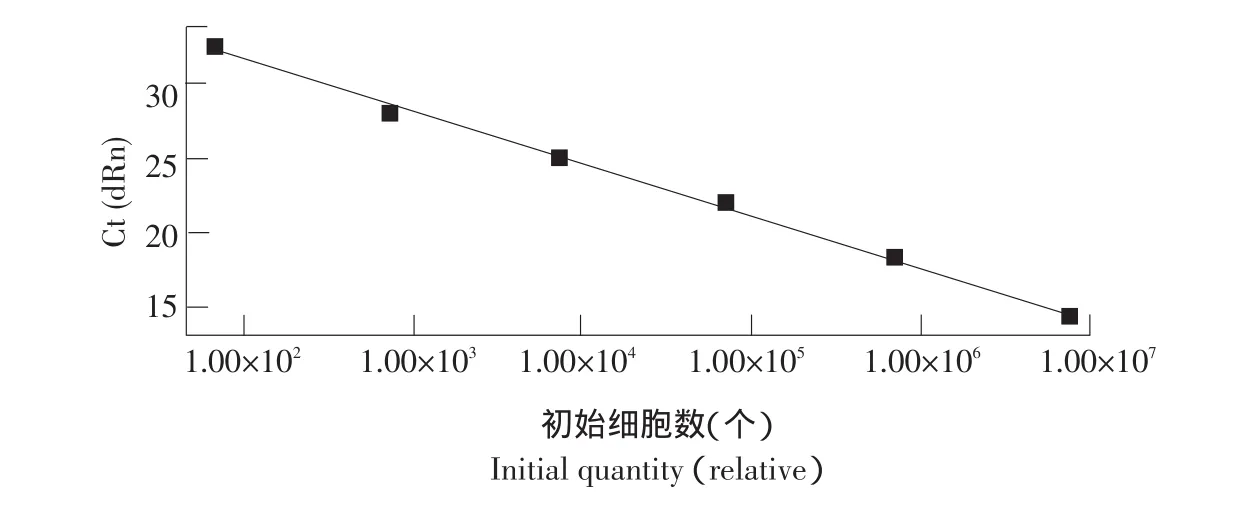
图6 10倍梯度稀释人工染菌肉样的荧光定量PCR标准曲线Fig.6 Real-time PCR standard curve of serial 10-fold dilutions of artificially inoculated meat samples
循环阈值(Ct值)和初始细胞数的对数具有良好的相关性,相关系数为0.996,线性方程Y=3.540×log(X)+38.83。且在人工染菌肉样中单增李斯特菌浓度为2.8×101cfu·mL-1时仍有扩增曲线,且Ct值小于35,表明该方法敏感度为2.8×101cfu·mL-1。
3 讨论和结论
单增李斯特菌在自然界分布广泛,对各类食品尤其是肉类食品污染较为严重。而鲜肉类食品在市场的广泛流通,会进一步扩大该菌对其他食品污染范围,加剧该菌引发食物中毒的潜在威胁。因此建立一种特异性好、敏感性高且能够定量的检测方法对于加强肉类食品中单增李斯特菌的监控、监管意义重大。
TaqMan探针荧光定量PCR法是指在PCR反应体系中加入一特异性寡核苷酸荧光探针。探针的5'端和3'端分别标记一个荧光基团(FAM)和荧光淬灭基团(TAMRA)。当探针完整时,由于两个基团之间很近,发生能量传递,荧光基团不产生荧光。而当引物结合到模板时,激活了Taq聚合酶的5'端外切酶活性,荧光基团和淬灭基团分离,两个基团之间的能量传递作用遭到破坏,从而发出荧光。荧光量和PCR产物的数量成正比。因此,通过PCR反应液的荧光强度可推算出初始模板数量,达到定量目的[6]。该法实现了PCR从定性到定量的飞跃,与常规PCR相比,能有效解决PCR污染问题、自动化程度高。故本研究建立一种适合于肉中单增李斯特菌的TaqMan探针荧光定量PCR检测方法。
选择合适的靶基因是成功建立荧光定量PCR检测方法的前提。单增李斯特菌的靶基因主要为hly、prfA、inl、actA和iap基因等。actA和iap基因序列上具有较高的多态性,给探针设计带来一定难度,且容易导致假阴性[7]。hlyA基因具有种特异性,且hly基因高度保守,是致病性李斯特菌的毒力标志基因[8]。本研究选取hlyA基因作为扩增靶基因。在探针设计上,选择荧光本底信号较低的Eclipse非荧光淬灭基团代替常用的TAMRA荧光淬灭基团作为3'端标记基团[9],这些均为提高本检测方法特异性和敏感性奠定基础。
本研究所设计引物和探针定量PCR扩增5株单增李斯特菌,均产生扩增曲线。定量扩增其他6种非单增李斯特菌均未产生扩增曲线,证实本方法高度特异性。通过对阳性重组质粒进行荧光定量PCR扩增,建立相关性良好(R2=0.998)标准曲线,敏感度高达19.5copies·μL-1。进一步将所建立的方法应用到人工染菌肉样中,建立标准曲线,最低检出限为2.8×102cfu·g-1。该检出限低于Kalliopi等以16S和23S rRNA基因间隔区为靶基因建立TaqMan探针荧光定量PCR法对鲜肉中单增李斯特菌104cfu·g-1检出限[10]。但由于该方法未经过增菌或菌落富集过程,故其检出限高于Peter等建立经过菌落富集TaqMan探针荧光定量PCR法。
本研究利用人工染菌肉样初步验证TaqMan探针荧光定量PCR检测方法可行性,进一步验证该方法实用性提供指导意义和参考价值。为后期肉中单增李斯特菌TaqMan探针荧光定量PCR检测试剂盒研制奠定基础。
[1]Ryster T,Ejmer H M.Listeriosis and food safety[J].Marcel Dekkeinc,1991,6(2):214-216.
[2]Berrada H,Soriano J M,Pico Y,et al.Quantification of Listeria monocytogenes in salads by real-time PCR[J].International Journal of Food Microbiol,2006,107:202-206.
[3]张晓焱,王梅周,映霞.多重PCR技术检测肉品中致病菌的应用研究[J].肉类研究,2009(7):47-49.
[4]Zou Y W,Feng Z C,Hu B,et al.Detection ofmdr1 gene by real-time fluorescence quantitative polymerase chain reaction using TaqMan-MGB probe[J].Journal of Southern Medical University,2006,26(4):466-468.
[5]Rantsiou K,Alessandria V,Urso R,et al.Detection,quantification and vitality of Listeria monocytogenes in food as determined by quantitative PCR[J].International Journal of Food Microbiology,2008,121:99-105.
[6]蔡潭溪,蒋鲁岩,黄克和.用基于TaqMan探针的Real-time PCR技术定量检测副溶血弧菌[J].微生物学报,2005,45(4):638-641.
[7]Vazpuez-boland J A,Kuhn M,Berche P,et al.Listeria pathogenesis and molecular virulence determinants[J].Clinical Microbiology Reviws,2001,14:584-640.
[8]张辉,王兴龙.食品中单核细胞增生性李斯特氏菌PCR快速检测[J].食品科学,2008,29(4):324-327.
[9]Elizaquivel P,Aznar R.A multiplex RTi-PCR reaction for simultaneous detection of Escherichia coli O157:H7,Salmonella spp.and Staphylococcus aureus on fresh,minimally processed vegetables[J].Food Microbiology,2008,25:705-713.
[10]Kalliopi R,Valentina A,Rosalinda U,et al.Detection,quantification and vitality of Listeria monocytogenes in food as determined by quantitative PCR[J].International Journal of Food Microbiology,2008,121:99-105.
[10]Peter R,Martina K,Martin W.Detection of Listeria monocytogenes in food using a combined enrichment/real-time PCR method targeting the prfA gene[J].Research in Microbiology,2006,157:763-771.

