SEC2在莱茵衣藻中的表达及免疫学活性分析
李建成,彭世清,胡章立
1)海南大学农学院,海口570228;2)深圳大学生命科学学院,深圳市海洋生物资源与生态环境重点实验室,深圳518060;3)中国热带农业科学院热带生物技术研究所,农业部热带作物生物技术重点开放实验室,海口571101
超抗原 (superantigen)是一类可与抗原呈递细胞 (antigen presenting cell,APC)上主要组织相容性复合物II(major histocompatibility complex class II,MHCII)和 T淋巴细胞受体 (T cell receptor,TCR)的Vβ区结合而刺激T细胞活化增殖的抗原[1].金黄色葡萄球菌 (Staphylococcus aureus,S.aureus)肠毒素 C2(staphylococcal enterotoxin C2,SEC2)是一种外源性超抗原,仅需微量 (ng级)就能产生强烈的免疫应答,刺激非特异性T细胞大量增殖,提高机体免疫能力[2].然而,微量的SEC2即可引起人体及动物多种组织和器官的损伤[3-4],严重制约了SEC2在抗肿瘤生物制剂和动物免疫增强剂等方面的应用.Wright A等[5]发现,SEC2基因的第118位组氨酸 (Histidine,His)是重要的毒素位点,与其催吐机制密切相关.为获得既具有超抗原特性,又不会严重损伤机体组织器官的减毒肠毒素C2,本研究通过对sec2基因序列进行定点突变,获得具有超抗原性的sec2t基因.
莱茵衣藻是一种单细胞真核绿藻,生长迅速,光合效率高,且遗传背景清晰,是目前少数3套基因组 (细胞核、叶绿体和线粒体)都能进行遗传转化的生物[6].由于莱茵衣藻蛋白质和糖类等营养物质含量高且不产生内毒素,作为可食性疫苗生物载体具有重要意义.本研究将sec2t基因转入莱茵衣藻,并分析转基因莱茵衣藻Tran-sec2t的免疫学特性,为进一步利用转基因藻生产抗肿瘤制剂和动物免疫增强剂奠定基础.
1 实验方法
1.1 材料和试剂
大肠杆菌(Escherichia coli,E.coli)Top10、质粒pH124(含ble基因,可使宿主细胞具有腐草霉素和Zeomycin抗性),野生型莱茵衣藻均由本实验室保存.克隆载体PMD18-T simple购自宝生物工程(大连)有限公司.分泌SEC2的金黄色葡萄球菌标准株由深圳市疾病预防控制中心惠赠.Balb/c小鼠购自广东省医学实验动物中心.测序工作由北京六合华大基因科技股份有限公司完成.限制性内切酶HindⅢ、NheⅠ、PmacⅠ 和 T4连接酶均购自 MBI Fermentas.点突变试剂盒 (Mutaan BEST kit)和DNA聚合酶LA Taq均购自宝生物工程 (大连)有限公司.
1.2 引物设计与合成
根据Genbank已知的金黄色葡萄球菌SEC2基因登录号 (Genbank登录号AY450554)分别设计点突变及克隆所需特异性引物:P1:5'-AAGTTATGTATGTAGATAAATTTTTGGCACATG-3',P2:5'-TAGTTGCTGATACATAATGATCATCATATAAAT-3';C1:5'-CATGCTAGCGAGAGTCAACCACCAGACCCTACGCCAG-3',C2:5'-CGCACGTGTTATCCATTCTTTGTTGTAAGGTGG-3'.
1.3 克隆金黄色葡萄球菌sec2基因
利用试剂盒(Takara mini BEST bacterial genomic DNA extraction kit ver.2.0)提取金黄色葡萄球菌标准株总DNA,以C1和C2为引物,进行PCR扩增(反应体系为:反应酶 LA Taq 0.5 μL、10×LA PCR 缓冲液5 μL、dNTP Mixture 8 μL、模板基因组DNA 1 μL、引物C1和 C2各0.5 μL,补水至总体积50 μL).PCR反应条件为:94℃预变性5 min;94℃反应30 s,55℃反应30 s,72℃反应1min,30个循环;72℃延伸5 min.PCR反应产物进行琼脂糖凝胶电泳 (琼脂糖质量浓度为10 g/L),并将电泳片段利用胶回收试剂盒(Takara agarose gel DNApurification kit ver.2.0)切胶回收.回收产物与T载体在16℃水浴条件下连接过夜,然后转入E.coli Top10中,再将转化菌液涂抹在有氨苄抗性的LB平板上,培养12~16 h后,将生长良好的单克隆接种于含氨苄抗性的LB液体培养基中,培养过夜.采用十二烷基磺酸钠(sodium dodecyl sulfate,SDS)碱裂解法提取质粒,并对质粒进行PCR和酶切鉴定.
1.4 金黄色葡萄球菌SEC基因的定点突变
以sec2基因为模板,P1和P2为引物,采用点突变试剂盒 (Mutaan BEST kit)进行PCR扩增.扩增产物经平末端处理后,连接并转入感受态细胞E.coli Top10中,挑取阳性克隆进行验证,同时送北京六合华大基因科技股份有限公司测序.
1.5 构建含sec2t基因的莱茵衣藻表达载体
将突变成功且已连接到T载体上的sec2t基因和pH124载体同时用NheⅠ和PmacⅠ酶切,然后进行切胶回收,得sec2t基因片段和线性化的pH124载体,将两者的回收产物用T4连接酶连接,并转入E.coli Top10中,挑取阳性克隆进行PCR和酶切鉴定.
1.6 莱茵衣藻的遗传转化
采用“珠磨法”进行莱茵衣藻遗传转化.具体方法如下:①将细胞壁缺陷性莱茵衣藻CC-849接种于新鲜TAP培养基中,连续光照条件下培养至对数生长期 (细胞浓度为1×106~2×106/mL);室温条件下5 000 r/min离心6 min,弃上清,收集藻细胞;②用新鲜无菌的TAP培养液重悬沉淀,调整藻细胞浓度至2×108/mL.取悬浮液300 μL于1.5 mL的EP管中 (含灭菌的玻璃珠);③将目的DNA酶切成线状,加入EP管中,快速振荡25 s,使玻璃珠、藻株和外源DNA充分混匀;④将混合液转移到50 mL已灭菌的培养管中,加入10 mL无菌新鲜TAP培养液,100 r/min摇床培养过夜,使细胞恢复;⑤室温离心,去上清,收集藻液,用0.8 mL TAP培养液轻轻重悬,加入3.5 mL TAP培养基(琼脂糖质量浓度为5 g/L),均匀涂布在TAP平板上 (含Zeomycin抗生素),静置30 min后,转移至22°C光照培养箱中倒置培养3~4周,平板上长出的绿色单克隆即为转基因莱茵衣藻.
1.7 转基因莱茵衣藻的分子检测
1.7.1 PCR和RT-PCR分析
将获得的转基因莱茵衣藻接种于新鲜TAP培养基中,光照培养至对数生长期,使用Takara universal genomic DNA extraction kit ver.3.0提取总DNA,以提取的总DNA为模板进行PCR扩增;采用反转录试剂盒 (Takara prime scrip RT reagent kit with gDNA eraser)对转基因莱茵衣藻总RNA进行RT-PCR扩增.PCR和RT-PCR引物均为C1和C2.PCR反应体系为:Premix Ex Taq 10 μL、引物C1和C2各0.5 μL、模板 1 μL,补水至总体积 20 μL.PCR 反应条件为:97℃预变性5 min;94℃反应30 s,60℃反应30 s,72℃反应1 min,30个循环;72℃延伸5 min.反应后取5 μL产物进行琼脂糖凝胶电泳(琼脂糖质量浓度为10 g/L)检测.
1.7.2 转基因莱茵衣藻Southern blot分析
步骤如下:①提取转基因莱茵衣藻总DNA,取10 μg至1.5 mL的EP管中,并加入适量的限制性内切酶HindⅢ,37℃酶切过夜;②用Takara DNA fragment purification kit ver.2.0回收DNA片段;③用琼脂糖凝胶电泳 (琼脂糖质量浓度为8 g/L)分离后,将DNA片段转移到尼龙膜上,后与sec2基因探针杂交检测,探针是用DIG high prime DNA labeling and detection starter kitⅠ标记后的set2基因(720 bp).
1.7.3 转基因莱茵衣藻Western blot分析
以SEC2单克隆抗体为一抗、碱性磷酸酶标记的羊抗小鼠IgG为二抗进行免疫印迹,检测转基因莱茵衣藻SEC2蛋白质的表达.具体方法如下:①提取转基因莱茵衣藻总蛋白,取10 μg进行SDSPAGE电泳;②将凝胶上的蛋白质转移到NC膜上,4℃条件下,置于20 mL封闭液 (由BSA和TBST混合液组成,BSA体积分数为3%)中过夜;③取出NC膜,按1∶1 000用封闭液稀释一抗,37℃杂交箱中杂交1 h;④用TBST洗膜3次,每次10 min,然后按1∶1 000用TBST稀释二抗,杂交2 h;⑤用TBST洗膜3次,每次10 min;⑥将膜置于暗处,加入适量的碱性磷酸酶底物 (BCIP和NBT)显色.
1.8 转基因莱茵衣藻的免疫活性检测
1.8.1 小鼠脾脏细胞制备
取6周龄清洁级雄性Balb/c小鼠,分3组,每组8只,分别喂食转基因莱茵衣藻、野生型莱茵衣藻CC-849和无菌生理盐水,连续喂养1个月,期间每隔1 d用针头灌胃器罐注上述相应液体2 mL.喂养成熟后断颈处死小鼠,浸泡于体积分数为75%的乙醇中.无菌条件下取出小鼠脾脏,用无菌注射器柄碾碎,经200目尼龙网过滤后,将分离液迅速转移到15 mL离心管中,覆盖500 μL的RPMI-1640细胞培养基 (保持液面分界明显),在室温下以2 400 r/min离心30 min(设置较慢的加速和减速程序);吸出淋巴细胞层,再加入10 mL RPMI-1640培养基,颠倒洗涤;在室温下以1 000 r/min离心10 min收集细胞.
1.8.2 CD4和CD8T淋巴细胞亚群的测定
取制备好的小鼠脾脏细胞,分别加入抗小鼠FITC-CD3e、FITC-CD8a和 FITC-CD4单克隆抗体,室温条件下暗室孵育10 min,用PBS缓冲液洗去多余抗体,再用流式细胞仪测定细胞荧光,并进行数据分析.
2 结果与分析
2.1 超抗原SEC2基因的克隆与定点突变
以分泌SEC2的金黄色葡萄球菌标准株总基因组DNA为模板,C1和C2为引物进行PCR,所得产物经琼脂糖凝胶电泳 (琼脂糖质量浓度为10 g/L)分析,结果如图1.由图1可见,在720 bp处有疑似目的基因条带.序列分析证实,该片段为超抗原sec2基因片段,与Genbank已知的金黄色葡萄球菌sec2基因 (Genbank登录号AY450554)序列一致.

图1 金黄色葡萄球菌sec2基因PCR产物Fig.1 PCR products of enterotoxin C2 gene in Staphylococcal aureus
以连接在T载体上的sec2基因为模板,P1和P2为引物进行PCR介导的sec2基因点突变.经六合华大基因科技股份有限公司测序,证明超抗原sec2基因第118位组氨酸密码子已突变为酪氨酸密码子.
2.2 莱茵衣藻表达载体pH124sec2t的构建与遗传转化
将sec2t基因插入含Hsp70A-RBCS2启动子和RBCS2终止子的pH124载体,通过酶切鉴定和序列分析,证明莱茵衣藻表达载体pH124sec2t构建成功.通过“珠磨法”将表达载体pH124sec2t转入细胞壁缺陷型莱茵衣藻 CC-849中,在含10 μg/mL Zeomycin的TAP平板上培养3~4周后,获得大量的阳性转化子.对转化子进行PCR和RT-PCR分析,均获得720 bp的片段,见图2,初步验证筛选到转基因莱茵衣藻Tran-sec2t.

图2 转基因莱茵衣藻Tran-sec2t的PCR和RT-PCR分析结果Fig.2 PCR and RT-PCR results of Tran-sec2t in Chlamydomonas reinhardtii
2.3 转基因莱茵衣藻的Southern blot分析
提取转基因莱茵衣藻Tran-sec2t总DNA,用内切酶HindⅢ酶切过夜,经琼脂糖凝胶电泳 (琼脂糖质量浓度为8 g/L)分离后,转移至带正电荷的阳性尼龙膜,使用地高辛标记的SEC2探针进行杂交,结果如图3.由图2可见,在1 515~1 482 bp、6106~4 899 bp间均有一条带,而阴性对照莱茵衣藻CC-849中无相应条带出现,说明sec2t基因已成功整合到莱茵衣藻中,且在转基因莱茵衣藻Tran-sec2t中有两个拷贝.
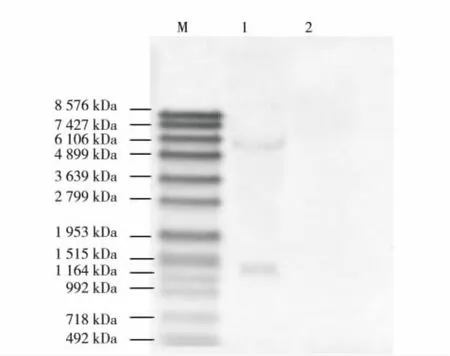
图3 转基因莱茵衣藻Tran-sec2t的Southern blot分析结果Fig.3 Southern blot results of Tran-sec2t in Chlamydomonas reinhardtii
2.4 转基因莱茵衣藻Tran-sec2t的Western blot分析
提取转基因莱茵衣藻Tran-sec2t和野生型莱茵衣藻CC-849的总蛋白,进行SDS-PAGE蛋白电泳(丙烯酰胺质量浓度为120 g/L),上样量10 μg,然后转移至NC膜上,以SEC2单克隆抗体为一抗、碱性磷酸酶标记的羊抗小鼠IgG为二抗进行免疫杂交反应.转基因莱茵衣藻与阳性对照所出现的杂交条带相对分子质量大小一致,且阴性对照 (莱茵衣藻CC-849)总蛋白中无相应大小的条带,表明sec2t基因已在转基因莱茵衣藻中正常表达,如图4.
2.5 转基因莱茵衣藻Tran-sec2t的免疫学活性
利用流式细胞仪对喂食不同藻细胞培养液的Balb/c小鼠CD4+和CD8+淋巴细胞亚群进行检测分析,结果见表1.由表1可见,喂食转基因莱茵衣藻Tran-sec2t小鼠的CD4+与CD8+细胞数目比值有所降低,但CD3+和CD8+细胞明显增殖.CD4+细胞数目下降的原因可能是由于CD8+细胞的大量增殖抑制了CD4+细胞的克隆.由此可知,表达减毒超抗原SEC2的转基因莱茵衣藻能刺激小鼠T淋巴细胞的大量增殖,从而提高小鼠的机体免疫应答.
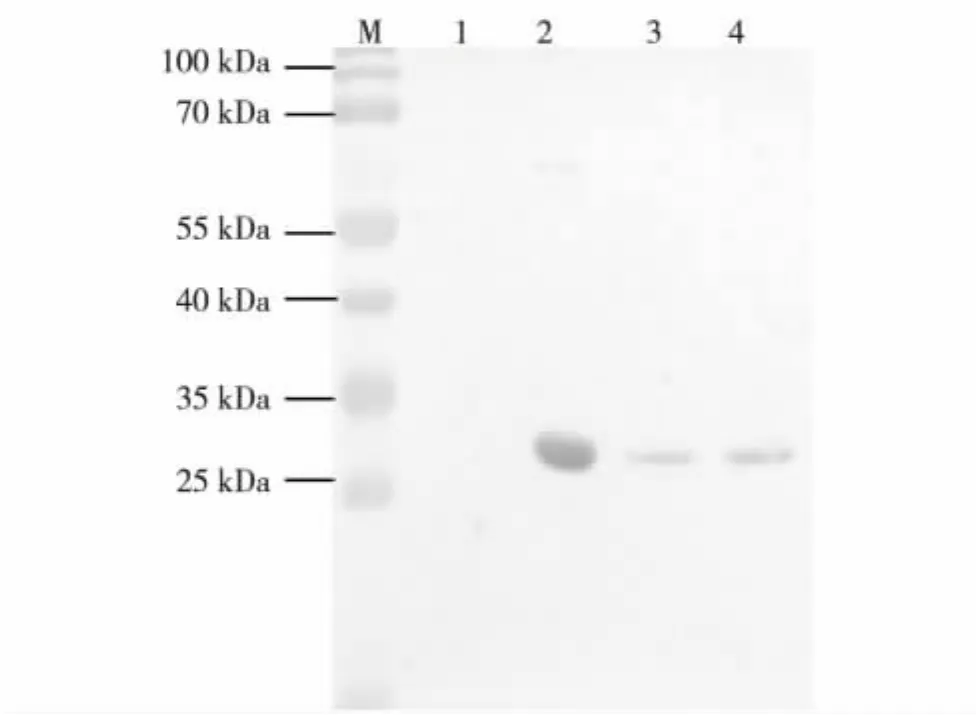
图4 转基因莱茵衣藻Tran-sec2t的Western blot分析结果Fig.4 Western blot results of Tran-sec2t in Chlamydomonas reinhardtii
表1 流式细胞仪测定不同处理组别小鼠T淋巴细胞亚群变化情况(±s)Table 1 The variations of T lymphocyte subsets of mouse in different groups(±s)单位:%
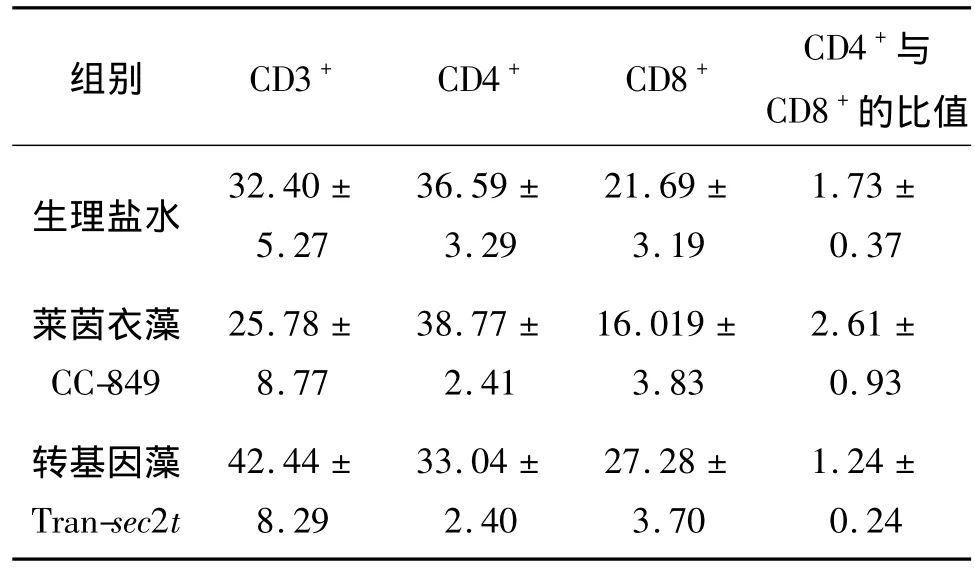
表1 流式细胞仪测定不同处理组别小鼠T淋巴细胞亚群变化情况(±s)Table 1 The variations of T lymphocyte subsets of mouse in different groups(±s)单位:%
组别 CD3+ CD4+ CD8+ CD4+与CD8+的比值1.73 ±生理盐水0.37莱茵衣藻CC-849 32.40 ±5.27 36.59 ±3.29 21.69 ±3.19 2.61 ±0.93转基因藻Tran-sec2t 25.78 ±8.77 38.77 ±2.41 16.019 ±3.83 42.44 ±8.29 33.04 ±2.40 27.28 ±3.70 1.24 ±0.24
3 讨论
在可食性药物和可饲用动物疫苗基因工程表达体系中,莱茵衣藻表达体系比哺乳动物细胞和高等植物系统更具优势:一方面由于莱茵衣藻营养丰富且不产生内毒素,自身就是理想的保健食品和动物饲料;另一方面由于其生长速度快且光合效率高,既具有微生物的生长特性又具有高等植物自养优势,生产成本低.Mayfield等[7]用莱茵衣藻叶绿体偏爱密码子,合成人类抗单纯疱疹病毒糖蛋白D抗体大单链基因(HAV8-lsc),并在莱茵衣藻叶绿体表达,该基因表达产物的积累量占可溶性蛋白总量的0.5%,且具有抗体活性.Sun等[8]将口蹄疫病毒(foot-and-mouth disease virus,FMDV)VP1基因与霍乱毒素B亚基 (cholera toxin B subunit,CTB)基因融合,转入莱茵衣藻叶绿体基因组,使CTBVP1融合蛋白在莱茵衣藻中成功表达,表达量占可溶性蛋白总量的3%,该融合蛋白既保留了GM1-神经节苷脂亲和力又具有FMDV VP1抗原性,证明了在莱茵衣藻生产黏膜疫苗 (mucosal vaccine)的可行性.本研究将金黄色葡萄球菌sec2t基因转入莱茵衣藻细胞核基因组,获得能通过热激和强光诱导表达SEC2蛋白的转基因莱茵衣藻,动物免疫实验证明转基因莱茵衣藻表达的SEC2蛋白具有超抗原特性,诱导动物CD8+细胞淋巴细胞的大量增殖 (表1).尽管莱茵衣藻核表达系统在表达外源基因时的效率较低[9],但由于 SEC2蛋白是超抗原,只需微量(ng级)就可产生强烈的免疫应答,从而激活非特异性T淋巴细胞[10].因此,转基因莱茵衣藻Transec2t在可食性肿瘤治疗药物和可饲性动物疫苗免疫增强剂领域具有重要应用价值.
SEC2作为细菌超抗原无需抗原递呈细胞加工,直接结合MHC II分子外侧,激活带有特异T细胞受体 (TCR)T淋巴细胞大量增殖[1],而T淋巴细胞是重要的免疫细胞,在自身的炎症反应中起重要作用.本研究发现,喂食转基因莱茵衣藻Tran-sec2t的小鼠CD3+细胞数量大大增加,说明小鼠机体免疫应答的增强;而CD8+细胞作为参与抗肿瘤作用的主要效应细胞,其数目的增加表明sec2t具有抑制肿瘤的潜能;另外,转基因莱茵衣藻导致小鼠CD4+与CD8+细胞数目比降低 (表1),说明其对辅助性T淋巴细胞有损害,原因可能是CD8+细胞增加抑制了CD4+增殖.有研究表明[11-12],从小鼠动物模型中分离出来的CD8+T淋巴细胞具有免疫抑制作用,能特异性地下调或杀伤经MBP活化的CD4+T细胞的增殖,并能优先抑制潜在的病理性自身反应性克隆.
/References:
[1]Baker M D,Acharya K R.Superantigens:structure-function relationships[J].International Journal of Medical Microbiology,2004,293(7/8):529-537.
[2]XIA Zhan-qiang.Research progress for the superantigen enterotoxin of Staphylococcus aureus[J].Chinese Practical Medicine,2009,31(4):235-236.(in Chinese)夏占强.超抗原SE-金葡菌肠毒素的研究进展[J].中国实用医药,2009,31(4):235-236.
[3]Baker M D,Papageorgious A C.Titball R W,et al.Structural and functioml role of threonine 112 in a superantigen Staphylococcal aureus enterotoxin B[J].The Journal of Biological Chemistry,2002,277(4):2756-2762.
[4]Liewelyn M,Cohen J.Superantigens:microbial agents that corrupt immunity[J].The Lancet Infectious Disease,2002,2(3):156-162.
[5]Wright A,Anderws P L,Titball R N.Induction of emetic,pyreic and behacioral effects of Staphylococcus aureus enterotoxin B in the ferret[J].Infection and Immunity,2000,68(4):2386-2389.
[6]HU Zhang-li,ZHAO Zhong-lin,WU Zhi-hua,et al.Suc cessful expression of heterologous egfp gene in the mitochondria of a photosynthetic eukaryote Chlamydomonas reinhardtii[J].Mitochondrion,2011,11(5):716-721.
[7]Mayfield S P,Franklin S,Lerner R.Expression and assembly of a fully active antibody in algae[J].Proceedings of the National Academy of Sciences of the United States of America,2003,100(2):438-442.
[8]SUN Meng,QIAN Kai-xian,SU Ning,et al.Foot-andmouth disease virus VP1 protein fused with cholera toxin B subunit expressed in Chlamydomonas reinhardtii chloroplast[J].Biotechnology,2003,25(13):1087-1092.
[9]WANG Chao-gang,HU Zhang-li,LEI An-ping,et al.Biosynthesis of poly-3-hydroxybutyrate(PHB)in transgenic green algae Chlamydomonas reinhardtii[J].Journal of Phycology,2010,46(2):396-402.
[10]Schlievert P M,Shands K N,Dan B B,et al.Role of super-antignes in human disease[J].The Journal of Infectious Diseases,1993,167(5):997.
[11]Madeleine W Cunningham.T cell mimicry in inflammatory heart disease[J].Molecular Immunology,2004,40(14/15):1121-1127.
[12]Krakauer T,Chen X,Howard O M,et al.Triptolide attenuates endotoxin and staphylococcal exotoxin-induced T-cell proliferation and production of cytokines and chemokines[J].Immunopharmacol.Immunotoxicol,2005,27(1):53-66.

