β-葡萄糖苷酶高产菌株的筛选及其基因的克隆与表达
王斌斌,刘逸寒,李 玉,王建玲,路福平
(工业发酵微生物教育部重点实验室(天津科技大学) 工业酶国家工程实验室 天津市工业微生物重点实验室 天津科技大学生物工程学院,天津 300457)
β-葡萄糖苷酶(beta-Glucosedase,EC 3.2.1.21)是纤维素降解酶系的主要组分之一,它能够水解结合于末端非还原性的β-D-葡萄糖苷键,同时释放出β-D-葡萄糖和相应的配基[1],在人类、动物、植物和微生物的糖类代谢方面都具有重要的价值[2]。目前,β-葡萄糖苷酶已经广泛应用于食品、酿酒、医药、化工及粮食加工等领域,可用于改善茶叶、果汁的风味[3],生产低聚龙胆糖[1]、大豆异黄酮活性苷元[4]和天然抗氧化剂多酚化合物[5]等。
虽然植物中广泛存在着β-葡萄糖苷酶,但其含量少、活力低、大规模生产β-葡萄糖苷酶纯化工艺较为复杂,限制了其扩大应用。因此,通过基因重组技术构建工程菌,分泌表达高活性β-葡萄糖苷酶对其实现工业化具有重要意义。Raynal等[6]于1984年从脆壁克鲁维酵母中克隆得到β-葡萄糖苷酶基因,并在大肠杆菌和酿酒酵母中表达,重组菌产酶活力分别达到570 U·mL-1和3660 U·mL-1。2007年Hong等[7]在毕赤酵母中对嗜热子囊菌β-葡萄糖苷酶进行表达,酶活力为0.7 U·mL-1。2009年李丽娟[8]实现黑曲霉GS115β-葡萄糖苷酶基因在毕赤酵母中表达,酶活达到1218 U·mL-1,是出发菌株的33.6倍。迄今为止,已有多种微生物来源的β-葡萄糖苷酶基因被克隆获得并实现异源表达及分泌,但β-葡萄糖苷酶生产菌的相关研究绝大部分集中于真菌[9],而对于细菌β-葡萄糖苷酶鲜有研究。随着β-葡萄糖苷酶在化工以及其它领域的广泛应用,细菌β-葡萄糖苷酶的优势逐渐凸显出来[10,11],碱性和高温的极端环境下真菌来源的酸性β-葡萄糖苷酶活力会急剧下降甚至丧失,而大多数细菌β-葡萄糖苷酶耐碱耐热性能良好。因此,对细菌β-葡萄糖苷酶的研究成为主要发展趋势。
作者从滨海新区盐碱地土壤中分离筛选得到一株高产β-葡萄糖苷酶的短小芽孢杆菌B-4,并成功实现其β-葡萄糖苷酶基因bglB在大肠杆菌中的表达,为下一步该酶的性质研究奠定了基础。
1 实验
1.1 土样来源
土样采自天津滨海新区盐碱地。
1.2 质粒与试剂
E.coliDH5α、E.coliBL21(DE3)、pET-22b(+),自行保存;克隆载体pUCm-T,TaKaRa公司。
Taq DNA聚合酶、限制性内切酶、DNA分子量标准、纯化DNA片段的琼脂糖凝胶回收试剂盒,Takara公司;X-Gal、IPTG、T4连接酶、蛋白质分子量标准,上海生物工程有限公司。引物合成及测序由上海Invitrogen生物公司完成。
1.3 培养基
菌种富集筛选培养基:蛋白胨 1%,牛肉膏 0.3%,NaCl 0.5%,纤维二糖 0.5%,纳他霉素适量,pH值7.4~7.6,121 ℃灭菌20 min。
产酶筛选培养基[12]:栀子苷 1‰,谷氨酸钠 1%,蛋白胨 0.5%,KH2PO41%,MgSO40.05%,琼脂 2%,pH值7.4~7.6,121 ℃灭菌20 min。
产酶发酵培养基[13]:麸皮 4%,(NH4)2SO40.2%,KH2PO40.2%,CaCl20.04%,MgSO4·7H2O 0.04%,121 ℃灭菌20 min。
1.4 产β-葡萄糖苷酶细菌的筛选
1.4.1 初筛
称取1 g土样加入到10 mL无菌水中,于80~90 ℃热水浴中保温10~15 min,37 ℃恒温水浴振荡培养,得到菌悬液;将菌悬液置于装有菌种富集筛选培养基的三角瓶中于37 ℃、180 r·min-1培养2 d;梯度稀释(10~106)[14],涂布于筛选培养基平板上,37 ℃恒温培养18 h,筛选单菌落周围蓝色水解圈颜色较深且与菌落直径比值相对较大的菌落进行复筛。
1.4.2 复筛
将经初筛获得的单菌落接种于装有富集筛选培养基的三角瓶中,于37 ℃、180 r·min-1振荡培养10 h,按1%的接种量接种于产酶发酵培养基中,于37 ℃、180 r·min-1培养48 h。用DNS法测定其酶活,筛选获得β-葡萄糖苷酶高产菌株。
1.5 β-葡萄糖苷酶活性测定
取0.5 mL粗酶液加入到1.5 mL缓冲溶液配制的0.5% PNPG溶液中,于50 ℃水浴15 min;加入1.5 mL DNS,沸水浴5 min;冷却至室温后用蒸馏水稀释至20 mL,在波长540 nm处测定其吸光值(OD540)。
酶活力单位定义为:每小时产生1 mg还原糖所需的酶量,用U·mL-1表示。
1.6 菌株16S rDNA序列的扩增、测定
参照文献[15]进行。所测细菌16S rDNA序列同GenBank数据库相关菌株的16S rDNA序列比对,并进行系统发育树分析。
1.7 引物设计及目的片段的扩增
根据GenBank上已经发表的短小芽孢杆菌SAFR-032β-葡萄糖苷酶基因序列bglB(登录号为YP_001488769.1)设计上游引物:5′-CGCGGATCCATGAGGAGGGCATTCAACATGAACAA-3′(下划线部分为BamHI酶切位点),下游引物:5′-CCG-GAATTCTTATGCATCTAAATGATCACCATTTGTCG-3′(下划线部分为EcoRI酶切位点)。PCR反应体系(50 μL)为:10×Taq缓冲溶液5 μL,模板DNA 1 μL,浓度为10 μmol·L-1的引物各2 μL,dNTPs(2.5 mmol·L-1)4 μL,Taq DNA聚合酶0.3 μL,超纯水35.7 μL,混匀。反应条件:95 ℃ 5 min;94 ℃ 45 s,53 ℃ 45 s,72 ℃ 2 min,32个循环;72 ℃ 10 min。
1.8 bglB基因的克隆及序列分析
将PCR扩增产物纯化后连接到pUCm-T载体上,转化E.coliDH5α感受态细胞。筛选获得含bglB基因阳性克隆,经测序后在NCBI与已有β-葡萄糖苷酶序列进行比对分析。
1.9 重组表达质粒pET-bglB的构建
将上述测序正确的质粒及提取的大肠杆菌表达载体pET-22b(+)分别用BamHI和EcoRI进行双酶切,酶切产物经纯化回收后,用T4连接酶于16 ℃连接过夜,转化E.coliDH5α感受态细胞,氨苄抗性平板筛选转化子,分别用PCR和双酶切法进行鉴定,并挑取阳性转化子进行测序。再将阳性转化子的质粒转入表达宿主菌BL21(DE3)中诱导表达。
1.10 目的蛋白的诱导表达及分析鉴定
将构建好的工程菌BL21/pET-bglB和对照菌BL21/pET-22b(+)分别接种于5 mL带有氨苄抗性的LB液体培养基中,于37 ℃水浴振荡培养过夜,按1%的接种量转接于装有30 mL培养基的250 mL三角瓶中,继续培养至OD600为0.6~0.8时,加入IPTG(终浓度为1 mmol·L-1),20 ℃诱导表达。16 h后,4000 r·min-1冷冻离心收集菌体,将菌体悬于pH值7.0的磷酸缓冲溶液中,冰浴超声。超声波功率为200 W,每超声5 s间隔8 s,共70次。分别取上清和沉淀进行SDS-PAGE(分离胶浓度为10%,浓缩胶浓度为5%),检测蛋白的表达情况。按1.5方法,对重组菌株的酶活力进行测定。
2 结果与讨论
2.1 产β-葡萄糖苷酶菌株的分离
传统产β-葡萄糖苷酶菌株筛选方法主要是在以纤维二糖为唯一碳源的平板上根据透明圈的大小进行筛选,由于纤维二糖价格较为昂贵,进行较大规模筛选成本较高。因栀子苷可被β-葡萄糖苷酶分解生成栀子苷元,而栀子苷元可与谷氨酸钠作用形成蓝色化合物,故可根据产生的蓝色圈来筛选产β-葡萄糖苷酶的菌株。本实验利用栀子苷筛选培养基获得9株具有较高β-葡萄糖苷酶活力的菌株,见表1。
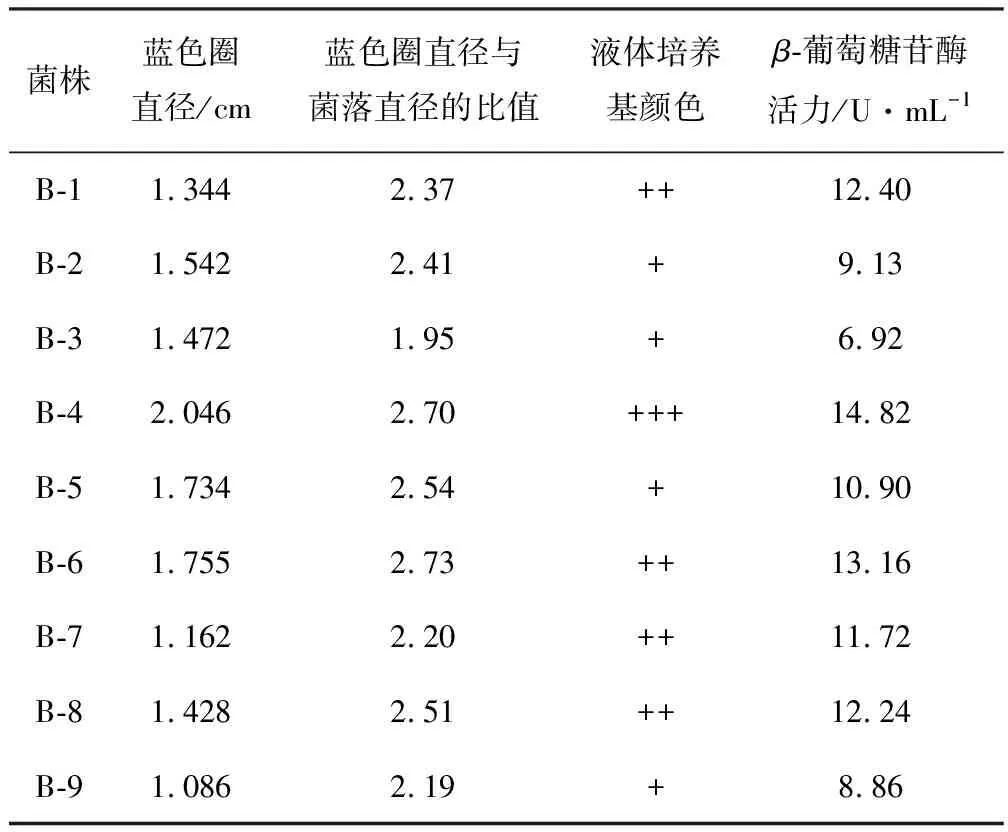
表1 9株具有较高β-葡萄糖苷酶活性的菌株
由表1可以看出,菌株B-4经37 ℃培养后蓝色圈直径与菌落直径的比值最大,且颜色最深,同时其经进一步发酵培养后具有最高的酶活,所以选用B-4作为后续实验出发菌株。
2.2 菌株B-4的形态(图1)、16S rDNA鉴定
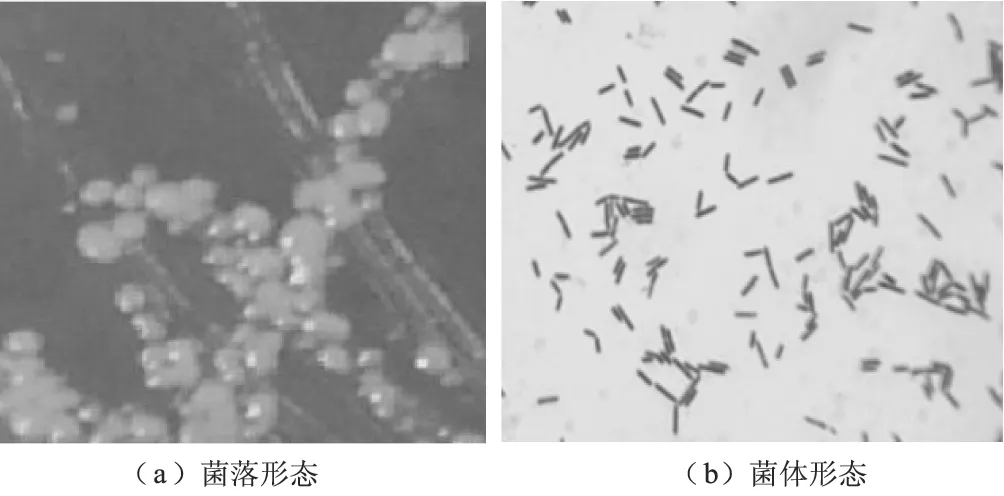
图1 B-4的菌落形态(a)和菌体形态(b)
由图1可以看出,菌落较小,呈乳白色,表面光滑,不透明;菌体呈短杆状,很少成链,大小为(0.6~0.7)μm×(2.0~3.0)μm,具内生芽孢,少有两端生,为革兰氏阳性菌。推测菌株B-4属于芽孢杆菌。
利用NCBI中的BLAST软件对B-4菌株进行16S rDNA序列分析发现,菌株B-4与短小芽孢杆菌(Bacilluspumilus)的同源性为99%。又根据同源序列搜索,并且下载一些相关菌种的16S rDNA序列,利用MEGA 4.0软件来构建系统进化树,进一步探索菌株B-4与短小芽孢杆菌的亲缘关系,见图2。
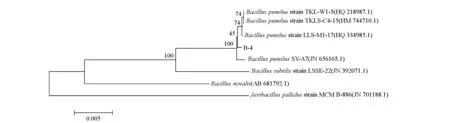
图2 菌株B-4 16S rDNA构建的系统发育树
由图2可以看出,菌株B-4与Bacilluspumilus处于同一分支,进化距离最短,这与BLAST比对的结果一致。
根据形态学、16S rDNA比对分析,可将菌株B-4鉴定为短小芽孢杆菌(Bacilluspumilus)。
2.3 短小芽孢杆菌B-4 β-葡萄糖苷酶基因bglB的获得
利用PCR技术扩增后的产物电泳图如图3所示。
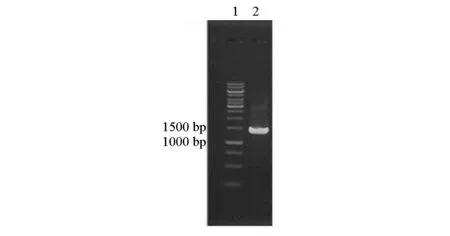
1.DNA标准 2.PCR产物
由图3可以看出,利用PCR技术扩增后,得到1.5 kb左右的产物,片段大小与目的基因bglB相符。
2.4 bglB基因的序列测定与分析
按照1.8方法进行bglB的扩增、连接、验证和测序,其验证结果见图4。
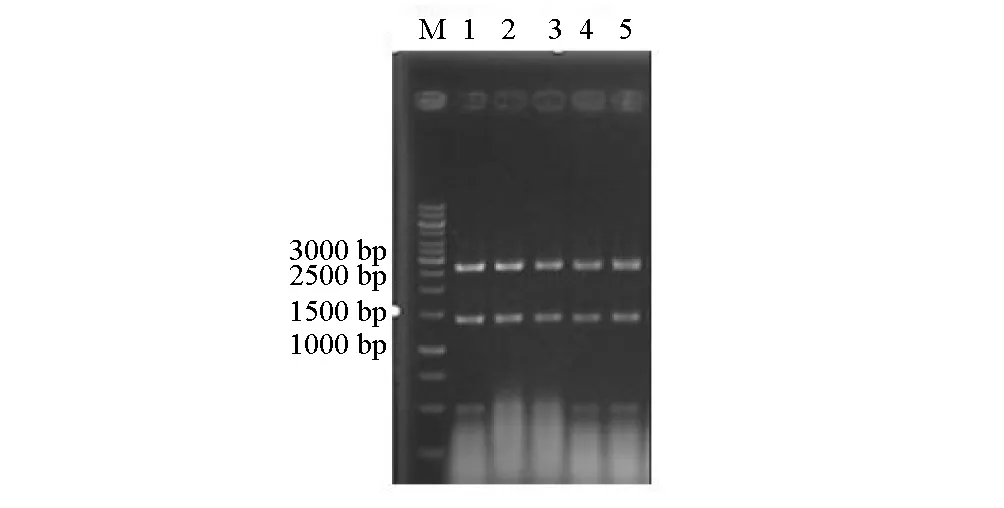
M.分子量标记 1~5.pUCm-T-bglB/Bam HI+Eco RI
序列分析结果表明,所得目的基因片段大小为1437 bp,可编码478个氨基酸,目的蛋白大小预计为52.5 kD。将该基因的核苷酸序列与GenBank中序列进行比对发现,其与短小芽孢杆菌SAFR-032及枯草芽孢杆菌TU-B-10编码的β-葡萄糖苷酶基因(YP_001488769.1、YP_004879524.1)具有较高的同源性,达到97%,其中与短小芽孢杆菌SAFR-032编码基因相比,41个碱基不同,翻译为蛋白质后有6个氨基酸差异,氨基酸同源性达到99%。
2.5 重组菌株BL21/pET-bglB的筛选与鉴定
按照1.9方法构建重组表达质粒pET-bglB,其双酶切验证结果见图5。
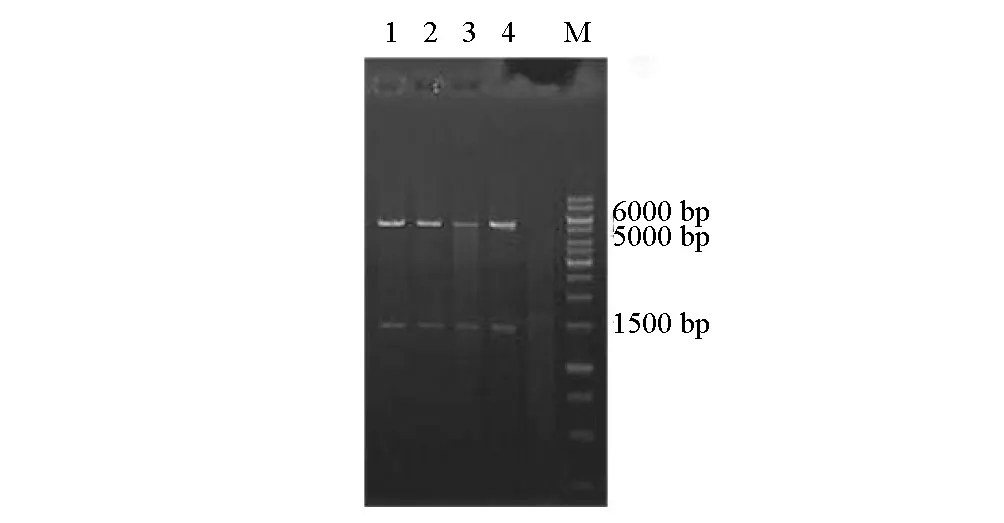
M.分子量标记 1~4.pET-bglB/Bam HI+Eco RI
由图5可以看出,重组质粒经BamHI及EcoRI双酶切后,获得的两个特异性条带大小分别与目的片段bglB及载体pET-22b(+)相符,表明重组菌株BL21/pET-bglB构建成功。
2.6 SDS-PAGE检测
将验证正确的重组质粒转入大肠杆菌BL21(DE3)中,进行诱导表达,以BL21/pET-22b(+)诱导、BL21/pET-bglB未诱导作为对照。分别对超声破碎后的上清液、沉淀和全菌体进行SDS-PAGE分析,结果见图6。
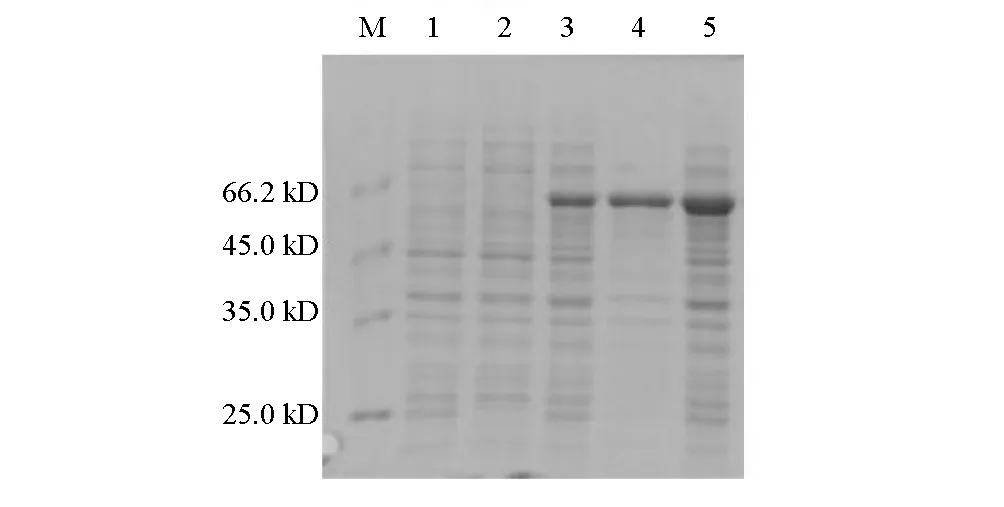
M.分子量标记 1.BL21/pET-bglB未诱导全菌体 2.BL21/pET-22b(+)诱导后全菌体 3.BL21/pET-bglB诱导后上清 4.BL21/pET-bglB诱导后沉淀 5.BL21/pET-bglB诱导后全菌体
由图6可以看出,BL21/pET-bglB的上清、沉淀与全菌体中均发现有相对分子质量约为58 kD的表达蛋白(条带3~5),与理论值略有差异,这是由于pET-22b(+)质粒本身分别带有His标签序列,其编码的蛋白与目的蛋白融合表达的结果。通过Band-scan软件分析得到其表达量占细胞总蛋白的37.3%左右,经超声破碎后,蛋白仍有一部分以包涵体形式存在于沉淀中,上清中有部分蛋白表达。同时,按照1.5方法,测得BL21/pET-bglB超声破碎上清液中β-葡萄糖苷酶BGL的酶活力可达46.85 U·mL-1。
2.7 讨论
目前,由于由植物直接提取β-葡萄糖苷酶存在较多问题,微生物来源的β-葡萄糖苷酶受到广泛重视。虽然微生物来源β-葡萄糖苷酶在许多催化性质上都表现出一定的相似性,但与大部分真菌β-葡萄糖苷酶相比,细菌β-葡萄糖苷酶在最适pH值、等电点等方面均明显不同,其在中性或碱性条件下具有更高的催化活性[16]。因此,从实际应用方面考虑,有必要开发热稳定性好、pH值作用范围宽的β-葡萄糖苷酶。
3 结论
从盐碱地土壤中分离得到一株高产β-葡萄糖苷酶的短小芽孢杆菌B-4。其β-葡萄糖苷酶基因bglB大小为1437 bp,编码478个氨基酸,与已报道短小芽孢杆菌SAFR-032β-葡萄糖苷酶基因(YP_001488769.1)核苷酸序列同源性为97%、氨基酸序列同源性为99%。进一步利用表达载体pET-22b(+),实现了β-葡萄糖苷酶基因bglB在大肠杆菌BL21(DE3)中的高效表达,活力达46.85 U·mL-1。为下一步酶学特性的分析及结构功能关系研究奠定了基础。
[1] 潘利华,罗建平.β-葡萄糖苷酶的研究及应用进展[J].食品科学,2006,27(12):803-807.
[2] Amann R I,Ludwig W,Schleifer K H.Phylogenetic identification and in situ detection of individual microbial cells without cultivation[J].Microbiological Reviews,1995,59(1):143-169.
[3] 李平,宛晓春,陶文沂,等.黑曲霉β-葡萄糖苷酶的食品增香应用[J].食品与发酵工业,2000,26(2):5-6.
[4] Pyo Y H,Lee T C,Lee Y C.Enrichment of bioactive isoflavones in soymilk fermented withβ-glucosidase-producing lactic acid bacteria[J].Food Research International,2005,38(5):551-559.
[5] Yan T R,Liau J C.Synthesis of alkylβ-glucosidase from cellobiose withAspergillusnigerβ-glucosidase Ⅱ[J].Biotechnology Letters,1998,20(7):653-657.
[6] Raynal A,Guerineau M.Cloning and expression of the structural gene forβ-glucosidase ofKluyveromycesfragilisinEscherichiacoliandSaccharomycescerevisiae[J].Mol Gen Genet,1984,195(1-2):108-115.
[7] Hong J,Tamaki H,Kumagai H.Cloning and functional expression of thermostableβ-glucosidase gene fromThermoascusaurantiacus[J].Appl Microbiol Biotechnol,2007,73(6):1331-1339.
[8] 李丽娟.β-葡萄糖苷酶基因在毕赤酵母中的诱导表达[D].南京:南京林业大学,2009.
[9] 李远华.β-葡萄糖苷酶的研究进展[J].安徽农业大学学报,2002,29(4):421-425.
[10] 赵新刚.洗涤用碱性纤维素酶及其产生菌的分离方法[J].微生物学通报,1999,26(1):63-65.
[11] 沈雪亮,夏黎明,刘景晶.纤维素酶E5基因在E.coli中的克隆与表达[J].浙江大学学报(工学版),2001,35(6):640-644.
[12] 张蔚,杨雪鹏,魏东芝,等.β-葡萄糖苷酶高产菌株的筛选及产酶条件优化[J].河南大学学报(自然科学版),2011,41(2):174-178.
[13] 李平,宛晓春,陶文沂,等.微生物发酵生产β-葡萄糖苷酶[J].安徽农业大学学报,2000,27(2):196-198.
[14] 吴小刚,曾莹,周丽明,等.β-葡萄糖苷酶高产菌的筛选[J].中国酿造,2005,(9):14-16.
[15] 成堃,路福平,李玉,等.产碱性蛋白酶菌株的筛选、分子鉴定及其酶学性质的初步研究[J].中国酿造,2009,(2):33-36.
[16] 房伟,方泽民,刘娟娟,等.新型海洋微生物β-葡萄糖苷酶基因的克隆、表达及重组酶性质[J].生物工程学报,2009,25(12):1914-1920.

