双歧杆菌脂磷壁酸对胃癌SGC7901细胞SphK1表达的影响
刘 宁,鲁志刚
(1.乳品科学教育部重点实验室,哈尔滨 150030;2.东北农业大学食品学院,哈尔滨 150030;3.国家乳业工程技术研究中心,哈尔滨 150086)
双歧杆菌(Bifidobacterium)是人体肠道内最主要的生理性有益菌,与人体的许多病理、生理现象密切相关。双歧杆菌在体内发挥着许多重要的生理功能,如生物屏障、抗衰老、改善乳糖消化不良和营养免疫等,其中抗肿瘤作用是最受关注的功能之中。双歧杆菌活体、灭活菌体、完整的细胞壁肽多糖、胞外多糖及细菌素等均有较高的抗肿瘤活性。脂磷壁酸(Lipoteichoic acid,LTA)是普遍存在于革兰氏阳性菌细胞壁中的一种成分。目前国内对双歧杆菌研究的较多,主要集中在免疫激活、抗突变、抗衰老、粘附及肿瘤等方面[1]。
鞘磷脂(Sphingolipid)是所有真核生物的细胞膜中普遍存在的组分。在鞘磷脂类物质的代谢中,神经酰胺(Ceramide,Cer)是一种细胞凋亡的诱导分子,细胞内Cer水平升高能直接导致细胞凋亡;而其下游代谢产物1-磷酸鞘氨醇(S1P)则可以通过多种途径抑制凋亡、促进存活,它们之间相对平衡决定细胞增殖或死亡。鞘氨醇激酶 1(Sphingosine kinase 1,SphK1)是这种动态平衡的关键调节者,同时其自身也是一种癌基因[2]。
本研究从鞘磷脂信号通路出发,应用RTPCR和Western blot探讨双歧杆菌LTA对胃癌SGC7901细胞内SphK1表达是否具有抑制作用,为阐明脂磷壁酸抑制胃癌的机理作进一步的探讨,同时也为发现肿瘤治疗的有效靶标提供一定的理论支持。
1 材料与方法
1.1 材料
双歧杆菌LTA的制备参考乐军等的方法[3],用非离子型去垢剂Triton X-114提取,通过DEAESephacel阴离子交换色谱纯化;胃癌SGC7901细胞株(购自哈尔滨医科大学);Trizol(购自Invitrogen公司);RT-PCR反转录试剂盒(购自北京天根公司);SphK1和GAPDH引物序列由北京三博远志生物技术有限责任公司合成;兔源SphK1抗体(一抗)(购自Cell Signaling Technology);辣根过氧化物酶标记的IgG(二抗)(来自于北京中杉金桥公司);ECL发光检测试剂盒(购自南京凯基生物);RPMI 1640(购自Invitrogen公司);胎牛血清购自杭州四季青。
1.2 方法
1.2.1 半定量RT-PCR检测SphK1 mRNA表达
引物用Primer5设计完成,序列如下:SphK1 Forward∶5'TGGATGGTCAGCGGTTGC 3',Reverse∶5'CTGGGAATGTCACTTTATTTGGAT 3',扩增片断为348 bp;GAPDH Forward∶5'TCCCATCACCATCTTC CAG 3', Reverse∶5'ATGAGTCCTTCCACGATACC 3',扩增片断为309 bp。
细胞经0、200、500 μg·mL-1LTA处理72 h后收集细胞并加入1 mL Trizol进行总RNA的提取,用分光光度计根据OD260和OD280进行RNA浓度的测定。随后根据逆转录试剂盒进行cDNA的合成,反应体系为20 μL,包括:2 μL 10 × RT Mix,2 μL超纯dNTP,2 μL Oligo-dT15,1 μL逆转录酶,3 μL Rnase-free水,10 μL模板RNA。PCR反应体系为12.5 μL Master Mix,上下游引物各1 μL,cDNA模板5 μL,补充ddH2O至25 μL。扩增条件为:95℃5 min;95 ℃ 30 s,57 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 10 min。取 PCR 产物 5 μL 与 1 μL 6×Loading Buffer混合上样于1%琼脂糖凝胶,100 mA,电泳40 min后于紫外凝胶成像系统下观察结果并成像。灰度分析使用Image J软件。
1.2.2 Western blot检测SphK1蛋白表达
细胞经 0,200,500 μg·mL-1LTA 处理 72 h后,用预冷的PBS洗两次,用细胞裂解液提取总蛋白。BCA蛋白定量试剂盒进行蛋白浓度测定,调整蛋白量为20~25与5×SDS上样缓冲液以4∶1的比例混匀,煮沸变性5 min。12 000 g离心取上清于10%SDS-PAGE进行蛋白分离。电泳条件为浓缩胶80 V,分离胶120 V。随后将蛋白转印至硝酸纤维素(NC)膜上,用含5%的脱脂奶粉的TBST室温封闭2 h。按说明书比例稀释一抗,将膜在4℃杂交过夜,然后用TBST洗去多余未结合的抗体,室温洗涤3次,每次15 min。随后用二抗室温摇动1~2 h进行结合,用TBST洗膜3次去掉多余抗体,每次15 min。最后用增强型化学发光剂(ECL)于暗室中进行曝光及显影定影,将胶片扫描成像,进行灰度分析。以α-tubulin作为内参进行检测。
细胞裂解液的组分为:20 mmol·L-1Tris,pH 7.4;20%甘油;1 mmol·L-1β-巯基乙醇;1 mmol·L-1EDTA;5 mmol·L-1原钒酸钠;15 mmol·L-1NaF;40 mmol·L-1β-甘油磷酸;10 μg·mL-1亮肽素和抑肽酶;1 mol·L-1PMSF(临用前补加)。
1.2.3 统计学分析
每个试验均重复3次,结果用均值±标准差(Mean±SD)形式表示。与对照组的比较采用非配对t检验,以P<0.05为差异显著。统计分析及作图使用OriginPro 8.0软件。
2 结果与分析
2.1 双歧杆菌LTA对SGC7901细胞内SphK1基因表达的影响
图1是分别用 0,200,500 μg·mL-1处理72 h后SGC7901细胞内SphK1基因和GAPDH表达的结果。利用Image J进行灰度分析,SphK1条带灰度值除以GAPDH条带灰度值为SphK1相对表达量(Relative Expression,R.E.),结果如下:
对照:1.23±0.04;200 μg·mL-1LTA处理:0.54±0.01;500 μg·mL-1LTA 处理:0.20±0.02。结果表明LTA对SGC7901胃癌细胞内SphK1基因有明显的抑制作用(P<0.01),高浓度LTA抑制作用更大(见图1、2)。

图1 RT-PCR检测LTA处理72 h后SphK1基因表达Fig.1 SphK1 gene expression by RT-PCR after treatment with LTA for 72 h
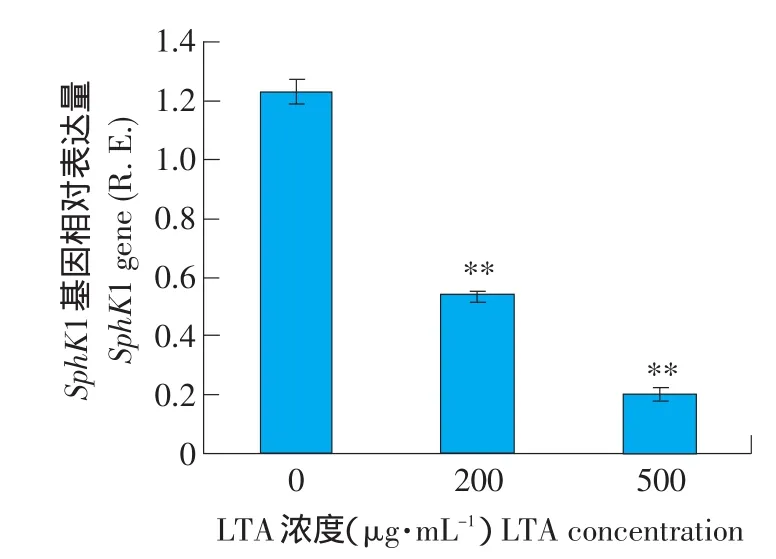
图2 LTA处理72 h后SphK1基因相对表达量Fig.2 Relative expression of SphK1 gene after treatment with LTA for 72 h
2.2 双歧杆菌LTA对SGC7901细胞内SphK1蛋白表达的影响
LTA处理72 h后用Western Blot检测SGC7901细胞内SphK1蛋白如图3所示,经灰度分析结果如下:对照组为0.91±0.03,200 μg·mL-1LTA处理组为0.82±0.04,500 μg·mL-1LTA处理组为0.49±0.02(见图3、4)。

图3 LTA处理72 h后的SphK1蛋白表达Fig.3 SphK1 protein expressions after treatment with LTA for 72 h

图4 LTA处理72 h后SphK1蛋白相对表达量Fig.4 Relative expression of SphK1 protein after treatment with LTA for 72 h
3 讨论
双歧杆菌的表面分子LTA对多种体外培养的肿瘤细胞都具有直接的生长抑制作用,并能诱导肿瘤细胞凋亡和分化,国内对其作用机制研究较多。研究显示LTA对胃癌SGC7901细胞的增殖有抑制作用,并随着其浓度升高而增强;利用TUNEL法观察LTA处理后的细胞,出现了凋亡现象(数据未显示)。由于鞘磷脂信号在细胞凋亡中的作用逐渐被研究证实,LTA诱导SGC7901细胞调亡通过抑制这一通路实现。
鞘磷脂代谢物在介导癌细胞存活、死亡和分化的信号途径中起关键作用。Cer和S1P之间比例形成的“鞘磷脂变阻器”决定了一个细胞是死亡还是存活。SphK1是最重要并直接调节这些鞘磷脂信使的介导者[4],同时其自身也是一种癌基因。研究发现SphK1 mRNA在许多肿瘤组织和细胞中都有高表达[5],使得它成为一种公认的治疗癌症的鞘标。最新的研究表明SphK1表达的高低与胃癌的发展和较低的患者存活率相关[6],因此抑制SphK1表达是发挥抗肿瘤作用的机制所在,也是进行新型药物开发的有力支持。目前一些具有药理活性的复合物已经被发现或分离出来,其中一些来源于微生物[7-8],还有一些是合成的鞘磷脂类似物[2,9]。
本研究利用不同浓度LTA处理胃癌SGC7901细胞后检测其SphK1基因和蛋白表达情况。结果显示200、500 μg·mL-1的LTA对SphK1的基因和蛋白表达均具有明显的抑制作用,且500 μg·mL-1LTA抑制作用更强。研究结果表明,双歧杆菌LTA能够抑制胃癌SGC7901细胞内SphK1基因和蛋白表达,且浓度越高抑制作用越强。抑制的结果是一方面可以有效地抑制促存活的S1P的生成,增加促凋亡的Cer的生成;另一方面,由于SphK1自身也是一种癌基因,抑制其表达能够从根本上抑制这一信号通路,最终的结果是促使细胞走向凋亡。研究结果印证并初步解释了双歧杆菌LTA抑制SGC7901细胞增殖及诱导凋亡的作用。本研究在一定程度上证明LTA作为一种天然产物有希望成为癌症治疗物质,更重要的是为SphK1信号通路作为治疗癌症的靶标提供有力支持。对于LTA抑制SphK1同时是否影响其他信号通路,还需进一步研究。
[1]刘春梅,魏华,郭亮,等.双歧杆菌脂磷壁酸生物学活性研究进展[J].天然产物研究与开发,2007,19∶905-909,916.
[2]Bektas M,Johnson S P,Poe W E,et al.A sphingosine kinase inhibitor induces cell death in temozolomide resistant glioblastoma cells[J].Cancer Chemoth Pharmacol,2009,64(5)∶1053-1058.
[3]乐军,胡宏.非离子型去垢剂TritonX-114提取两歧双歧杆菌的脂磷壁酸[J].中国微生态学杂志,1997,9(4)∶5-8.
[4]Maceyka M,Payne S G,Milstien S,et al.Sphingosine kinase,sphingosine-1-phosphate,and apoptosis[J].Biochim Biophys Acta,2002,(2-3)∶193-201.
[5]French K J,Schrecengost R S,Lee B D,et al.Discovery and evaluation of inhibitors of human sphingosine kinase[J].Cancer Res,2003,63(18)∶5962-5969.
[6]Li W,Yu C P,Xia J T,et al.Sphingosine kinase 1 is associated with gastric cancer progression and poor survival of patients[J].Clin Cancer Res,2009,15(4)∶1393-1399.
[7]Kono K,Sugiura M,Kohama T.Inhibition of recombinant sphingosine kinases by novel inhibitors of microbial origin,F-12509A and B-5354c[J].J Antibiot(Tokyo),2002,55(1)∶99-103.
[8]Kono K,Tanaka M,Mizuno T,et al.B-535a,b and c,new sphingosine kinase inhibitors,produced by a marine bacterium;taxonomy,fermentation,isolation,physico-chemical properties and structure determination[J].J Antibiot(Tokyo),2000,53(8)∶753-758.
[9]Kim J,Kim Y,Inagaki Y,et al.Synthesis and evaluation of sphingoid analogs as inhibitors of sphingosine kinases[J].Bioorg Med Chem,2005,13(10)∶3475-3485.

