siRNA抑制人肝癌细胞MDM2表达及细胞增殖的研究
赵燕颖,李亚刚,杨泽成,张舵舵,赵春燕
(1.吉林大学第四临床医院 内科,吉林 长春 130011;2.吉林大学中日联谊医院 普外科,吉林 长春130033;3.吉林大学 白求恩医学院 生理学系,吉林 长春 130021)
siRNA抑制人肝癌细胞MDM2表达及细胞增殖的研究
赵燕颖1,3,李亚刚1,杨泽成2,张舵舵2,赵春燕3*
(1.吉林大学第四临床医院 内科,吉林 长春 130011;2.吉林大学中日联谊医院 普外科,吉林 长春130033;3.吉林大学 白求恩医学院 生理学系,吉林 长春 130021)
目的 探讨siRNA对人肝癌HepG2细胞MDM2基因表达的抑制作用及对增殖的影响。方法体外合成针对MDM2基因的siRNA质粒,转染HepG2细胞株;应用RT-PCR和western blot方法检测siRNA对MDM2和P53基因和蛋白表达的影响,并用MTT法检测siRNA对细胞增殖抑制作用,流式细胞仪检测细胞周期。结果和空白组比转染siMDM2-1,2的HepG2细胞的MDM2基因和蛋白表达减低,而P53基因和蛋白表达增加。阴性对照质粒组的基因表达未见明显改变。转染siRNA MDM2后细胞生长受到抑制,转染siMDM2-1,2和阴性对照质粒后的抑制率分别是46.3%、56.1%和3%。和对照组比较,转染siMDM2-1,2的hepG2细胞的细胞周期发生明显改变,而转染对照质粒的hepG细胞周期未发生明显变化。结论siRNA MDM2可以有效抑制HepG2细胞株中MDM2的表达,促进P53的表达,同时可以使细胞周期发生变化,这可能是其抑制肿瘤细胞增殖的主要机制之一。
肝细胞癌;MDM2;si RNA;凋亡
(ChinJLabDiagn,2012,16:1790)
肝癌的发生涉及多种致病原因和危险因素。目前,原癌基因、抑癌基因、凋亡基因等癌症相关基因的过度表达被认为是肝癌发生的主要原因[1]。MDM2是p53调控网络中的下游基因,作为p53的重要调节因子,参与细胞生长抑制、凋亡、细胞周期调控等过程。MDM2作为原癌基因具有泛素化-蛋白酶降解抑癌基因p53的功能,从而抑制细胞凋亡促进细胞增殖[2,3]。本研究中,我们构建了针对人MDM2特异性发卡状siRNA (small interfering RNA)质粒表达载体,并成功转染人肝癌HepG2细胞,进一步研究其沉默MDM2对其增殖的影响和初步探讨其分子机制。
1 材料与方法
1.1 材料胎牛血清、IMDM培养基 (GBICO);M-MLV逆转录和PCR试剂盒(Invitrogen)、SilencerTM siRNA construction kit(Ambion公司);LipofectamineTM2000转染试剂盒(Invitrogen公司);引物由上海生工生物技术公司合成;细胞株(中国科学院上海细胞所)。
1.2 siRNA的设计和合成根据已知Genebank MDM2mRNA序列和siRNA的设计原则[4],利用Ambion公司的在线设计来寻找靶序列,并做同源序列搜索,排除那些和其他编码序列或EST同源的序列。用silencerTM siRNA construction kit体外合成 si-MDM2 1,si-MDM2 2,阴性对照(control siRNA)购于Ambion,与任何编码序列无同源性。
1.3 细胞培养及转染人肝癌细胞株HepG2细胞于IMDM培养液 (含10% 新生牛血清,青霉素100μg/ml,链霉素100μg/ml)中,37℃5%CO2孵箱内培养,常规更换生长液、消化传代,实验用细胞均处于对数生长期。胰酶消化处于对数生长期的细胞并计数,传代于孔板或培养瓶,在无抗生素的培养基中培养24h后,细胞融合率达80%-95%时开始转染。操作按LipofectamineTM 2000试剂说明书进行。
1.4 RT-PCR检测基因表达转染后72h收集各组siRNA MDM2和control siRNA细胞,按Trizol操作说明,分别提取总RNA,紫外分光光度计定量。RNA样品经逆转录反应合成cDNA,然后进行PCR扩增,RT-PCR所有操作均按RT-PCR试剂盒说明书进行。以βactin做为内参,MDM2扩增产物为300bp,上游引物5’-AACCACCTCACAGATTCCAG-3’,下游引物5’-TCAAGGTGACACCTGTTCTC-3’;P53扩增引物为490bp,上游引物5'-GTGGTGGTGCCCTATGAG-3';下 游 引 物 5'-GGGAGGTAGACTGACCCTTT-3';β-actin 扩 增 产 物为520bp,上游引物:5’2GGGACCTGACAGACTACCT23’下游引物:5’2CGTACTCCTGCTTGCTGA23’。扩增条件:94℃变性45秒,55℃退火45秒,72℃延伸1分钟,30个循环,最后72℃延伸7分钟。PCR产物经1%琼脂糖凝胶系统电泳(含溴化乙啶),拍照鉴定。用 Pharmacia ImageMaster凝胶成像仪观察,并用ImageMaster软件分析条带峰面积,转染各组信号值相对于对照组的百分率进行统计作图。
1.5 Western blot检测蛋白表达细胞转染后培养72h,用PBS清洗后加预冷的裂解液,收集细胞,轻微超声粉碎细胞10s,测蛋白质浓度,取50μg蛋白上样,12%SDS PAGE电泳,并转印到硝酸纤维素膜上。含有样品的硝酸纤维素膜用10g/L脱脂奶粉4℃封闭过夜后用配制的TBST洗,用按1∶200稀释的兔抗人MDM2、wtP53和βactin单克隆抗体37℃振荡反应2h,用TBST洗。然后用按1∶1 000稀释的山羊抗兔二抗37℃反应1h,TBST洗,DAB法显色。用图像分析系统测定各条带灰度值,来反映蛋白的表达变化。
1.6 MTT法检测细胞增殖抑制取对数生长期HepG2细胞以5×103/孔接种于96孔板,培养至细胞贴壁后,转染2组siRNA MDM2和control siRNA使其终浓度达50nmol/L,未处理组加入相应体积的PBS,转染24,48,72h后,每孔加入15μl MTT(5mg/ml)培养4h,再加入150μl/孔的DMSO,振荡10min,用酶标仪570nm处测定吸光度(A)值。根据公式:细胞增殖抑制率(%)= (1-处理组吸光度/未处理组吸光度)×100%,计算出抑制率。每组均设3个平行孔(取平均值作为1次实验结果),并重复3次实验。
1.7 流式细胞术检测细胞周期按1×106/瓶将对数生长期细胞接种到培养皿中,分别转染2组的siRNA MDM2和control siRNA。培养72h,用消化法收集细胞,用冷PBS充分洗涤,制备成单细胞悬液,用70%乙醇处理过夜,碘化丙啶染色,流式细胞仪检测细胞周期。每组均设3复管,并重复3次。
1.8 统计学方法采用SPSS13.0统计软件。采用成组t检验。P≤0.05为差异有统计学意义。
2 结果
2.1 重组质粒酶切和测序鉴定PGCsilencerTMMDM2siRNA经HindⅢ和BamHⅠ双酶切后呈2条带,分成大的载体片段和小的目的片段,见图1。将重组质粒PGCsilencerTM-MDM2-siRNA送上海生 工 测 序 (测 序 号 D02.CS060503093_0253.SD13D229-1.F;D04.CS060503093 _0255.SD13D230-1.F),引物序列根据载体序列,采用 Primer-Premier5.0设计为:5′-AAGAAGAGAGTGTGGAATCTA-3′。结果表明siRNA表达模板成功构建于PGCsilencer载体上,序列完全正确,与目的序列相同。
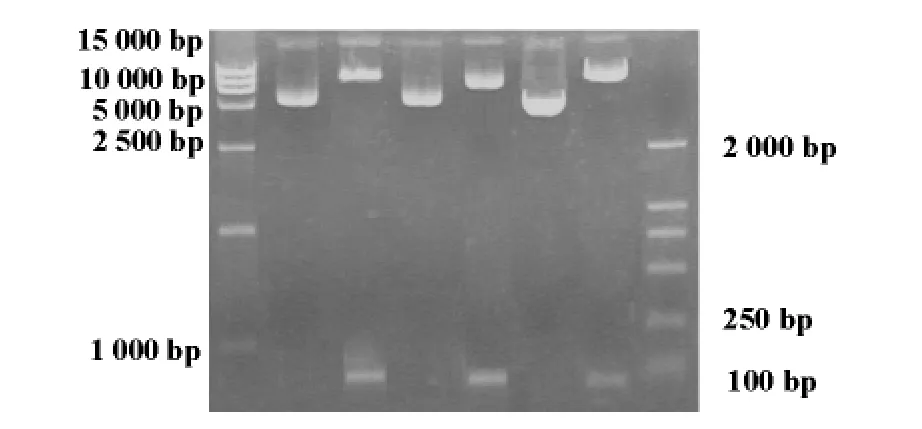
图1 重组质粒双酶切鉴定
2.2 siMDM2转染后对hepG2细胞MDM2和P53基因表达的影响半定量RT-PCR检测结果显示MDM2,P53和β-actin引物的扩增基因片段经电泳和EB染色后,结果显示扩增片段大小与所设计的大小完全一致。和转染control siRNA及空白组的hepG2细胞比较转染si2MDM2-1、si2MDM2-2的hepG2细胞中MDM2mRNA的表达水平显著减低,而P53mRNA表达水平明显增加(如图2)。而和空白组比较control siRNA组各基因表达水平无明显改变。统计分析结果表明,转染si-MDM2-1、si-MDM2-2和control siRNA 的hepG2中 MDM2-mRNA的表达量分别下降至空白组的39.06%,32.61%和94.8%,si-MDM2组和空白组比转染差异有显著性,P<0.05;control siRNA与空白组比无明显差异,P>0.05。和空白组比较转染si MDM2组P53mRNA表达水平分别上调46.2%和52.1%左右(P<0.05);control siRNA 组无明显改变,P>0.05。
2.3 siMDM2转染后对hepG2细胞MDM2和P53蛋白因表达的影响western blot结果显示hepG2细胞转染后各组β-actin蛋白表达量基本相同,阴性对照组和空白组的各目的蛋白表达量相似,siRNA MDM2-1和siRNA MDM2-2组的各目的蛋白表达量相似,差异均无统计学意义(P>0.05)。和对照组比较,转染2组siRNA MDM2的MDM2蛋白表达量有不同程度的下调,P53蛋白表达水平有不同程度上调,差异均具有统计学意义(P>0.05)。和空白组比较转染2组si MDM2的 MDM2/β-actin平均下调56.80%;wtP53/β-actin平均上调44.9%。如图3

图2 转染后各组hepG2中MDM2mRNA和P53mRNA的表达的变化
2.4 siMDM2转染后对hepG2细胞增殖的影响siRNA MDM2转染后用MTT显色法检测96孔板细胞在不同时间的吸光值,根据存活细胞数量与吸光值呈正比的原理,按细胞增殖抑制率,转染siMDM2后细胞的增殖速度和分裂指数均低于空白组,而且抑制率在0-72小时时间范围内随时间的增加而增高(P<0.05),如图4。control siRNA和空白组比较细胞增殖差异无显著性(P>0.05)。
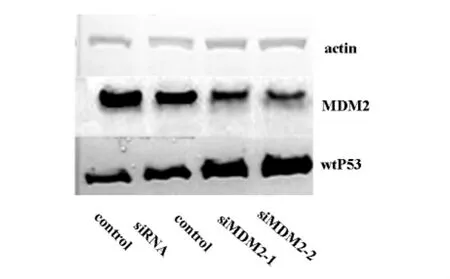
图3 转染后各组hepG2中MDM2mRNA和P53蛋白的表达的变化
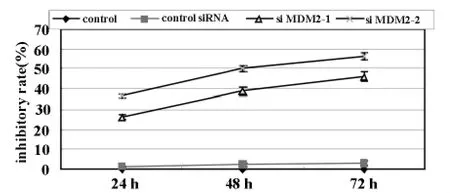
图4 转染后各组hepG2细胞增殖抑制率
2.5 siMDM2转染后对hepG2细胞周期的影响流式细胞仪检测结果显示转染siMDM2-1,2后引起hepG2细胞的细胞周期发生改变,使处于G0/G1期细胞明显增加,S期细胞明显减少,如图5。
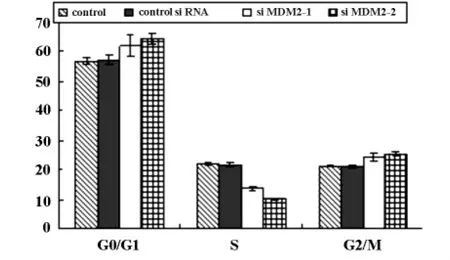
图5 转染后各组hepG2细胞周期变化
3 讨论
MDM2可以与野生型P53蛋白形成复合体,对P53起负调节作用,使P53受到抑制或完全失活,在肿瘤发生发展中发挥重要作用[5]。当有致癌因素时,P53基因突变,失去抑癌功能,原癌基因MDM2被激活,表达相应蛋白P90,通过与P53蛋白结合,进一步使P53功能丧失,从而导致肿瘤的发生[6]。研究表明,MDM2作为一个原癌基因,在肿瘤发生和发展过程中发挥重要作用,MDM2在一些软组织肉瘤中的扩增与表达和肿瘤转移、复发有关。Zhang MF等[7]报道 MDM2癌基因在原发性肝细胞癌明显过度表达,并可能参与肿瘤转移,故认为MDM2与肝癌的发生,发展和转移有关。
SiRNA可以特异性地降解相应基因的mRNA,从而抑制该基因的表达,siRNA每一条链均有2个核苷酸3′突出端,介导识别并靶向切割同源性靶mRNA分子而实现的,其作用类似于基因敲除,但较其技术简单、快捷[8,9]。siRNA技术较其他单克隆抗体和反义核苷酸方法,具有更高的效率性和特异性:微量的siRNA即可使其编码致病基因产物的含量明显下降,达到剔除的效果;同时,siRNA的抑制作用具有严格的序列特异性,治疗的针对性强,副作用小。因此,siRNA技术为肿瘤基因治疗提供了一个新的可供选择的策略和技术平台,siRNA技术可能成为治疗人类肿瘤和其他疾病的一个新的重要工具。
我们根据siRNA设计原则设计合成了2对针对在肝细胞肝癌高表达的MDM2基因的干扰位点序列的siRNA MDM2。将构建的siMDM2真核表达质粒转染至hepG2细胞后进行基因和凋亡的检测。RT-PCR结果显示siMDM2能有效地阻抑MDM2基因的表达,和空白组比较,平均基因表达下调64.7%;同时,增强P53基因的表达,和空白组比较,平均基因表达上调49.1%。MTT检测结果显示:瞬时转染siMDM2能有效抑制hepG2细胞增殖,使细胞增殖速度减慢,且随着转染时间延长,增殖抑制率逐渐增加,差异具有显著性,但转染control si RNA组细胞增殖与空白组比为见明显差异。流式细胞术检测结果显示siMDM2可使肿瘤细胞发生细胞周期阻滞:处于S期细胞减少,G0/G1和G2/M期细胞增多。而转染control si RNA组细胞未见明显细胞周期改变。
SiRNA MDM2能抑制MDM2基因和上调P53基因表达,从而抑制肿瘤细胞增殖和使细胞发生周期阻滞,本研究组已经在siRNA MDM2对骨肉瘤增殖和凋亡的影响研究中证明了合成的siMDM2的有效性[10],本研究进一步证明了此重组质粒可以抑制肿瘤细胞增殖,提示在肝癌治疗中,以MDM2基因为靶点,利用siRNA技术进行基因治疗有可能成为一种新的有效手段。本研究为后续的长效抑制肿瘤的研究工作提供了新思路和实验数据。
[1]Zeng XX,Zheng RL,Zhou T,Nove,et al.l thienopyridine derivatives as specific anti-hepatocellular carcinoma(HCC)agents:Synthesis,preliminary structure-activity relationships,and in vitro biological evaluation[J].Bioorg Med Chem Lett,2010,8:21.
[2]Akkiz H,Sümbül AT,Bayram S,et al.MDM2promoter polymorphism is associated with increased susceptibility to hepatocellular carcinoma in Turkish population[J].Cancer Epidemiol,2010,34(4):448.
[3]Kang KF,Zhang X,Chen XW,et al.Expressions of MDM2and MMP-7in normal liver,cirrhosis,hepatocellular carcinoma tissues[J].Zhonghua Gan Zang Bing Za Zhi,2010,18(1):67.
[4]Elbashir SM,Harborth J,Weber K,et al.Analysis of gene function in somatic mammalian cells using small interfering RNAs[J].Methods,2002,26(2):199.
[5]Copson ER,White HE,Blaydes JP,Robinson DO et al.Influence of the MDM2single nucleotide polymorphism SNP309on tumour development in BRCA1mutation carriers[J].BMC Cancer,2006,6(1):80.
[6]Zheng T,Wang J,Song X,et al.Nutlin-3cooperates with doxorubicin to induce apoptosis of human hepatocellular carcinoma cells through p53or p73signaling pathways[J].Cancer Res Clin Oncol,2010,136(10):1597.
[7]Zhang MF,Zhang ZY,Fu J,et al.Correlation between expression of p53,p21/WAF1,and MDM2proteins and their prognostic significance in primary hepatocellular carcinoma[J].J Transl Med,2009,22(7):110.
[8]Xiong GS,Sun HL,Wu SM,Mo JZ,et al.Small interfering RNA against the apurinic or apyrimidinic endonuclease enhances the sensitivity of human pancreatic cancer cells to gemcitabine in vitro[J].J Dig Dis,2010,11(4):224.
[9]Eckstein A,Grøβl T,Geisler A,et al.Inhibition of adenovirus infections by siRNA-mediated silencing of early and late adenoviral gene functions[J].Antiviral Res,2010,8:11
[10]吕佳音,吴丹凯,张舵舵,等.siRNA 对骨肉瘤 U2OS细胞株MDM2mRNA表达的抑制作用[J].中国实验诊断学,2007,11(7):878.
siRNA inhibits MDM2expression and proliferation of hepatoma carcinoma cell
ZHAOYan-ying1,LIYa-gang1,YANGZe-cheng2,etal.(1.DepartmentofInternalMedicine,theFourthHospitalofJilinUniversity,Changchun130011,China;2.DepartmentofSurgery,China-JapanUnionHospital,JilinUniversity,Changchun130033,China)
ObjectiveUsing siRNA to downregulate MDM2expression in hepatocellular carcinoma cell line hepG2,to observe the influence of siRNA of cell proliferation and apoptosis.MethodsMDM2-siRNAs against the MDM2gene were designed and transfected into hepG2cells respectively,MDM2and P53gene and protein expression was measured using RT-PCR and western blot,Cell proliferation was measured with MTT assay,the cell cycle were analysed using flow cytometer.ResultsMDM2mRNA and protein expression were inhibited and P53mRNA and protein expression were enhanced after transfecting with two siRNA MDM2respectively.As a consequence,cell growth inhibition was observed,cell cycle change was observed after transfecting with two siRNA MDM2too.ConclusionsiRNA against MDM2could effectively downregulate MDM2and upregulate P53expression in hepG2cell line,inhibit cell proliferation and change cell cycle.
hepatocellular carcinoma;MDM2;si RNA;apoptosis
R735.7
A
1007-4287(2012)10-1790-04
*通讯作者
2011-09-03)

