皖南花猪不同发育阶段脂肪组织脂联素及受体和瘦素mRNA的变化*
盛 晟,周 杰,张 佳,邵 康,吴小雪,李维新,殷宗俊
(安徽农业大学动物科技学院,合肥 230036)
自从Scherer等1995年克隆了脂联素(adiponectin,Adp)基因,并发现其表达产物是一个30 kDa的蛋白质,Zhang等1994年克隆了瘦素(leptin)基因,近十几年的研究表明,脂肪细胞可分泌大量活性物质,通过内分泌、旁/自分泌的形式在能量调节中起重要作用。其中,Adp是唯一一种随脂肪沉积增多其血液浓度反而下降的脂肪因子,Adp大约占血浆总蛋白的0.01%,是迄今发现的含量最丰富的脂肪因子[1]。Ding等2004年首次克隆了猪Adp基因片段,发现其主要在猪脂肪组织中高表达,并发现Adp有两种受体,其中AdpR1在骨骼肌高表达,AdpR2在肝脏、脂肪高表达[2]。基因的表达具有时间特异性,然而目前有关Adp的研究一般集中在动物生长的某一阶段,对不同发育阶段Adp分泌变化的研究不多,且有不同的结果。本实验室发现猪血液Adp有明显的时序变化[3]。Ramsay等发现新生小猪(0~21d)脂肪组织Adp和leptin mRNA的表达随日龄增加[4],而断奶后Adp基因的表达规律未见报道。此外,配体的作用效果往往决定于其受体水平的变化。目前尚未见猪不同发育阶段脂肪组织中AdpR表达的报道。本研究利用荧光定量PCR方法测定不同日龄皖南花猪皮下脂肪和内脏脂肪Adp、AdpR1、AdpR2和leptin mRNA的表达,系统认识它们的表达规律和性别差异。
1 材料与方法
1.1 试验动物及样品采集
从安徽黟县皖南花猪繁育中心选择0 d、30 d、45 d(断奶)、90 d、180 d的健康皖南花猪雌、雄各5头,常规饲养管理,屠宰前禁食12 h(0 d除外),正常饮水。屠宰后迅速采集猪皮下(subcutaneous,SC)和肾周(perirenal,PR)脂肪组织,液氮速冷后-80℃保存备用。
1.2 主要试验仪器和材料
高速冷冻离心机(Sigma,德国),紫外分光光度计(岛津,日本),PCR仪(Techne,英国),荧光定量PCR仪(Corbett,澳大利亚)。Trizol Reagent、鼠源反转录酶(M-MLV)、DNA 聚合酶、SYBR·Premix Ex TaqTMⅡ(大连宝生物);寡聚核苷酸(Oligo(dT)18)、dNTP、琼脂糖 、焦碳酸二乙酯(DEPC)、DNA maker2000、0.5×TBE(上海生工生物)。
1.3 试验方法
1.3.1 组织总RNA提取 按Trizol Reagent试剂盒要求提取样品总RNA。OD260/OD280测定值在1.8~2.0为合格,根据OD260值计算RNA产量。甲醛变性凝胶电泳检测RNA质量。
1.3.2 反转录 反应体系:总 RNA 2 μ l,Oligo dT Primer(20 μ mol/L)4 μ l,RTase M-MLV(200 U/μ l)1 μ l,5 ×M-MLV Buffer 4 μ l,dNTP Mixture(10mmol/L)1 μ l,Rnase Inhibitor(40 U/μ l)0.5 μ l,加 Rnase free ddH2O至 20 μ l。反应条件 :37℃15 min,85℃5 s。反转录获得各样品的cDNA以18S为引物,常规PCR反应鉴定纯度。
1.3.3 引物设计 Adp、AdpR1、AdpR2、leptin 和内标β-actin引物序列根据GenBank中各基因的序列设计(表1)。

Tab.1 Primers used for real-time quantitative PCR
1.3.4 实时定量RCR反应 用待测样品RT产物混合样(cDNA mix)优化反应条件。反应体系:cDNA 2 μ l,SYBR·Premix Ex TaqTM(1×)12.5 μ l,上下游引物(10 μ mol/L)各 1 μ l,ddH2O 8.5 μ l,总体积 25 μ l。每个样品设3个重复,荧光PCR扩增:95℃预变性2 min,95℃10 s,60℃20 s,72℃15 s,72℃收集荧光15 s,40个循环后,进行熔点曲线分析,判定反应特异性。
1.4 数据统计分析

2 结果
2.1 不同发育阶段Adp及其受体和leptin基因表达的规律及组织差异
2.1.1 AdpmRNA表达规律 皮下脂肪和肾周脂肪Adp表达在不同发育阶段有极显著差异(P<0.01),0 d低于其他日龄(P<0.01,表2)。皮下脂肪Adp 90 d表达量最高,并与45 d、180 d差异显著;肾周脂肪Adp表现为下降趋势,30 d与180 d差异显著。肾周脂肪Adp总体比皮下脂肪高62.1%(P<0.05),并在30 d和45 d差异显著。
2.1.2 AdpR1 mRNA表达规律 0~90 d皮下脂肪AdpR1表达丰富,显著高于180 d。肾周脂肪AdpR1随日龄增加出现先升后降趋势,30 d、45 d表达量高于其他日龄(P<0.05或P<0.01,表2)。肾周脂肪AdpR1总体比皮下脂肪低49.8%(P<0.01),并在0 d和90 d差异显著。
2.1.3 AdpR2 mRNA表达规律 30 d和90 d皮下脂肪AdpR2表达高于其他日龄(P<0.01,表2),在肾周脂肪的表达有先升高后降低的趋势,45 d高于其他日龄(P<0.01)。肾周脂肪AdpR2总体比皮下脂肪低87.6%(P<0.01),并在45 d外的其他日龄差异显著。
2.1.4 Leptin mRNA表达规律 皮下脂肪和肾周脂肪letpin mRNA表达在发育不同阶段有差异(P<0.01,表2),在皮下脂肪0 d表达高于其他日龄(P<0.01),在肾周脂肪随日龄增加而减少,总体上在肾周脂肪显著低于皮下脂肪(P<0.05)。
Tab.2 Changes in the mRNA expression of Adp,AdpR1,AdpR2 and leptin in SC and PR of Wannanhua pigs at different stages of development(±s,n=10)
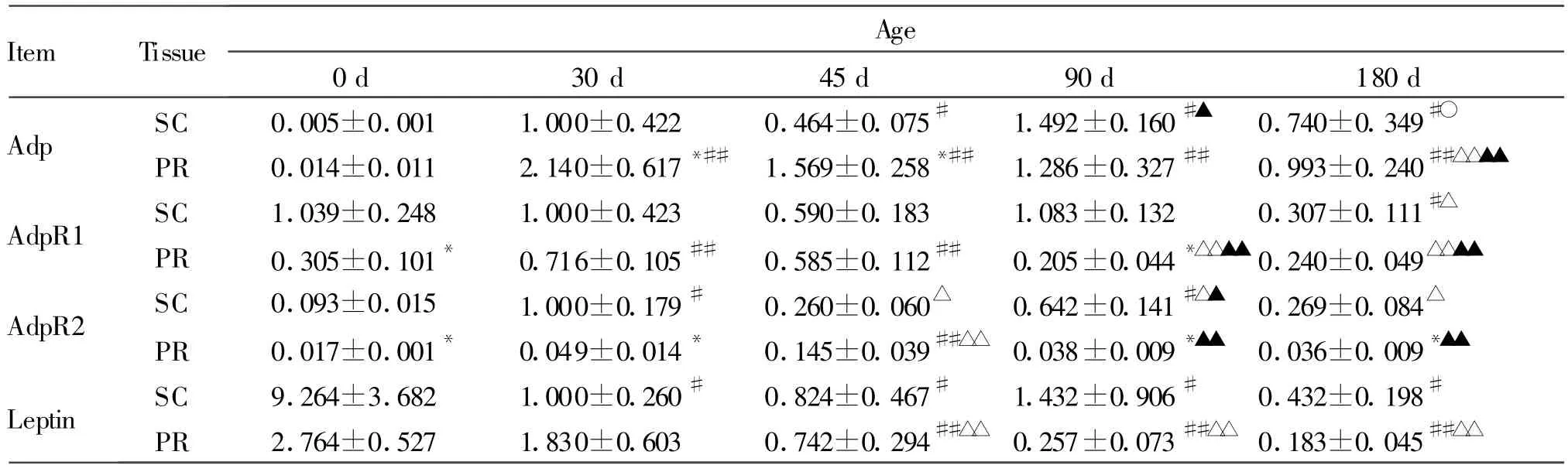
Tab.2 Changes in the mRNA expression of Adp,AdpR1,AdpR2 and leptin in SC and PR of Wannanhua pigs at different stages of development(±s,n=10)
Adp:Adiponectin;AdpR1:Adiponectin receptor 1;AdpR2:Adiponectin receptor 2;SC:Subcutaneous adipose tissue;PR:Perirenal adipose tissue*P<0.05 vs SC;#P<0.05,##P<0.01 vs 0 d;△P<0.05,△△P <0.01 vs 30 d;▲P<0.05,▲▲P<0.01 vs 45 d;○P<0.05 vs 90 d
Item Tissue Age 0 d 30 d 45 d 90 d 180 d Adp SC 0.005±0.001 1.000±0.422 0.464±0.075# 1.492±0.160#▲ 0.740±0.349#○PR 0.014±0.011 2.140±0.617*## 1.569±0.258*## 1.286±0.327## 0.993±0.240##△△▲▲AdpR1 SC 1.039±0.248 1.000±0.423 0.590±0.183 1.083±0.132 0.307±0.111#△PR 0.305±0.101* 0.716±0.105## 0.585±0.112## 0.205±0.044*△△▲▲ 0.240±0.049△△▲▲AdpR2 SC 0.093±0.015 1.000±0.179# 0.260±0.060△ 0.642±0.141#△▲ 0.269±0.084△PR 0.017±0.001* 0.049±0.014* 0.145±0.039##△△ 0.038±0.009*▲▲ 0.036±0.009*▲▲Leptin SC 9.264±3.682 1.000±0.260# 0.824±0.467# 1.432±0.906# 0.432±0.198#PR 2.764±0.527 1.830±0.603 0.742±0.294##△△ 0.257±0.073##△△ 0.183±0.045##△△
2.2 皮下脂肪和肾周脂肪基因表达的性别差异
不同发育阶段雄、雌性猪脂肪组织各基因表达的变化没有总体差异,只有0 d雄性猪皮下脂肪AdpR2 mRNA高于雌性(0.116±0.008vs0.061±0.018,P<0.05),内脏脂肪leptin低于雌性(1.559±0.126vs3.473±0.651,P<0.05);90 d雄性猪内脏脂肪Adp高于雌性(1.803±0.451vs0.635±0.179,P<0.01),AdpR1和 leptin分别高于雌性(0.274±0.060vs0.118±0.028;0.402±0.105vs0.118±0.053,P<0.05)。雄、雌性猪皮下脂肪各基因表达与肾周脂肪的差异与雌雄合计时的情况一致。
2.3 相关性分析结果
皮下脂肪和肾周脂肪Adp mRNA的表达分别与同组织中AdpR1、AdpR2呈极显著或显著正相关(P<0.01,P<0.05,表3);分别与同组织leptin呈显著负相关(P<0.05)。皮下和肾周脂肪Adp mRNA的表达显著相关(P<0.05)。

Tab.3 Correlation coefficients between Adp,AdpR1,AdpR2 and leptin mRNA expression in SC and PR
此外,皖南花猪30 d、45 d、90 d和180 d 时6、7肋背部皮下脂肪厚度分别为(cm):0.37±0.03、0.52±0.04、0.70±0.02和 1.02±0.10(0 d未测定到结果)。除0 d外,内脏脂肪Adp和AdpR1 mRNA分别与皮下脂肪厚度呈负相关(r=-0.346,P<0.05;r=-0.505,P<0.01),皮下脂肪AdpR2mRNA与皮下脂肪厚度呈负相关(r=-0.389,P<0.05)。
3 讨论
早期的内分泌作用可以影响遗传性状,并随年龄增长而逐渐显现,这种作用往往表现为滞后效应,称为程序化(Gardner et al,2009)。所以,研究Adp及其受体的发育性变化规律十分重要。本试验发现猪在0 d时脂肪组织Adp表达量极低,这可能与猪刚出生时前体脂肪细胞较多,而成熟脂肪细胞相对较少有关(Körner et al,2005)。本试验发现猪0~30 d脂肪Adp mRNA水平均随日龄升高,与Ramsay等的结果一致[4];30~180 d内脏脂肪Adp mRNA表达呈下降趋势,与皮下脂肪厚度呈负相关,与在人及啮齿类报道的Adp随脂肪沉积增多而下降的结果一致[1],结果提示Adp在猪的作用可能与在人及啮齿类的类似,也与能量代谢有关。而皖南花猪皮下脂肪letpin mRNA在0 d表达丰富,与我们以往在太湖猪和大白猪的研究结果不同[5]。这是否与动物的品种有关,有待进一步研究。
本实验发现雌、雄性皖南花猪在发育过程中,内脏脂肪Adp mRNA表达在总体上均显著高于皮下脂肪,与Lord等在110 kg体重雌性猪[6]、成年雌、雄性小鼠[7]、成年大鼠实验(Altomonte et al,2003)中的报道一致,提示内脏脂肪表达的Adp可能是血液Adp的主要来源。皖南花猪AdpR1、AdpR2以及 letpin mRNA表达量的组织差异与Adp相反,肾周脂肪AdpR1和AdpR2 mRNA在总体上均极显著低于皮下脂肪,且雌、雄性猪结果一致,与Ramsay等对哺乳期仔猪和断奶后猪的研究结果一致[4,7]。
本实验中雌、雄性猪Adp mRNA在总体上没有明显差异,但在180 d时(性成熟)雌性猪皮下脂肪和内脏脂肪Adp mRNA表达量分别高于雄性猪,虽然未到达显著水平,与小鼠的研究相似[8,9],结果提示Adp可能与雌、雄个体性成熟后脂肪沉积的差异有关。
本实验发现皖南花猪除0 d外,内脏脂肪Adp与皮下脂肪厚度呈负相关,与梅山猪的情况相似。内脏脂肪AdpR1 mRNA,皮下脂肪AdpR2 mRNA分别与皮下脂肪厚度呈负相关,与Lord等[6]的结果有一定差异。结果提示脂联素及受体表达与脂肪沉积的关系存在品种差异。
综上所述,皖南花猪不同发育阶段脂肪组织中Adp及受体和leptin mRNA的表达均有一定的变化规律,且有组织特异性,其中Adp mRNA的表达量在内脏组织高于皮下脂肪,而AdpR1、AdpR2和leptin mRNA的表达量在内脏组织低于皮下脂肪。Adp与其受体mRNA表达有相关性。
[1]Arita Y,Kihara S,Ouchi N,et al.Paradoxical decrease of an adipose-specific protein,adiponectin,in obesity[J].Biochem BiophysResCommun,1999,257(1):79-83.
[2]Ding S T,Liu B H,Ko Y H.Cloning and expression of porcine adiponectin and adiponectin receptor 1 and 2 genes in pigs[J].J Anim Sci,2004,82(11):3162-3174.
[3]盛 晟,周 杰,舒宝屏,等.皖南花猪11种血液生化指标的发育性变化及性别差异[J].生命科学研究,2010,14(2):150-155.
[4]Ramsay T G,Caperna T J.Ontogeny of adipokine expression in neonatal pig adipose tissue[J].Comp Biochem Physiol B Biochem Mol Biol,2009,152(1):72-78.
[5]Zhou J,Zhao R,Wei X,et al.Developmental patterns of serum leptin levels,leptin gene expression in adipose tissue and Ob-Rb gene expression in hypothalamus of Erhualian and Large White pigs[J].Sci China C Life Sci,2004,47(2):190-196.
[6]Lord E,Ledoux S,Murphy B D,et al.Expression of adiponectin and its receptors in swine[J].J Anim Sci,2005,83(3):565-578.
[7]Ramsay T G,Richards M P.Leptin and leptin receptor expression in skeletal muscle and adipose tissue in response toin vivoporcine somatotropin treatment[J].J Anim Sci,2005,83(11):2501-2508.
[8]Combs T P,Berg A H,RajalaM W,et al.Sexual differentiation,pregnancy,calorie restriction,and aging affect the adipocyte-specfic secretory protein adiponectin[J].Diabetes,2003,52(2):268-276.
[9]Gui Y,Silha JV,Murphy L J.Sexual dimorphism and regulation of resistin,adiponectin,and leptin expression in the mouse[J].Obes Res,2004,12(9):1481-1491.

