非诺贝特对高脂模型大鼠过氧化物酶增殖物活化受体γ、肝X受体α和ABCA1 mRNA及其蛋白表达的影响
高丽君 齐晓勇 王秀萍 高俊茶 蔺 杰 王 超 孙海平 马艳凯
(河北省人民医院心内科,河北 石家庄 050051)
动脉粥样硬化(AS)发生与低密度脂蛋白胆固醇(LDL-C)水平呈正相关,在降低LDL-C的同时,升高高密度脂蛋白胆固醇(HDL-C)及增加逆胆固醇转运(RCT)不仅能有效抗AS,还能有效逆转 AS斑块。ATP结合盒转运体(ABCA1)是升高HDL-C及增加RCT的关键基因〔1〕。生理情况下,进入细胞内的胆固醇,特别是氧化型低密度脂蛋白胆固醇(ox-LDL)以及乙酰化低密度脂蛋白胆固醇(ac-LDL)均可通过肝脏X受体(LXRα)途径调节ABCA1的表达〔2〕;过氧化物酶体增殖物活化受体γ(PPARγ)也可通过肝脏LXRα调节ABCA1基因的表达。非诺贝特是PPARα的配体,可升高HDL-C浓度,减少AS的形成。本文拟研究非诺贝特是否通过影响ABCA1基因的表达而发挥抗AS作用以及其分子机制。
1 材料与方法
1.1 实验动物及分组 30只雄性健康 Wistar大鼠,体重100~120 g,2月龄,购自河北医科大学实验动物中心,合格证编号708160。适应性喂养1 w后,测量体重及血脂水平。随机分为3组:正常对照组10只、高脂模型对照组10只、非诺贝特药物干预组10只。全部动物均在同一实验室按清洁级大鼠要求专人饲养,自由进食水。实验过程符合中华人民共和国的《实验动物管理条例》及伦理要求。
1.2 实验方法 应用RT-PCR方法测量各组肝脏和血管中PPARγ mRNA,LXRα和ABCA1 mRNA的表达。应用Western印迹方法测量肝脏和血管中PPARγ,LXRα和ABCA1蛋白的表达。
2 结果
2.1 非诺贝特对大鼠肝脏、血管PPARγ mRNA及蛋白表达的影响 高脂模型组肝脏PPARγ mRNA及蛋白表达水平分别为0.18±0.01和0.35±0.01,与正常对照组(0.17±0.01和0.32±0.01)相比虽然有轻度的升高,但差异无统计学意义(P>0.05)。主动脉PPARγ mRNA及蛋白表达水平较正常对照组分别提高了1.21倍和1.15倍,与正常对照组(0.29±0.02和0.20±0.00)相比差异无统计学意义(P>0.05)。非诺贝特药物干预后大鼠肝脏的PPARγ mRNA为0.27±0.02,主动脉PPARγ mRNA为0.39±0.02,与模型组比较虽有升高,但差异无统计学意义(P>0.05);大鼠肝脏PPARγ蛋白表达为0.39±0.02,主动脉PPARγ蛋白表达为0.26±0.01,表达水平有不同程度的升高,变化趋势与mRNA的表达趋势一致。见图1~图4。
2.2 非诺贝特对大鼠肝脏、血管LXRα mRNA及蛋白表达的影响 高脂模型组大鼠肝脏、主动脉的LXRα mRNA及蛋白表达水平与正常对照组相比差异无统计学意义(P>0.05)。非诺贝特药物干预后大鼠肝脏LXRα mRNA为0.60±0.08,主动脉LXRα mRNA为0.82±0.07,与模型组比较差异有统计学意义(P<0.05);大鼠肝脏LXRα蛋白表达为0.34±0.01,主动脉LXRα蛋白表达为0.41±0.01,表达水平均升高,变化趋势与mRNA的表达趋势一致。见图1~图4。

图1 各组大鼠肝脏PPARγ、LXRα、ABCA1 mRNA表达

图2 各组大鼠主动脉PPARγ、LXRα、ABCA1 mRNA表达

图3 各组大鼠肝脏PPARγ、LXRα、ABCA1蛋白表达
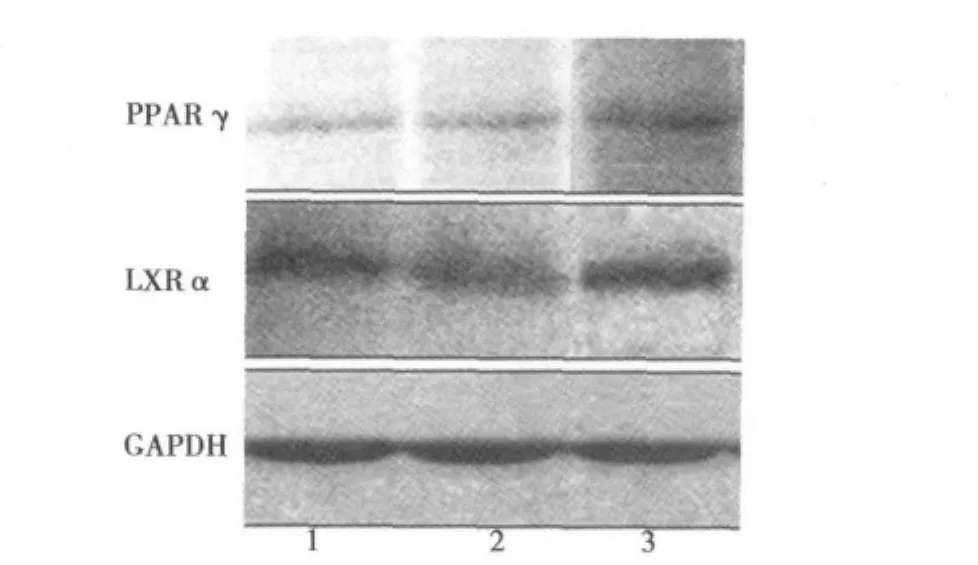
图4 各组大鼠主动脉PPARγ、LXRα蛋白表达
2.3 非诺贝特对肝脏、血管ABCA1 mRNA和蛋白表达的影响高脂模型组肝脏ABCA1 mRNA及蛋白表达水平分别为0.65±0.08和0.28±0.01,与正常对照组(0.55±0.03和0.25±0.01)相比虽然有轻度的升高,但无统计学差异(P>0.05),主动脉ABCA1 mRNA及蛋白表达水平分别提高了1.157倍和1.16倍,与正常对照组(0.57±0.06和0.25±0.01)相比无统计学差异(P>0.05)。非诺贝特药物干预后大鼠肝脏ABCA1 mRNA为0.90±0.08,主动脉ABCA1 mRNA为1.08±0.09,较模型组明显升高,差异有统计学意义(P<0.05);大鼠肝脏ABCA1蛋白表达为0.50±0.02,主动脉ABCA1蛋白表达为0.51±0.02,表达水平有不同程度的升高,与模型组相比具有统计学差异(P<0.05)。见图1~图3。
3 讨论
AS是一种多因素参与的疾病,其病因尚不完全清楚。大量胆固醇脂在巨噬细胞内积聚,形成泡沫细胞,这是AS形成早期的特征性病理生理过程。研究表明HDL-C通过参与胆固醇逆转运(RCT)发挥抗动脉粥样硬化作用,与AS、冠心病发病危险呈负相关。HDL-C的AS保护作用的关键机制是胆固醇逆转运(RCT),已经证明ABCA1的主要作用是将细胞内胆固醇和磷脂转运至细胞膜外并与apoA-I相结合,形成新生HDL颗粒,启动RCT过程。因此,ABCA1在RCT和HDL-C生成的起始步骤中起重要作用。研究发现,ABCA1的表达水平与血浆中HDL水平相关 ,即ABCA1表达增加,血浆中HDL水平随之增加〔3〕。本研究结果表明,建立模型后,HDL-C升高和ABCA1轻度升高,原因如下:考虑血脂增高后,刺激胆固醇外流,增加巨噬细胞和成纤维细胞内胆固醇含量可显著增加ABCA1的表达并提高载脂蛋白介导的脂质流出。除了胆固醇外,氧化固醇也明显诱导巨噬细胞ABCA1表达。ABCA1途径受损与动脉粥样硬化性炎症和代谢紊乱有关,所以ABCA1通路是治疗心血管疾病的靶点。
非诺贝特属于氯贝丁酸衍生物类血脂调节药,通过抑制ox-LDL和TG的生成并同时使其分解代谢增多,降低血LDL-C、TC和TG;非诺贝特还通过减少胆固醇脂转移蛋白的表达升高高密度脂蛋白。吴信超等〔4〕认为使用非诺贝特治疗,降低甘油三酯有效率为90%,降低胆固醇为74%,增加高密度脂蛋白为67%。说明非诺贝特主要是降低甘油三酯,并兼有降低胆固醇和升高HDL-C作用,贝特类还可诱导HDL受体(如SR-B1/CLA-1和ABCA1)过分表达,从而增加细胞胆固醇外流,所以,贝特类可通过增加“逆向胆固醇转运”而减少动脉硬化。本研究表明,非诺贝特能降低甘油三酯,升高HDL-C,能升高ABCA1的表达,可能一种机制是通过对脂质、脂蛋白的影响,其机制尚需进一步探讨。本实验显示:ABCA1 mRNA和蛋白质的分布并不总一致的,说明存在着转录后的调控,在培养的巨噬细胞中,ABCA1 mRNA和蛋白质以很快的速度降解,而apoA-Ⅰ和apoA-Ⅱ阻止了THP-1细胞中的ABCA1降解,与HDL无关。说明存在一种稳定调节ABCA1表达的因子,具体机制有待探讨。目前研究比较多的在转录水平上调节ABCA1的因子就是肝X受体/视黄醇X受体(LXRα/RXR)。当配体与它们结合后,核受体LXR和RXR形成异源二聚体,受氧化胆固醇和视黄酸所激活,然后结合到ABCA1启动子的识别序列DR-4上,增强ABCA1基因的转录。通过对LXR/RXR与ABCAI的基因启动子相结合研究表明,利用LXR/RXR途径可促进ABCA1基因的转录,促进外周细胞内胆固醇流出,防止泡沫细胞的形成,从而可以防治AS。
PPARs属于核激素受体超家族成员。研究发现PPARs有α、β、γ三种亚型,可以通过与LXR或RXR结合,进一步调节如ABCA1等的靶基因的表达。PPARγ通过调控靶基因的表达,增加ABCA1的表达,对动脉粥样硬化有抑制作用。近来研究发现,PPAR-γ的人工合成配体罗格列酮能上调ABCA1蛋白的表达〔5〕,实验研究可能通过PPAR-LXR-ABCA1路径而实现。因此,PPAR-α和PPAR-γ激动剂很可能是间接通过活化LXR/RXR途径来上调ABCA1基因转录的,通过上调LXR-α促进胆固醇逆转运蛋白的转录,加速胆固醇逆转运出巨噬细胞而发挥抗AS作用〔3〕。PPARγ还具有促进巨噬细胞凋亡,抑制一些炎性因子的作用,并可抑制内皮素的释放,诱导内皮细胞释放利钠肽,使血管扩张、改善血管张力发挥其抗AS的作用继而减轻斑块的形成,可能对AS的防治具有重要意义。
本实验显示了应用非诺贝特后,肝脏和血管ABCA1升高,同时LXRα明显升高,但PPARγ无明显升高,表明他的作用可能是通过其他途径实现。PPAR是配体倚赖的转录因子,是细胞核激素受体超家族中的一员,在众多的细胞转录调控中起重要作用,PPARα主要调节脂质代谢和炎症调控,是贝特类的分子靶标。延长非诺贝特作用时间以及提高非诺贝特药物浓度都可引起冠心病患者外周血 ABCA1基因表达上调,同时PPARα的表达也上调,作用于LXR/RXR途径,从而引起人ABCA1转录过程的加强。
很多文献研究许多ABCA1基因的调节因素,但是大部分的机制目前尚不太清楚,而且大多处于动物实验阶段,需要进一步阐明人的ABCA1基因的调节机制。深入研究ABCA1的功能及其表达的调控机制,无论对于脂代谢、AS、冠心病的治疗,还是针对这一环节的新药开发,都具有十分重要的意义。
1 Soro-Paavonen A,Naukkarinen J,Lee-Rueckert M,et al.Common ABCA1 variants,HDL levels,and cellular cholesterol efflux in subjects with familial low HDL〔J〕.J Lipid Res,2007;48(6):1409-16.
2 Attie AD.ABCA1:at the nexus of cholesterol,HDL and atherosclerosis〔J〕.Trends Biochem Sci,2007;32(1):172-9.
3 Hossain MA,Tsujita M,Gonzalez FJ,et al.Effects of fibrate drugs on expression of ABCA1 and HDL biogenesis in hepatocytes〔J〕.J Cardiovasc Pharmacol,2008;51(2):258-66.
4 吴信超,王晓霞.微粒化非诺贝特治疗49例高脂血症疗效观察〔J〕.人人健康(医学导刊),2008;20(2):16-7.
5 苟连平,吕 湛,秦 俭.腺苷三磷酸结合盒转运蛋白A1在动脉粥样硬化中的作用及其受控特点〔J〕.中国组织工程研究与临床康复,2007;11(10):1943-6.

