磷脂脂质体对三种天然黄酮化合物稳定作用
龚双梅,赵良容,张荣荣,李晓波,杨昌英
天然产物研究与利用湖北省重点实验室三峡大学,宜昌 443002
天然黄酮类化合物生理活性丰富并且广泛存在于自然界,其抗氧化作用的研究已引起国内外学者的高度重视,其体外抗氧化作用主要包括直接清除超氧阴离子、羟自由基、脂质过氧化自由基等活性氧自由基、螯合金属离子,抑制 LDL及DNA氧化损伤。但因其稳定性差、溶解性差、生物利用度不高,并存在一定毒性等缺点而限制了它们的临床应用。近年来,包封黄酮的脂质体药物的研究不断涌现[1-3],其目的包括:利用脂质体的双层组装结构增加药物稳定性,减缓其本身的氧化失活过程;利用脂质体的生物相容性好,具有靶向给药的功能,提高药物的溶解性和生物利用度,减少药物毒性。
除此之外,抗脂质过氧化是黄酮化合物的重要活性之一,黄酮与脂质双层膜结合,可以阻止氧化性成分对生物膜的攻击,同时可以螯合易引发脂质过氧化的金属离子,从而达到保护生物膜,抑制脂质过氧化的目的。本文以木犀草素,槲皮素和山奈酚三种母体结构相同的黄酮类化合物为研究对象(结构如下图),以超声法制备卵磷脂脂质体,采用生物膜探针1-苯胺基-8-萘磺酸铵(ANS)研究化合物与脂质体相互作用性质[4,5]的基础上,通过在脂质体环境中化合物的酸离解能力及与铝离子螯合能力的评价,探讨化合物与脂质双层的亲和性质,及脂质体稳定化合物结构和性质的分子机制。

图1 三种黄酮的结构Fig.1 Structures of three flavonoids
1 仪器与方法
1.1 仪器及试剂
UV-3010紫外可见分光光度计(日本日立公司);F-4500荧光分光光度计(日本日立公司);槲皮素 (Quercetin,Que),山奈酚 (Kaempferol,kae),木犀草素(Luteolin,Lut),购于南京TCM中药研究所,98%(HPLC),实验前以无水乙醇/水(7/3)配制成浓度为2×10-3mol/L储备液;8-苯胺基-1-萘磺酸铵(8-anilinonaphthalene-1-sulphonic acid ammonium salt,ANS),购自 Fluka 公司,纯度≧ 97%,配制 0.05 mol/L的水溶液,避光保存。卵磷脂(EPC),中国医药集团上海化学试剂厂产品,常用试剂均为国产分析纯;实验用水为二次亚沸水。实验前配置pH=7.24的Tris-HCl缓冲液备用。
1.2 脂质体的制备
称取50 mg卵磷脂,溶解于5 mL有机溶剂(氯仿/甲醇:9/1)中,于30℃旋转蒸发除去有机溶剂,通N210 min除去残留溶剂。然后加入50 mL Tris-HCl缓冲液,在N2保护下40℃温浴10 min,在旋涡混合器上混匀1 min。保持低温,继续在N2保护下间断性的超声5 min(加冰块0℃),直到体系均匀分散。在2~4℃以3000 rpm的速度低温离心20 min,取上层清液。得到半透明的10 mg/mL的EPC脂质体,于4℃ N2氛围下贮存,三天内使用[6]。
1.3 光谱测定
1.3.1 ANS与载药脂质体相互作用的荧光光谱
在含有5%(v%)脂质体的双蒸水中,加入ANS储备液至浓度为1.0×10-4mol/L,用荧光分光光度计记录ANS在脂质体中的荧光光谱,荧光发射光谱的检测条件:360 nm处激发,扫描速度:2400 nm/min,激发和发射狭缝宽度均为10 nm,记录370~650 nm范围内的荧光发射光谱。然后依次加入10 uL 2.0×10-3mol/L的黄酮,混合均匀,5 min后扫描荧光光谱。
在含有5%(v%)脂质体,2.0×10-5mol/L黄酮化合物的双蒸水中,依次加入4 uL 0.05 mol/L的ANS,混合均匀,扫描荧光。
1.3.2 黄酮化合物酸解离常数pKa的紫外-可见吸收光谱法测定
在含有5%(v%)脂质体,2.0×10-5mol/L黄酮化合物的水溶液中,采用H2SO4,NaOH调节溶液酸碱度,采用紫外-可见分光光度计在200~500 nm范围测定化合物的吸收光谱,同时准确测定溶液pH值。同时测定没有脂质体存在时的化合物吸收谱及pH值。
1.3.3 Al3+与载药脂质体相互作用的紫外-可见光谱响应

图2 木犀草素对5%脂质体中的ANS荧光光谱的影响;(B)三种黄酮引起的ANS荧光猝灭的剂量关系。Fig.2 The effect of Luteoin on the fluorescence spectra of ANS in presence of 5%liposomes.The concentration of flavonoids corresponding to 0-10:0-10,0 × 10-5mol/L,λex=340 nm.ANS at a concentration 1.0 × 10-4 mol/L.(B)Dose-dependent effects of three flavoniods on fluorescence of 1.0 ×10-4mol/L ANS in presence of 5%liposomes.
将含有5%(v%)脂质体,2×10-5mol/L黄酮化合物的体系超声1 min,静置,逐次加入2 uL 0.01 mol/L硝酸铝溶液,混合均匀,5 min后以水做参比,波长范围220~500 nm,扫描吸收光谱。对照组试验不含脂质体。
2 结果与讨论
2.1 黄酮化合物对脂质体结构的影响
ANS在水溶液中的荧光很弱,与脂膜结合后,荧光强度显著增强[7],因此用于标记细胞膜。由于ANS定位于脂质双层与水的交界面上,即亲水和疏水相的界面,在疏水区有强烈的荧光而在水中猝灭.它不与膜的特定区域结合,外源物质(如药物小分子)的存在可能会影响 ANS与脂双层的结合,从而可以间接考察药物与脂双层的相互作用或药物对脂双层结构带来的影响[8],即脂双层中磷脂分子的极性基端运动的程度[9,10]。如图1A,在脂质体环境中(5%),ANS在530 nm左右有强荧光峰,木犀草素的加入使ANS荧光强度降低并不伴随发射峰位的红移,说明荧光强度的降低不是由于ANS分子极性环境的改变引起的,而是由于它所结合的膜脂环境的粘滞性变化,即流动性增加引起的[4]。
表1 化合物对脂质体中ANS的表观荧光猝灭常数Table 1 of flavonoids for ANS fluorescence in liposomes

表1 化合物对脂质体中ANS的表观荧光猝灭常数Table 1 of flavonoids for ANS fluorescence in liposomes
Drug Luteolin Kempferol Quercetin Kqapp(104L/mol)3.4119 0.7543 0.7209
Stern-Volmer方程I0/I=1+KSV[Q]广泛适用于荧光猝灭现象,但是当猝灭剂分布于膜相和水相之间时,仅处于膜上的猝灭剂分子[Q]m才可以猝灭膜相中ANS的荧光,所以通过药物总浓度得到的猝灭常数应为表观猝灭常数[11]。在低浓度进行线性拟合,得到三种化合物对ANS荧光的表观猝灭常数,列于表1。表观猝灭常数与药物在两相中的分配系数密切相关。三种化合物中,荧光猝灭常数木犀草素明显最大,其次是山奈酚,最小的是槲皮素。表明木犀草素在脂质双层中的分配系数大,与脂双层的亲和性好,木犀草素在水中的溶解度低,容易进入疏水性的脂双层,从而明显增加膜的流动性。细胞膜脂质过氧化会导致细胞膜损伤,膜不饱和脂肪酸减少,膜脂的流动性降低,预测木犀草素能明显抑制脂质过氧化过程。
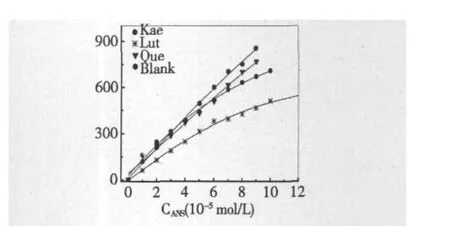
图3 脂质体中5×10-5mol/L黄酮的存在对ANS荧光强度剂量关系的影响Fig.3 Dose-dependent effects of ANS in liposomes containing 5 ×10-5mol/L flavonoids.
为了进一步考察黄酮与脂质体的结合性质,将黄酮(5×10-5mol/L)与脂质体(5%)结合后,检测探针ANS的荧光强度剂量关系,如图3,在脂质体环境中,ANS的荧光强度与其浓度基本呈线性关系,而脂质体中黄酮的存在会使ANS的荧光强度受到影响,但槲皮素和山奈酚的影响并不明显,只在ANS高浓度范围产生一定影响,而木犀草素的存在会明显降低ANS的发光强度。由于木犀草素的结合导致膜结构改变,流动性增加,疏水性降低,ANS的发光受到抑制,不再满足线性的剂量关系。
因此,三种化合物可以不同程度地进入脂双层结构,已经有文献证明,槲皮素结合在脂质膜的极性头部,并不能进入脂双层内部[12],因此对膜结构不会产生明显影响。木犀草素能进入脂质双层与水的交界面,参与脂质双层结构的重新组装,处于脂质结构的包围之中,预示脂质膜能起到对木犀草素结构的保护作用。
2.2 黄酮化合物在脂质体中的质子解离常数pKa
酸质子解离常数pKa是药物的重要理化参数。由于黄酮化合物在不同pH的缓冲液中紫外吸收光谱存在较大差异,因此,可以利用分光光度法测定其解离常数。随着环境pH不同,黄酮化合物的紫外吸收光谱中出现成对的质子化峰和去质子化峰,随着碱性增强,质子化峰逐渐下降,去质子化峰的峰值逐渐升高,表明黄酮化合物的酚羟基上的质子解离。如图4A,木犀草素水溶液随着pH增大,345 nm的最大吸收峰发生红移,峰值先减小后增大,化合物本身的特征峰消失,在395 nm处形成了一个新的稳定的吸收带,形成明显的等色点。将化合物两个波长处对应的吸收值分别对pH值作图,得到两条S型曲线,交叉点即对应于等色点,此时化合物的中性形态及去质子化态处于平衡,此时的pH可近似作为化合物的 pKa[13,14]。

图4 稀碱(NaOH)对木犀草素的紫外可见光谱的影响;(B)脂质体中木犀草素在345,395 nm处的吸光度随溶液pH变化曲线(内插图为化合物在水中的情况)Fig.4 UV-Vis spectra of 2 ×10-5mol/L luteolin in water with varying concentration(1.0 ×10-5to 2.1 ×10-4mol/L)of NaOH;(B)Curves of absorbance at 345nm/395nm of luteolin vs pH in the presence of 5%(V%)EPC liposomes.Inset:Curves in water without liposomes.
在含5%脂质体中,木犀草素的吸收峰随着体系pH值变化的规律是一致的,但出现等色点对应的pH明显不同,脂质体本身吸光度值小,对黄酮化合物的紫外吸收光谱没有干扰。图4B是木犀草素在脂质体环境中两个波长对应的吸收度与pH的关系曲线,在水中的情况以内插图显示,可见,在5%的脂质体中,木犀草素的345 nm的吸收峰随着pH变化幅度较小,但395 nm处的吸收峰增大较快,形成的等色点对应的pH明显比在水中大。脂质体中木犀草素 pKa明显增大,为8.06(水中 pKa=7.04)。表明在脂质体环境中,木犀草素由于与脂质结合,进入脂质双层结构,化合物的酚羟基质子离域能力减弱,去质子化变得困难。用同样方法测得槲皮素和山奈酚的pKa,结果列于表2,两者在脂质体环境中的pKa与水中相比分别降低了0.29,0.32。因此,在脂质环境中,槲皮素虽结合于脂双层的极性头部,不能完全进入脂质环境,但与游离态相比,结构仍然受到限制,在一定程度上影响了化合物的去质子化能力。相比之下,脂质双层对木犀草素的稳定和保护作用更明显,在中性条件下,化合物难于去质子化。黄酮含有多个酚羟基,可以提供活泼的H而发生自氧化过程,导致化合物不稳定[15]。将化合物包埋于脂质体中,可以起到稳定化合物,防止自氧化的目的。由本实验结果看出,三种化合物虽然母体结构完全相同,但脂质体对化合物的稳定作用也存在明显差异,木犀草素与脂质体作用亲和性好,能进入脂质双层,明显提高化合物稳定性,而槲皮素和山奈酚与脂质体作用较弱,不能完全包埋于脂质双层,只能在一定程度上起到稳定作用。

表2 化合物在脂质体中pKa变化值Table 2 Comparison of pKa of flavonoids in liposomes with that in water
2.3 三种黄酮化合物在脂质体中与Al3+的螯合作用
天然黄酮由于含有多个酚羟基,易与金属离子螯合,一方面通过螯合作用达到抑制由Fe2+,Cu2+等引发的脂质过氧化;另外,黄酮与有些金属离子的螯合物可以发挥更明显的生物活性。近年来,Al3+被认为是一种具有明显神经毒性的物质,易引起老年痴呆,其机制主要与铝促脂质过氧化有关。本文考察在脂质体环境中的黄酮与铝的螯合性质,一方面探讨脂质体对化合物螯合能力的影响,同时实验化合物在脂质环境中捕获Al3+的能力。
图5 A,B分别是在含有2.0×10-5mol/L木犀草素的水溶液中及载有相同浓度的木犀草素的脂质体(5%)中依次加入Al3+,记录的紫外吸收光谱。木犀草素与Al3+螯合能力强,较低浓度的Al3+能很快与化合物螯合。木犀草素由自身的特征吸收峰(345 nm)到形成稳定的螯合峰(400 nm),形成等色点,在水中紫外吸收光谱随Al3+的加入变化明显,而在脂质体中图谱变化十分缓慢。说明脂质体对黄酮化合物与Al3+螯合具有减缓、阻碍作用,即黄酮化合物的质子转移变得困难,使得Al3+与黄酮化合物的螯合变得困难。
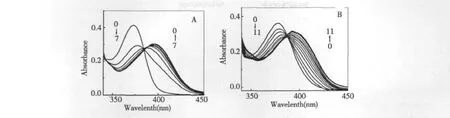
图5 Al3+加入对水溶液(A),脂质体(B)中木犀草素紫外可见光谱的影响Fig.5 UV-Vis spectra of 2.0 ×10-5mol/L luteolin in the presence of Al3+of varying concentration(1.0 ×10-5mol/L to1.3 ×10-4mol/L)in water(A),and in 5%liposomes(B).C(Al3+)=1.0-8.0 ×10-5mol/L.
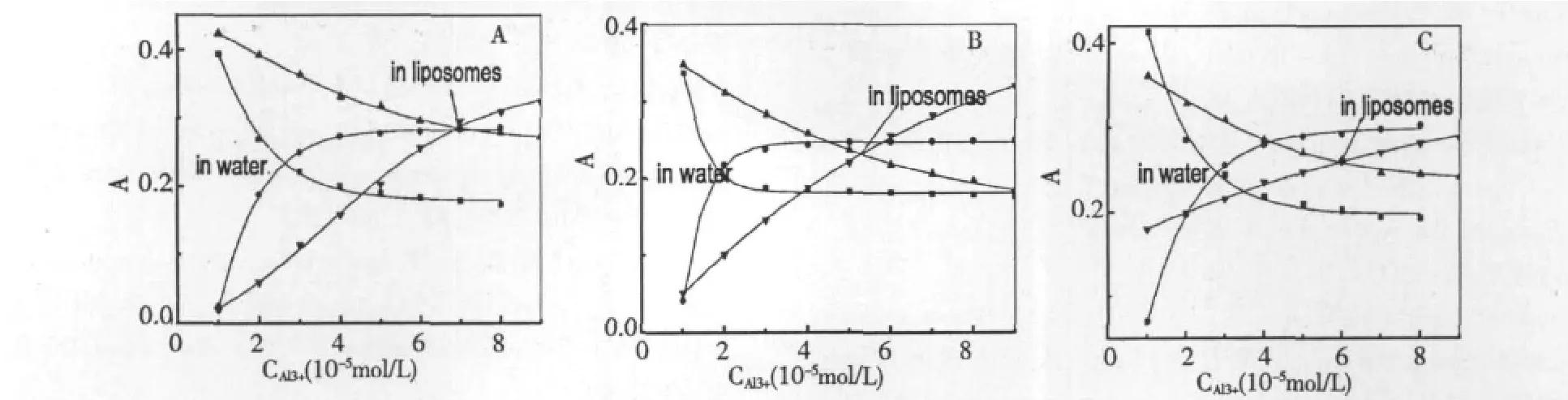
图6 化合物(螯合物)的吸光度随Al3+浓度变化曲线Fig.6 Curves of absorbances of flavonoids(flavonoid-Al complexes)vs concentration of Al3+in water or in liposomes.
对另外两种化合物的实验可得出类似的结论,将三种化合物与螯合引起的两组吸收峰的吸光度对应于Al3+浓度做曲线拟合,得到图6,可以看出,在脂质体环境中,化合物的游离态与铝复合物达到平衡时所需要的Al3+浓度明显高于水环境。水中的木犀草素,只需要2.6×10-5mol/L的Al3+即可达到平衡,而包裹在脂质体中的木犀草素则需要6.0×10-5mol/L的Al3+,这种现象可能是由于黄酮化合物包裹在脂质体中与膜相互作用,改变了脂质体膜的物理性质[16],降低了Al3+进入脂质体的几率,木犀草素主要与进入脂质体中的Al3+结合,因此需要更高浓度的Al3+,同时,脂质体环境中的木犀草素酚羟基活性降低,也是螯合能力下降的重要原因。
三种化合物与脂质体的作用强度差异较大,但在脂质环境中螯合Al3+的能力并未表现出明显差异,推测原因是三种化合物进入脂质体系的程度不同,膜结构产生差异,Al3+进入膜体系的几率会不同。木犀草素虽然在脂质内部,但膜的流动性增加会导致Al3+进入膜体系的几率降低,能与其螯合的程度也会减少。槲皮素和山奈酚的水溶性较好,只能结合于脂质外层的极性头部,与水环境中的Al3+螯合,因此也保持着较强的螯合能力。因此三种化合物都能明显抑制由Al3+引发的脂质过氧化。
3 结论
三种黄酮化合物槲皮素,山奈酚及木犀草素虽然母体结构相同,但不同位置的酚羟基会导致化合物的溶解性差异,更会导致化合物在脂质双层的分配,与脂质体结合程度的差异,木犀草素能进入脂质双层内部,而槲皮素和山奈酚主要结合于脂双层外部的极性头部,因此脂质环境中的木犀草素酚羟基去质子化能力显著降低,pKa明显增大,而后两种化合物的pKa受脂质体影响较小。在脂质环境中,三种化合物与Al3+的螯合能力显著下降,但差异并不明显,虽然木犀草素能进入脂质双层,但膜流动性的增加会导致Al3+进入脂质环境变得困难,因此螯合能力也明显下降,进一步证实木犀草素与脂质体有较好的亲和性。卵磷脂脂质体能对木犀草素起到明显的稳定和保护作用,但对槲皮素和山奈酚作用较弱。
1 Li MJ(李明静),Zhang L(张丽),Zhao DB(赵东保),et al.Solubility Behavior of Luteolin-7-O-β-D-glucoside in Molecular Aggregates.Acta Chem Sinica(化学学报),2009,67:1950-1956.
2 Ghosh D,Ghosh S,Sarkar S.Quercetin in vesicular delivery systems:Evaluation in combating arsenic-induced acute liver toxicity associated gene expression in rat model.Chem Biol Interac.2010,186:61-71.
3 Lin QL(林亲录),Wang J(王婧),Qin D(秦丹).Effect of bio-affinity structure on the stability of different soluble phenol compounds.Sci China Ser B Chem(中国科学 B辑:化学),2006,36:347-352.
4 Xian M(咸漠),Xu QL(徐庆伦),Ren YL(任玉林),et al.Effects of Salidroside on Fluidity of Human Erythrocyte Membranes.Acta Sci Nat Univ Jilinensis(吉林大学自然科学学报),1998,4:44-46.
5 Chen KS(陈靠山),Liu SM(刘世名),Xia K(夏凯),et al.Research on increase of membrane fluidty of plant mitochondria abscisic acid with ANS.Acta Biophys Sinica(生物物理学报),2000,16:237-241.
6 Lichtenberger LM,Wang ZM,Romero JJ,et al.Non-steroidal anti-inflammatory drugs(NSAIDs)associate with zwitterionic phospholipids:insight into the mechanism and reversal of NSAID-induced gastrointestinal injury.Nat Med,1995,1:154-158.
7 Guo R(郭荣),Xi JQ(奚菊群).Interaction between puerarin with EPC liposomes.Chin Sci Bull(科学通报),2007,52:1997-2002.
8 Yang CY(杨昌英),Liu Y(刘义),Li QG(李强国),et al.Interaction of Three Non-steroidal Anti-inflammatory Drugs with Egg Phosphatidylcholine Liposomes.Acta Phys Chem Sin(物理化学学报),2007,23,635-640.
9 Mitsuru S,Akira H,Michiya K.Effect of membrane surface potential on the uptake of anionic compounds by liposomes.Biochim Biophys Acta Biomembranes,1994,1192:241-246.
10 Maurice B.Reactions of Flurescent Probes with Normal and Chemically Modified Myelin.Biochemistry,1975,14:3041-3048.
11 Baltazar C,Paula G,Jose LFCL.Location and partition coefficients of anti-inflammatory drugs in EPC liposomes.A fluorescence quenching study using n-(9-anthroyloxy)-stearic probes.Colloids and Surfaces A:Physicochem.and Eng.Aspects,2001,190:205-212.
12 Pawlikowska-Pawlega B,Gruszecki W I,Misiak L.Modification of membranes by quercetin,a naturally occurring flavonoid,via its incorporation in the polar head group.Biochim Biophys Acta,2007,1768:2195-2204.
13 Khalafi L,Rohani M,Afkhami A.Acidity constants of some organic acids in the presence of(-cyclodextrin in binary ethanol-water mixtures by rank annihilation factor analysis.J Chem Eng Data,2008,53:2389-2392.
14 Lim H,Zhang HB,Barra M.Spectrophotometric determination and linear free energy relationship analysis of acidity constants for 1,3-diphenyltriazenes.J Chem Eng Data,2010,55:4917-4921.
15 Yu ML(俞梅兰),Yu YY(余燕影),Cao SW(曹树稳),et al.Investigation on the effects of quercetin self-oxidation on its super oxygen-anion free radical scavenging ability.Sci Tech Food Ind(食品工业科技),2006,27:75-78.
16 Oteiza I,Erlejman G,Verstraeten V,et al.Flavonoid-membrane interactions:a protective role of flavonoids at the membrane surface.Clin Dev Immunol,2005,12:19-25.

